日本平腹小蜂滯育幼蟲的重要生化物質變化
劉子欣 夏玥 吳其峰 趙燦 李敦松


摘要 :日本平腹小蜂是多種果樹蝽類害蟲的優勢寄生蜂,能以老熟幼蟲滯育越冬。本研究分別測定了日本平腹小蜂非滯育老熟幼蟲、滯育25、35、45、55 d老熟幼蟲和滯育解除老熟幼蟲體內的總蛋白、脂類、糖類及醇類等生化物質的含量,以及海藻糖酶和抗氧化酶(超氧化物歧化酶、過氧化物酶、過氧化氫酶)等關鍵酶的活性變化,比較了日本平腹小蜂滯育、非滯育和滯育解除老熟幼蟲體內重要生化物質的差異。結果表明:滯育老熟幼蟲顯著積累脂類、甘油三酯、糖原等能源物質以及山梨醇等低溫保護物質,且滯育個體的抗氧化能力顯著增強,這些變化有助于提高其抗逆性,滿足滯育維持期及滯育解除后恢復發育的能量需求,保證滯育個體的發育和存活。結果為解析日本平腹小蜂的滯育機制奠定了基礎。
關鍵詞 :日本平腹小蜂; 滯育; 蛋白質; 脂類; 抗氧化酶
中圖分類號:
S 436.67
文獻標識碼: A
DOI: 10.16688/j.zwbh.2021370
Physiochemical changes in diapause larvae of Anastatus japonicus Ashmead
LIU Zixin1,2, XIA Yue1, WU Qifeng1,2, ZHAO Can1*, LI Dunsong1
(1.Guangdong Provincial Key Laboratory of High Technology for Plant Protection, Plant Protection
Research Institute, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China;
2. College of Plant Protection, South China Agricultural University, Guangzhou 510642, China)
Abstract
Anastatus japonicus Ashmead is the dominant parasitic wasp of various fruit tree stink bugs.It can overwinter through diapause of mature larvae.In this study, we measured the content of biochemical substances such as total protein, lipids, saccharides and alcohols, as well as enzyme activities of trehalase and antioxidant enzymes (SOD, POD, CAT) in the non-diapause mature larvae, diapausing mature larvae (25, 35, 45, 55 d) and diapause-terminated mature larvae of A.japonicus.The results showed that energy substances resistant to low temperature, like lipids, triglycerides, glycogen and sorbitol were significantly accumulated in the diapause mature larvae.In addition, the antioxidant capability of diapause individuals was significantly enhanced.These changes may improve the resistance of A.japonicus to adverse environment, meet its energy requirements for the diapause maintenance and post-diapause development, and increase the survival ratio of diapause individuals.The results of this study provide information for understanding the mechanism of diapause of A.japonicus.
Key words
Anastatus japonicus; diapause; protein; lipids; antioxidant enzyme
日本平腹小蜂Anastatus japonicus Ashmead屬膜翅目Hymenoptera旋小蜂科Eupelmidae平腹小蜂屬Anastatus,是一種優良的寄生性天敵昆蟲,是田間防治果樹蝽類的主要蜂種[1]。滯育是由外界不良環境引起的,通過內源性調節所產生的一種發育停止的現象[23]。滯育技術在調控天敵昆蟲發育進度、延長天敵產品貨架期、適時釋放和提高天敵昆蟲抗逆性等方面具有極其重要的作用[4]。而目前,國內外對昆蟲滯育的研究主要集中在農業害蟲上,對害蟲天敵的研究占比不足10%[5]。我們前期研究發現日本平腹小蜂以老熟幼蟲滯育越冬,短光照和低溫是誘導其滯育的主要因子[6]。滯育的誘導、維持和解除常伴隨著一系列的生理生化變化,如積累能量儲備和低溫保護物質、降低代謝速率、提高抗逆性等,來度過滯肓期間的不良環境[7]。因此研究昆蟲在滯育過程中代謝物質的變化對揭示昆蟲滯育的生理生化和抗逆機制十分重要,將有助于解析昆蟲滯育的分子調控機理。
許多昆蟲在滯育前會大量積累脂類、蛋白質及碳水化合物等。一般而言,儲存的脂類物質是滯育昆蟲應對能量匱乏時期的主要營養物質[8],這些物質不僅為其生命活動提供能量,還可與糖、醇等物質相互轉化。滯育期間昆蟲儲存的碳水化合物有糖原、海藻糖、甘油、山梨醇等,這些物質一方面為滯育昆蟲提供能量、維持滯育期的代謝,另一方面作為冷凍保護物質提高昆蟲的過冷卻能力,穩定細胞膜和蛋白質結構,防止對細胞的滲透傷害,從而減輕低溫傷害[910]。如滯育東亞小花蝽Orius sauteri體內總糖、海藻糖、甘油、脂肪和抗逆性酶含量顯著高于發育個體,滯育個體的抗寒能力也顯著提高[11]。傘裙追寄蠅Exorista civilis滯育個體中糖原、甘油、海藻糖的含量顯著高于非滯育個體[12]。麗蠅蛹集金小蜂Nasonia vitripennis滯育期間顯著積累哌啶酸、脯氨酸和海藻糖等低溫保護物質,氨基酸和碳水化合物等的含量也變化顯著[13]。滯育期間昆蟲的抗氧化能力也會發生變化,且不同種昆蟲的變化并不完全相同。過氧化物酶(POD)、過氧化氫酶(CAT)、超氧化物歧化酶(SOD)是昆蟲體內重要的抗氧化系統保護酶。SOD清除昆蟲體內超氧化物,使之形成氧氣和過氧化氫, 過氧化氫被CAT和POD進一步分解從而防止自由基的毒害[14]。家蠶Bombyx mori滯育卵SOD活性顯著降低,CAT活性顯著高于非滯育預蛹[15]。白蛾周氏嚙小蜂Chouioia cunea 滯育個體SOD、CAT和POD的活性均低于非滯育的個體[16]。茶尺蠖Ectropis obliqua經冷馴化之后,SOD、CAT和POD活性顯著升高[17]。麗草蛉Chrysopa formosa[7]滯育期間SOD活性持續升高,顯著高于非滯育個體,POD活性下降,滯育個體的抗氧化防御能力顯著增強。綜上,這些生理生化物質的變化對于滯育個體的滯育維持和滯育之后的生長發育都有著重要的意義。
目前對日本平腹小蜂滯育的研究,僅限于對影響滯育的環境因子的探索,而對其滯育后代謝物質和生理機制的研究在國內外尚未見報道。本研究擬通過比較非滯育、滯育和滯育解除的日本平腹小蜂體內代謝物質變化,以期明確其體內主要生理生化物質在滯育過程中的變化趨勢,為揭示其滯育的生理機制奠定基礎。
1 材料與方法
1.1 供試蟲源
日本平腹小蜂來自北京野外收集的被寄生的茶翅蝽卵塊,由中國農業科學院植物保護研究所,農業農村部-CABI生物安全聯合實驗室提供,羽化出蜂后,經室內飼養擴繁幾代后作為供試蟲源。飼養方法:將羽化的平腹小蜂放入養蟲盒內,盒內放蘸有蜂蜜的脫脂棉為其補充營養。用滅活消毒的柞蠶剖腹卵作為替代寄主。供試蜂為3~5日齡已充分交配的成蜂,在24℃、光周期L∥D=16 h∥8 h、RH 70%、光照強度3 000 lx的人工氣候箱中寄生和發育。
1.2 試蟲處理
將已交配的3~5日齡成蜂放入養蟲盒內讓其寄生新鮮柞蠶Antheraea pernyi卵。將被日本平腹小蜂寄生2 d的新鮮柞蠶卵分別置于非滯育條件(24℃、光周期L∥D=16 h∥8 h、RH 70%)和滯育誘導條件(17℃、光周期L∥D=14 h∥10 h、RH 70%)的發育箱中。前期的研究表明日本平腹小蜂以老熟幼蟲滯育。非滯育樣品獲得:日本平腹小蜂在非滯育條件下發育約12 d到達老熟幼蟲,解剖取出老熟幼蟲,液氮速凍后置于-80℃待用。滯育樣品獲得:分別取滯育誘導25、35、45、55 d的老熟幼蟲,液氮速凍后置于-80℃待用。滯育解除樣品獲得:將滯育誘導55 d的日本平腹小蜂轉移到非滯育條件下放置12 d,取老熟幼蟲,液氮速凍后置于-80℃待用。
1.3 總蛋白質、總脂質及甘油三酯含量的測定
總蛋白質含量的測定參照BCA法蛋白定量測定試劑盒說明書(微量法,南京建成生物工程研究所),根據標準曲線計算出總蛋白質含量。每處理重復10次,試驗重復3次,每重復50 mg老熟幼蟲。
總脂質含量的測定采用香草醛濃硫酸顯色法[18],2.5 mg/mL的膽固醇溶液標準品用氯仿甲醇(V∶ V=2∶ 1)溶液稀釋成不同濃度,制作標準曲線。利用比色法測定樣品吸光度,查閱標準曲線計算出總脂含量。每處理設置生物學重復10次,技術重復3次,每個生物學重復20 mg老熟幼蟲。
甘油三酯含量的測定參照甘油三酯(TG)測定試劑盒說明書(北京索萊寶生物科技有限公司)。每處理設置生物學重復10次,技術重復3次,每個生物學重復50 mg老熟幼蟲。
1.4 糖原、海藻糖含量及海藻糖酶活性的測定
糖原、海藻糖含量的測定均采用蒽酮法,具體操作步驟分別參照糖原含量測定試劑盒說明書(北京索萊寶生物科技有限公司)和海藻糖含量測定試劑盒說明書(南京建成生物工程研究所);海藻糖酶活性檢測參照海藻糖酶活性檢測試劑盒說明書(北京索萊寶生物科技有限公司)。每處理設置生物學重復10次,技術重復3次,每個生物學重復50 mg老熟幼蟲。
1.5 甘油和山梨醇含量的測定
甘油含量的測定參照甘油含量測定試劑盒說明書(南京建成生物工程研究所),4 mmol/L甘油標準品用蒸餾水稀釋成不同濃度,制作標準曲線,重復3次。利用比色法測定樣品吸光度,根據標準曲線計算出甘油濃度。每處理設置生物學重復10次,技術重復3次,每個生物學重復50 mg老熟幼蟲。
山梨醇含量的測定參照山梨醇含量測定試劑盒說明書(北京索萊寶生物科技有限公司)。每處理設置生物學重復10次,技術重復3次,每個生物學重復50 mg老熟幼蟲。
1.6 SOD、POD和CAT活性的測定
超氧化物歧化酶(SOD)、過氧化物酶(POD)和過氧化氫酶(CAT)
活性的測定分別參照SOD、POD和CAT活性檢測試劑盒說明書(北京索萊寶生物科技有限公司)。每處理設置生物學重復10次,技術重復3次,每個生物學重復50 mg老熟幼蟲。
1.7 數據統計與分析
數據分析利用統計軟件IBM SPSS Statistics 25完成,各項生化物質含量及酶活性的比較采用 One-way ANOVA進行方差分析,各處理間的差異顯著性分析應用Tukey post-hoc檢驗法。所有數據以平均值±標準誤(mean±SE)表示。
2 結果與分析
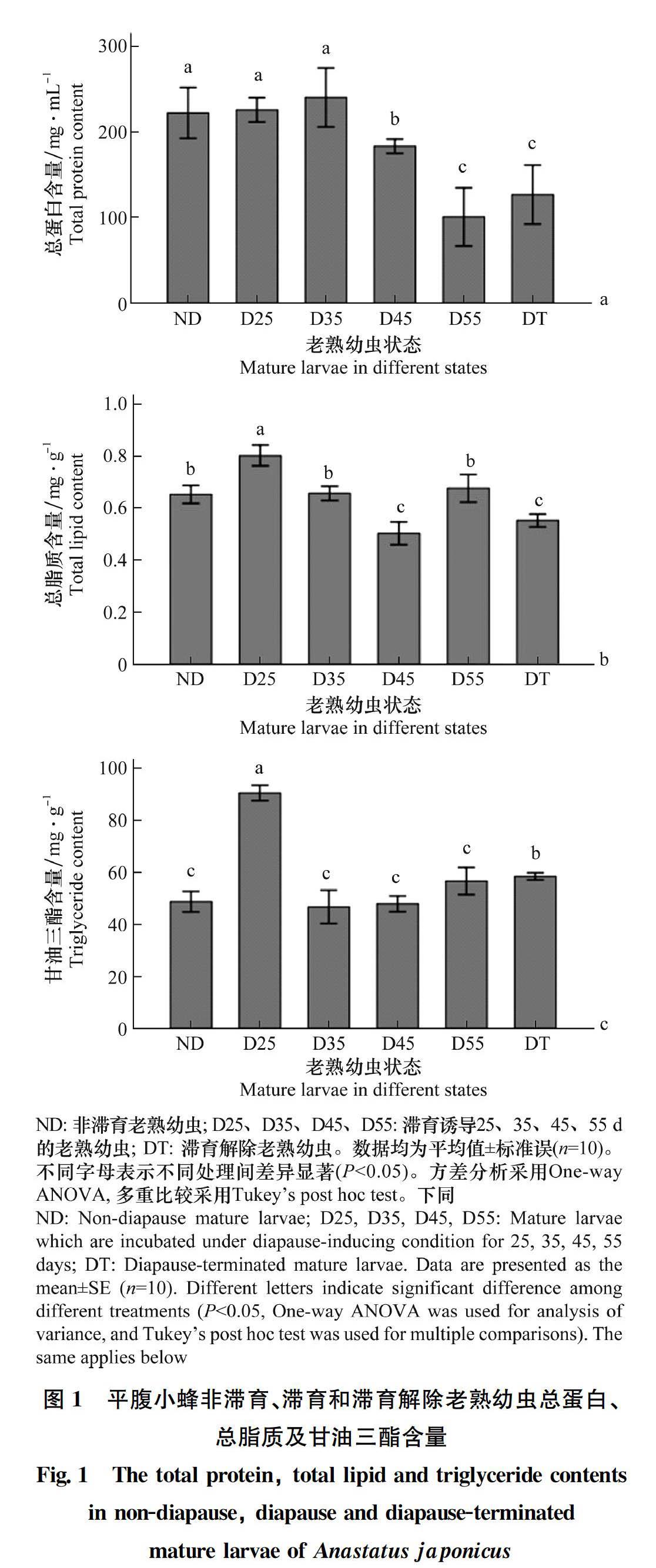
2.1 總蛋白、總脂質、甘油三酯含量的比較
日本平腹小蜂經滯育誘導25 d和35 d的老熟幼蟲總蛋白含量略有增加,但與非滯育老熟幼蟲相比無顯著差異(圖1a)。隨著滯育時間延長,滯育誘導45 d和55 d的個體總蛋白含量顯著下降(F 5,50=21.824, P<0.05)。滯育解除時總蛋白含量略有升高,但是與滯育誘導55 d的個體相比沒有顯著差異(圖1a)。滯育誘導25 d的老熟幼蟲總脂質含量顯著高于非滯育老熟幼蟲(F 5,50=26.521, P<0.05)。隨著滯育時間延長,滯育誘導35 d和45 d的個體總脂質含量顯著降低,其中滯育誘導45 d的老熟幼蟲總脂質含量顯著低于非滯育老熟幼蟲。滯育誘導55 d的個體總脂含量又有所升高,和非滯育個體無顯著差異(圖1b)。甘油三酯含量在滯育誘導25 d時顯著高于非滯育個體(F 5,46=45.531, P<0.05),滯育誘導35、45 d和55 d的個體甘油三酯含量下降,但與非滯育個體沒有顯著差異。滯育解除時甘油三酯含量又顯著升高(圖1c)。
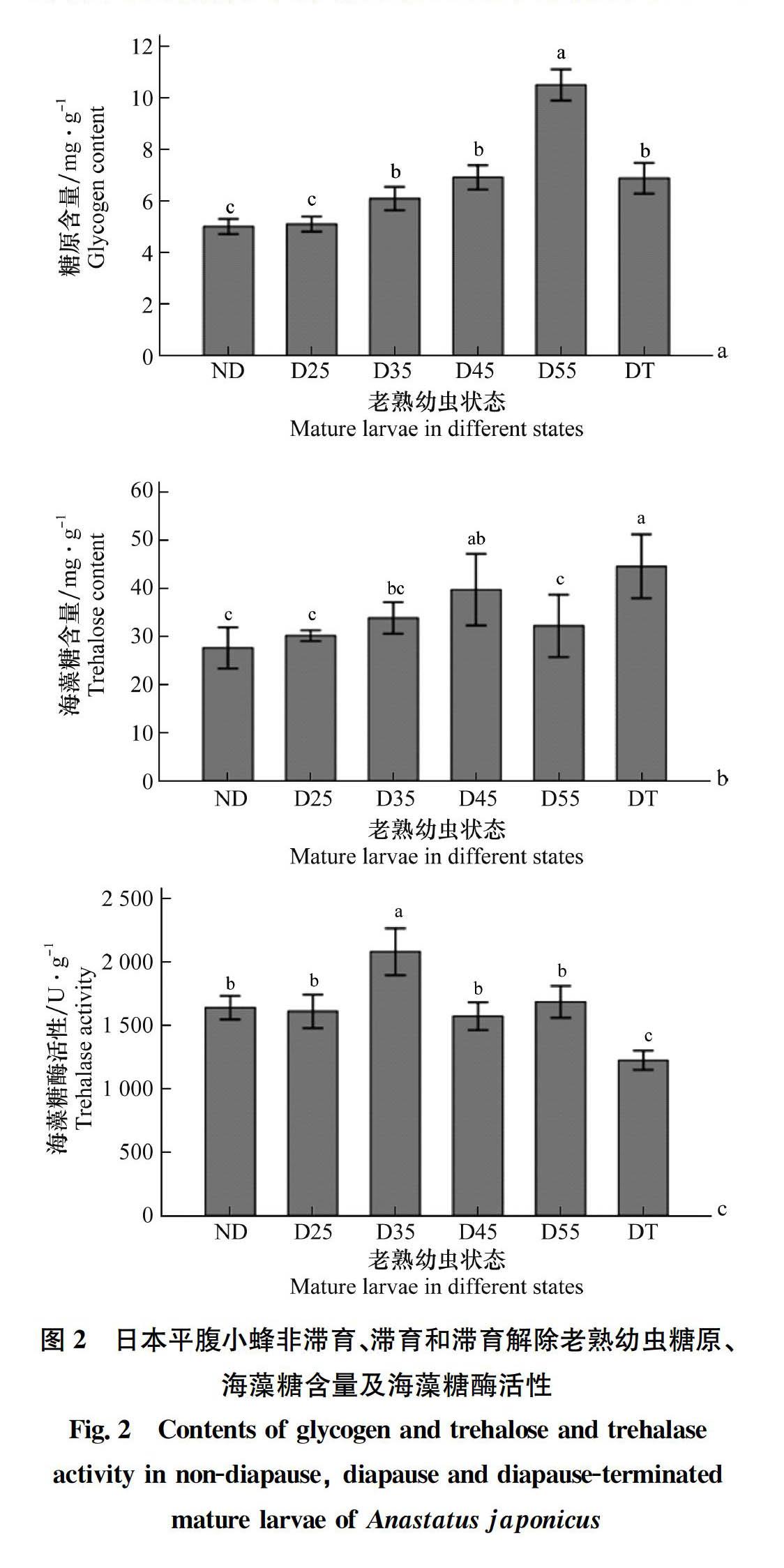
2.2 糖原、海藻糖含量及海藻糖酶活性的比較
滯育誘導35、45、55 d的老熟幼蟲糖原含量均高于非滯育個體(F 5,53=72.129, P<0.05),其中滯育誘導35~55 d的老熟幼蟲糖原含量顯著高于非滯育老熟幼蟲,且隨著滯育時間延長,糖原含量逐漸升高。滯育解除個體糖原含量低于滯育誘導55 d的個體,但顯著高于非滯育個體(圖2a)。滯育誘導45 d老熟幼蟲的海藻糖含量顯著高于非滯育個體(F 5,51=6.873, P<0.05),滯育誘導25、35 d和55 d的個體其海藻糖含量均與非滯育個體無顯著差異。滯育解除個體海藻糖含量顯著高于非滯育個體及滯育誘導25、35 d和55 d的個體(圖2b)。滯育誘導35 d的老熟幼蟲體內海藻糖酶活性顯著高于非滯育個體(F 5,54=19.168, P<0.05),滯育誘導25、45 d和55 d的個體海藻糖酶活性均與非滯育個體無顯著差異,滯育解除個體海藻糖酶活性顯著降低(圖2c)。
2.3 甘油和山梨醇含量的比較
滯育老熟幼蟲的甘油含量均顯著低于非滯育老熟幼蟲(F 5,53=261.194, P<0.05),且隨著滯育誘導時間延長,甘油含量顯著下降。滯育解除后個體甘油含量顯著升高,但仍顯著低于非滯育個體(圖3a)。滯育誘導25 d的老熟幼蟲山梨醇含量與非滯育個體沒有顯著差異,滯育誘導35、45、55 d和滯育解除老熟幼蟲的山梨醇含量無顯著差異(圖3b),但顯著高于非滯育個體(F 5,52=38.701, P<0.05)。
2.4 SOD、POD和CAT活性的比較
滯育誘導25 d的老熟幼蟲的SOD活性顯著高于非滯育個體(F 5,53=39.566, P<0.05),隨滯育時間延長,SOD活性呈顯著下降趨勢,滯育誘導35、45 d和55 d的老熟幼蟲的SOD活性顯著低于非滯育個體。滯育解除老熟幼蟲的SOD活性顯著升高,但是與非滯育個體無顯著差異(圖4a)。
滯育誘導25 d的老熟幼蟲的POD活性顯著高于非滯育個體(F 5,42=37.441, P<0.05),隨著滯育時間延長,POD活性呈顯著下降趨勢,滯育誘導45 d和55 d的老熟幼蟲的POD活性顯著低于非滯育個體。滯育解除老熟幼蟲POD活性略微升高,與滯育誘導45 d個體相當(圖4b)。
滯育老熟幼蟲的CAT活性均顯著高于非滯育個體(F 5,52=30.233, P<0.05),其中滯育誘導25~45 d期間,CAT活性逐漸升高,滯育誘導55 d 時CAT活性顯著下降,但是仍顯著高于非滯育個體。滯育解除個體CAT活性與滯育誘導55 d個體無顯著差異,但顯著高于非滯育個體(圖4c)。
3 討論
滯育昆蟲為了度過不良環境,在滯育前期必須積累某些化學物質,以滿足其在滯育期及滯育解除后對物質和能量的需求。滯育昆蟲積累的能源物質主要包括脂類、碳水化合物、氨基酸以及必需的維生素和礦物質等微量元素[19]。此外海藻糖、山梨醇、甘油等物質可以作為低溫保護物質。這些低溫保護物質可提高昆蟲的過冷卻能力,防止對細胞的滲透破壞而使昆蟲免于冷害和凍害,穩定細胞膜和蛋白質,從而提高滯育昆蟲的耐寒性,減輕低溫造成的傷害[20]。同時,昆蟲體內存在重要的防御系統保護酶,滯育期間昆蟲會調節這些酶的活性來幫助其度過不利環境[16]。其中POD、SOD、CAT作為抗氧化系統中重要的酶,在滯育期間起到十分重要的作用。
本研究表明日本平腹小蜂滯育老熟幼蟲與非滯育老熟幼蟲的主要生理生化物質含量顯著不同。滯育老熟幼蟲顯著積累糖原和山梨醇。雖然滯育老熟幼蟲的海藻糖含量與非滯育個體差異不顯著,但滯育期間海藻糖的含量一直保持較高水平,推測海藻糖是平腹小蜂體內的主要糖類。總脂質和甘油三酯在滯育期間呈現先升高后下降的趨勢。蛋白質含量在滯育初期略微增加,但是與非滯育個體相比無顯著差異,隨著滯育時間延長被顯著消耗。甘油在日本平腹小蜂滯育期間被顯著消耗,說明甘油在其滯育期間不是主要的低溫保護物質,可能參與代謝,為機體提供能量。過氧化氫酶活性在日本平腹小蜂滯育期間顯著升高,增強其抗氧化能力。本研究顯示滯育日本平腹小蜂顯著積累能源物質和低溫保護物質,提高抗氧化酶的活性,以幫助其提高耐寒能力,增強抗逆性,提高越冬存活率,是滯育日本平腹小蜂適應低溫的一種生理機制。
Colineta等[21]發現低溫誘導昆蟲產生抗凍蛋白等來阻止蟲體細胞內結冰,從而避免細胞內或其他重要部位遭遇冷害,這是在絕大多數昆蟲體內發現的一種應對越冬氣溫變化的積極應答機制。一般來說昆蟲在滯育準備期間會顯著積累蛋白質,可能是體內蛋白含量提高可提高抗寒性。如:處于滯育期的二化螟Chilo suppressalis[22]和草地螟Loxostege sticticalis[23]體內蛋白含量顯著高于非滯育期。但在日本平腹小蜂體內滯育前期蛋白含量與非滯育個體沒有差別,即日本平腹小蜂在滯育前期沒有顯著積累。這可能是因為在日本平腹小蜂滯育期間蛋白質并不作為耐受低溫和維持生命活動的主要物質,相似的報道在美國白蛾Hyphantria cunea上也有發現[24]。隨著滯育時間的延長,即滯育誘導45、55 d時蛋白含量顯著下降。類似地,九香蟲Aspongopus chinensis[25]、煙蚜繭蜂Aphidius gifuensis[26]的滯育幼蟲蛋白含量隨著時間的延長也明顯下降。滯育期間蛋白含量的下降可能是蛋白質分解成氨基酸參與代謝或者作為一種低溫保護物質。據報道中華通草蛉Chrysoperla sinica[27]滯育解除過程中隨時間延長蛋白質含量呈升高趨勢且高于滯育期。在滯育解除后日本平腹小蜂體內總蛋白含量也較滯育誘導
55 d有所上調,說明蛋白質作為昆蟲體內的重要結構物質和生物功能,其含量的變化與滯育的誘導和解除密切相關。
脂類是昆蟲滯育期間重要的能量儲存形式,其中甘油三酯是脂類的主要貯存形式,是大多數滯育昆蟲體內最重要的能量物質,其含量與滯育的發生、維持和解除密切相關[19]。一些昆蟲在滯育期間脂質含量升高,為其在低溫時儲存了能量,增強其耐寒性,如甘藍夜蛾Mamestra brassicae[28]和金紋細蛾Phyllonorycter ringoniella[29]滯育前會積累大量脂質。在本研究中,日本平腹小蜂老熟幼蟲在滯育初期顯著積累了大量脂質和甘油三酯,尤其是甘油三酯含量達到了非滯育幼蟲的2倍以上,這為接下來長達幾個月的滯育期儲備了充足的能量。隨著滯育時間延長,脂質和甘油三酯含量的逐漸降低也說明了在此期間脂質和甘油三酯作為能量物質被逐漸降解,以維持滯育期間代謝的需求。在麥紅吸漿蟲Sitodiplosis mosellana[30]中也有相似的報道。
糖原是昆蟲滯育期間最常積累的能量物質。許多滯育昆蟲在越冬期間常通過積累糖原或小分子多元醇類來增加抗寒能力[3132]。研究表明許多昆蟲在滯育時積累糖原,并在次年生長時將體內的糖原轉化為糖類和醇類以供其生長發育的需要。如馬鈴薯瓢蟲Epilachna vigintioctomaculata[33]可將糖原轉化為肌醇。本研究發現,隨著滯育時間的延長,日本平腹小蜂老熟幼蟲體內的糖原含量持續增加,在滯育誘導55 d時糖原含量達到了非滯育蟲體的2倍,這與大部分的報道相似。煙蚜繭蜂[24]和麗草蛉[7]在滯育初期糖原含量均顯著升高,隨著滯育時間增加糖原含量顯著下降。在滯育解除時糖原含量和滯育誘導55 d相比顯著下降,可能是部分的糖原作為能量物質參與代謝,或者是轉換成了生長發育的其他物質。
海藻糖是昆蟲體內一種重要的血糖,是昆蟲生長中重要的能量物質和低溫保護劑。海藻糖能降低昆蟲體液的過冷卻點,防止體液結冰,或者將結冰限制于細胞外空間,從而保護細胞的正常功能,避免遭受凍害[3435]。已有許多研究發現昆蟲在滯育過程中海藻糖會顯著積累。如:蘋果蠹蛾Cydia pomonella[36]老熟幼蟲進入滯育后體內海藻糖含量顯著升高;梨小食心蟲Grapholita molesta[37]在幼蟲滯育期間海藻糖含量升高。這些研究表明海藻糖在昆蟲滯育期間積累是一個普遍現象。本研究中日本平腹小蜂體內海藻糖含量在整個滯育過程中都處于一個較高水平,沒有被明顯消耗,推測海藻糖在日本平腹小蜂滯育期間不作為主要供能物質,而主要發揮低溫保護作用,提高耐寒性。在其他研究中海藻糖在滯育解除時會顯著降低,轉化為能源物質為解除滯育、活動、化蛹做能量準備[38]。但在本研究中,滯育誘導
55 d和滯育解除相比海藻糖酶活性降低,海藻糖含量升高。海藻糖的積累可能是為化蛹和羽化做準備,以滿足化蛹和羽化時幾丁質的合成以及能量供應。Hayakawa等[39]根據昆蟲滯育期間糖醇類物質積累的差異,提出滯育昆蟲的糖醇積累可分為2種類型: 一種為糖原積累型,另一種為海藻糖積累型。日本平腹小蜂滯育個體糖原含量明顯高于非滯育個體,并隨著滯育時間的延長迅速積累; 海藻糖含量則在滯育過程中一直維持同等水平。推測日本平腹小蜂滯育時糖醇積累類型為糖原積累型。
甘油和山梨醇對昆蟲細胞膜起到抗凍保護作用,同時可以增加細胞能量來源,使其耐寒性增強。大姬蛛Achaearanea tepidariorum[40]從滯育誘導開始便積累肌醇、肌糖和山梨醇。大斑芫菁Mylabris phalerata[41]滯育過程中,其血淋巴中積累的小分子多元醇主要為甘油,其次是山梨醇。在本研究中,日本平腹小蜂老熟幼蟲在滯育期間顯著積累山梨醇,而甘油含量顯著下降,說明在其滯育期間,山梨醇可能主要作為低溫保護物質提高滯育老熟幼蟲的耐寒性,而甘油可能作為前體物質參與代謝,為機體提供能量。甘油的積累并不是昆蟲越冬所必需的,有些昆蟲越冬期并不積累甘油,如棉鈴蟲Helicoverpa armigera[42]滯育蛹和非滯育蛹中甘油含量都較低,經8℃冷處理后仍不增加。大菜粉蝶Pieris brassicae[43]滯育蛹也不積累甘油,而僅積累山梨醇。
過氧化物酶(POD)、過氧化氫酶(CAT)、超氧化物歧化酶(SOD)是昆蟲體內重要的防御系統保護酶。SOD能清除昆蟲體內超氧化物,使之形成O 2和H 2O 2,而CAT和POD將產生的自由基、H 2O 2轉化為H 2O和O 2,以減少自由基對昆蟲的毒害[44]。滯育誘導
25 d的日本平腹小蜂體內SOD、POD和CAT的活性顯著高于非滯育個體,說明滯育初期其抗氧化防御能力增強。同樣地,異色瓢蟲Harmonia axyridis[45]和茶尺蠖Ectropis obliqua[17]蛹經低溫誘導后POD、SOD和CAT活性均顯著升高。隨著滯育時間延長,日本平腹小蜂體內SOD和POD活性顯著下降,但是CAT活性繼續升高,這說明CAT在滯育期間較活躍,是主要的防御酶。隨著日本平腹小蜂滯育老熟幼蟲的代謝速率下降,體內產生的活性氧可能也下降,此時低水平的酶活即可滿足抗氧化防御需求。SOD活性下降及CAT活性升高, 使滯育期間H 2O 2含量維持在一個較低水平,體現出滯育老熟幼蟲抵抗不良環境的能力。抗氧化酶活性的變化與外界溫度、逆境脅迫及生物體的代謝速率等密切相關,滯育發育過程中SOD、POD和CAT的活性變化反映了日本平腹小蜂的代謝水平、氧化狀態等生理狀態,也說明了滯育發育過程是一個動態變化的過程。
本研究表明,總蛋白質、總脂質、甘油三酯、糖原、海藻糖、甘油、山梨醇、SOD、POD、CAT在日本平腹小蜂滯育過程中的動態變化提升了自身的抗寒性。糖原和總脂質含量不僅對滯育的維持,而且對滯育后的發育十分重要。本文為研究日本平腹小蜂的滯育機理提供了基礎。
參考文獻
[1] LI Dunsong, LIAO Chunyuan, ZHANG Baoxin, et al. Biological control of insect pests in litchi orchards in China [J]. Biological Control, 2014, 68(1): 2336.
[2] TAUBER M J, TAUBER C A. Insect seasonality: Diapause maintenance, termination and post diapause development [J]. Annual Review of Entomology, 1976, 21: 81107.
[3] ANDUAGA A M, NAGY D, COSTA R, et al. Diapause in Drosophila melanogaster-photoperiodicity, cold tolerance and metabolites [J]. Journal of Insect Physiology, 2018, 105(1): 4653.
[4] DENLINGER D L. Regulation of diapause [J]. Annual Review of Entomology, 2001, 47(1): 93122.
[5] 張洪志, 高飛, 劉夢姚, 等. 近十年全球小型寄生蜂滯育研究的新進展[J]. 環境昆蟲學報, 2018, 40(1): 8291.
[6] 趙燦, 夏玥, 郭義, 等. 平腹小蜂滯育誘導研究[J]. 中國生物防治學報, 2019, 35(2): 282287.
[7] 王曼姿, 李玉艷, 高飛, 等. 麗草蛉滯育預蛹的重要生化物質變化分析[J]. 中國生物防治學報, 2020, 36(1): 3139.
[8] ARRESE E L, SOULAGES J L. Insect fat body: energy, metabolism, and regulation [J]. Annual Review of Entomology, 2010, 55: 207225.
[9] HEYDARI M, IZADI H. Effects of seasonal acclimation on cold tolerance and biochemical status of the carob moth, Ectomyelois ceratoniae Zeller, last instar larvae [J]. Bulletin of Entomological Research, 2014, 104(5): 592600.
[10]LI Yuyan, ZHANG Lisheng, ZHANG Qirui, et al. Host diapause status and host diets augmented with cryoprotectants enhance cold hardiness in the parasitoid Nasonia vitripennis [J]. Journal of Insect Physiology, 2014, 70: 814.
[11]呂兵, 翟一凡, 鄭禮,等. 東亞小花蝽滯育前后耐寒能力及體內生化物質變化[J]. 中國生物防治學報, 2020, 36(6): 885890.
[12]孫程鵬, 王建梅, 韓海斌, 等. 傘裙追寄蠅滯育期間主要物質含量變化研究[J]. 中國植保導刊, 2017, 37(4): 1519.
[13]WOLSCHIN F, GADAU J. Deciphering proteomic signatures of early diapause in Nasonia [J/OL]. PLoS ONE, 2009, 4(7): e6394. DOI: 10. 1371/journal. pone. 0006394.
[14]MENG Jianyu, ZHANG Changyu, ZHU Fen, et al. Ultraviolet light-induced oxidative stress: effects on antioxidant response of Helicoverpa armigera adults [J]. Journal of Insect Physiology, 2009, 55: 588592.
[15]趙林川, 司馬楊虎, 李兵,等. 即時浸酸對家蠶胚胎發育中H 2O 2代謝的影響[J]. 蠶業科學, 2000, 26(4): 268270.
[16]ZHAO Liwei, XU Xiaorui, XU Zhe, et al. Diapause induction, color change, and cold tolerance physiology of the diapausing larvae of the Chouioia cunea (Hymenoptera: Eulophidae) [J/OL]Journal of Insect Science, 2014, 14: 294. DOI: 10. 1093/jisesa/ieu156.
[17]段小鳳, 王曉慶, 李品武, 等. 冷馴化對茶尺蠖抗寒性生理指標的影響[J]. 應用昆蟲學報, 2015, 52(6): 14131420.
[18]HANDEL E V. Rapid determination of total lipids in mosquitoes [J]. Journal of the American Mosquito Control Association, 1985, 1(3): 302304.
[19]HAHN D A, DENLINGER D L. Energetics of insect diapause [J]. Annual Review of Entomology, 2001, 56: 103121.
[20]LEE R E J R. A primer on insect cold-tolerance [M]∥DENLINGER D L, LEE R E Jr. Low temperature biology of insects. Cambridge: Cambridge University Press, 2010:335.
[21]COLINETA H, VERNONB P, HANCE T. Does thermal-related plasticity in size and fat reserves influence supercooling abilities and cold-tolerance in Aphidius colemani (Hymenoptera:Aphidiinae) mummies [J]. Journal of Thermal Biology, 2007, 32(7):374382.
[22]楊光平, 劉玉娣, 侯茂林. 二化螟滯育幼蟲的蛋白和核酸含量以及保護酶活性的變化[J]. 昆蟲學報, 2013, 56(3): 251256.
[23]張健華,羅禮智,江幸福,等.草地螟滯育幼蟲的蛋白和核酸含量變化[J].昆蟲學報,2012,55(2):156161.
[24]王瑋. 美國白蛾滯育蛹越冬前的能量貯備與越冬期溫度變化對其能量消耗的影響[D]. 南京: 南京林業大學, 2020.
[25]吳有芳, 周汶楨, 趙帥, 等. 九香蟲滯育期脂肪、糖類和蛋白質含量的變化規律[J]. 應用昆蟲學報, 2019, 56(5): 10191025.
[26]李玉艷. 煙蚜繭蜂滯育誘導的溫光周期反應及滯育生理研究[D]. 北京: 中國農業科學院, 2011.
[27]陳珍珍, 趙楠, 印象初, 等. 中華通草蛉自然越冬成蟲在兩種光周期下滯育解除過程中的生理生化變化[J]. 昆蟲學報, 2013, 56(2):120130.
[28]DING Lei, LI Yiping, MICHIYO G. Physiological and biochemical changes in summer and winter diapause and non-diapause pupae of the cabbage armyworm, Mamestra brassicae L. during long-term cold acclimation [J]. Journal of Insect Physiology, 2003, 49(12): 11531159.
[29]LI Yiping, OGUCHI S, GOTO M. Physiology of diapause and cold hardiness in overwintering pupae of the apple leaf miner Phyllonorycter ringoniella in Japan [J]. Physiological Entomology, 2002, 27(2): 9296.
[30]李丹, 龍治任, 王越, 等. 麥紅吸漿蟲滯育發生和解除過程中總脂和甘油三酯含量變化[J]. 昆蟲學報, 2014, 57(5): 509514.
[31]GOTO M, SEKINE Y, OUTA H, et al. Relationships between cold hardiness and diapause, and between glycerol and free amino acid contents in overwintering larvae of the oriental corn bore, Ostrinia furnacalis [J]. Journal of Insect Physiology, 2001, 47: 157165.
[32]LI Yiping, GONG He, PARK H Y. Biochemistry and physiology overwintering in the mature larva of the pine needle gall midge, Thecodiplosis japonensis (Diptera:Cecidomyiidae) in Korea [J]. Cryo Letters, 2000, 21: 149156.
[33]HOSHIKAWA K. Interconversion between glycogen and inositol inhibernating adults of a phytophagous ladybeetle, Epilachna vigintioctomaculata[J]. Insect Biochemitry, 1987, 17(2): 265268.
[34]FIELDS P G, FLEURAT-LESSARD F, LAVENSEAU L, et al. The effect of cold acclimation and deacclimation on cold tolerance, trehalose and free amino acid levels in Sitophilus granarius and Cryptolestes ferrugineus (Coleoptera)[J]. Journal of Insect Physiology, 1998, 44(10): 955965.
[35]WANG Jia, FAN Huan, XIONG Kecai, et al. Transcriptomic and metabolomic profiles of Chinese citrus fly, Bactrocera minax (Diptera:Tephritidae), along with pupal development provide insight into diapause program [J/OL]. PLoS ONE, 2017, 12(7): e0181033. DOI: 10. 1371/journal. pone. 0181033.
[36]ROZSYPAL J, KOSTAL V, ZAHRADNICKOVA H, et. al. Overwintering strategy and mechanisms of cold tolerance in the codling moth (Cydia pomonella) [J/OL]. PLoS ONE, 2013, 8(4): e61745. DOI: 10.1371/journal. pone. 0061745.
[37]HE Chao, MENG Quanke, YANG Xiangbin, et al. Carbohydrate metabolism and antioxidant defense during diapause development in larvae of oriental fruit moth, Grapholita molesta, at low temperature [J]. International Journal of Agriculture & Biology, 2013, 15(1): 101106.
[38]張擁軍. 二化螟越冬幼蟲耐寒性及其機理研究[D]. 武漢:華中農業大學, 2007.
[39]HAYAKAWA Y, CHINO H. Phosphofructokinase as a possible key enzyme regulating glycerol or trehalose accumulation in diapausing insects [J]. Insect Biochemitry, 1982, 12(6): 639642.
[40]KAZUJIRO T. Evolutionary relationship between diapause and cold hardiness in the house spider, Achaearanea tepidariorum (Araneae: Theridiidae) [J]. Journal of Insect Physiology, 1997, 43(3):271274.
[41]朱芬, 李紅, 王永, 等.大斑芫菁滯育幼蟲在滯育不同階段體內糖類和醇類含量的變化[J]. 昆蟲學報, 2008, 51(1): 913.
[42]王智渝, 胡敦孝, 王宗舜. 棉鈴蟲(Helicoverpa armigera Hübner)滯育蛹和非滯育蛹血淋巴某些生化特性的比較研究[J]. 中國農業大學學報, 1998(1): 3339.
[43]PULLIN A S, BALE J S. Influence of diapause and temperature on cryoprotectant synthesis and cold hardiness in pupae of Pieris brassicae [J]. Comparative Biochemistry and Physiology Part A: Physiology, 1989, 94(3): 499503.
[44]HAO Linhua, WANG Zhenyu, XING Baoshan. Effect of sub-acute exposure to TiO 2 nanoparticles on oxidative stress and histopathological changes in juvenile carp (Cyprinus carpio) [J]. Journal of Environmental Sciences, 2009, 21(10): 14591466.
[45]趙靜, 陳珍珍, 曲建軍, 等. 異色瓢蟲成蟲冷馴化反應及體內幾種酶活力的相關變化[J]. 昆蟲學報, 2010, 53(2): 147153.
(責任編輯:楊明麗)

