馬鈴薯蛋白質提取工藝優化及分子量的測定
李 龍,程金生,任安祥,許穩健
(1.韶關學院 英東食品學院;2.韶關學院 英東生物與農業學院,廣東 韶關 512005)
新鮮馬鈴薯塊莖蛋白質含量為1.7%~2.1%,馬鈴薯蛋白質按分子量大小分為高分子量蛋白質、糖蛋白、蛋白酶抑制劑3部分[1].目前堿溶酸沉法提取馬鈴薯蛋白質堿溶最佳pH值在9.2~9.5之間,酸沉pH值為3.5左右[2].堿溶最佳pH值的選擇避開了酸溶堿沉蛋白質等電點pH值8.5,從而可獲得更多堿溶蛋白質的提取,也防止了因pH值過高(pH>9.5)導致浸提溶液粘度過大造成蛋白質分離困難和堿溶蛋白質的水解失去生物活性.因此堿溶酸沉法提取馬鈴薯蛋白質堿溶最佳pH值的選擇是科學合理的.其中堿溶酸沉蛋白主要是馬鈴薯儲藏蛋白高分子,酸溶堿沉蛋白主要是馬鈴薯蛋白酶抑制劑[3].為了進一步了解馬鈴薯堿溶酸沉蛋白和酸溶堿沉蛋白的分離特性,本研究分別做了馬鈴薯堿溶酸沉蛋白和酸溶堿沉蛋白的提取方法優化和分子量測定,為將來馬鈴薯生物活性蛋白膜分離提取技術和層析分離純化技術提供數據基礎.
1 材料與方法
1.1 試劑和儀器
馬鈴薯(內蒙古赤峰市合作企業提供);鹽酸、硫酸、氫氧化鈉等試劑均為分析純,由廣州化學試劑有限公司提供.葡聚糖凝膠:型號Sephadex G-200,購于阿拉丁試劑(上海)有限公司,已知分子量的葡萄糖標準品以及其他所需試劑均購置阿拉丁試劑(上海)有限公司.
所用儀器中:烘箱(型號Eny202266,上海精宏實驗設備有限公司);離心機(TGL-16G,上海菁華科技儀器有限公司);紫外可見分光光度計(型號UV-240,上海菁華科技儀器有限公司);電子分析天平(型號JA5003,韶關市科力實驗儀器有限公司);立式膠體磨(型號JM-50A,廣西天諢機械有限公司).
1.2 試驗方法
為了快速測定單因素實驗(pH值、料液比、時間)對馬鈴薯蛋白質溶解度的影響,選擇280 nm波長下測蛋白質測吸光度測定,吸光度與蛋白質提取率(酸提或堿提)呈反比.
為了優化工藝條件本研究采用正交實驗,選擇微波消化凱氏定氮法精確測定馬鈴薯蛋白質的提取率.
為了快速測定提取(酸提或堿提)馬鈴薯蛋白質在分子篩色譜過程的出峰位置,選擇280 nm波長下測蛋白質測吸光度測定,吸光度與蛋白質含量呈正比.為了確定分子篩層析內標葡聚糖的出峰位置,選擇了苯酚-硫酸法測定內標標準品的出峰位置.
1.2.1 馬鈴薯前處理
馬鈴薯→去皮、切塊→稱300 g馬鈴薯用1% NaCl溶液護色料液比(1∶2)→經豆漿機、膠體磨粉碎→紗布過濾→抽濾→過濾液→等體積分裝,備用.
1.2.2 不同pH值時馬鈴薯上清液的吸光度測定
取前處理后的分裝液,用濃HCl,濃NaOH溶液分別調節至設定pH→靜置1 h→離心(6 000 r) →沉淀蛋白質干燥105 ℃至恒重稱重→上清液在280 nm測量吸光度[5].
1.2.3 不同料液比條件下的馬鈴薯上清液(pH=3.5,pH=8)吸光度的測定
馬鈴薯前處理條件一樣,按照液料比1∶1,2∶1,3∶1,4∶1分別在pH=3.5,pH=8,時間為1 h的情況進行提取,離心后取上清液在280 nm波長下測蛋白質測吸光度,吸光度與蛋白質提取率呈反比.
1.2.4 提取時間對提取率的影響
馬鈴薯前處理條件一樣,按照提取時間0.5、1、1.5、2 h分別在pH=3.5,pH=8,液料比2∶1的情況進行提取,離心后取上清液在280 nm下測蛋白質測吸光度,吸光度與蛋白質提取率呈反比.
1.2.5 正交實驗設計
根據單因素的測定結果,確定等電點pH(A)、提取時間(B)和液料比(C)3個主要因素,從而在酸性條件和堿性條件下分別建立L9(33)三因素三水平的正交試驗[8],提取馬鈴薯蛋白質采用微波消化凱氏定氮法測定計算提取率,提取率=過濾液的蛋白質總量-調pH值后上清蛋白質總量/過濾液的蛋白質總量.實驗方案見表1、表2.

表1 酸性性條件下正交實驗因素水平

表2 堿性條件下正交實驗因素水平
1.2.6 馬鈴薯蛋白質分子量的測定
一定體積的馬鈴薯過濾液調pH=3.5提取沉淀的蛋白質經堿溶后過柱分析,再經堿液中和調pH=8.5提取沉淀的蛋白質經酸溶后過柱分析,利用紫外線分光光度計確定酸溶性和堿溶性蛋白質的大致含量,通過與內標葡聚糖標準品的流出時間測定馬鈴薯蛋白質的分子量,從而對馬鈴薯酸溶和堿溶蛋白質進行初步的分析和分類.
1.2.6.1 測定內標葡聚糖含量的葡萄糖標準曲線的繪制
標準樣品溶液的配制:稱取葡萄糖100 mg,置于100 mL容量瓶中,加水適量使溶解,定容.吸取上述溶液10 mL,定容至100 mL.即得0.1 mg/mL的標準葡萄糖溶液[6].
苯酚-硫酸法繪制標準曲線:用移液管移取0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9 mL的標準葡萄糖溶液,分別置于10 mL試管中,依次加水,終體積為1.0 mL[7].另加1.0 mL的5%的苯酚,搖勻,再各加入濃硫酸5 mL,搖勻,在室溫下顯色10~20 min,以空白校正零點,于490 nm波長下處檢測其吸光度[6].然后以葡萄糖的質量濃度為橫坐標,吸光度為縱坐標,繪制葡萄糖標準曲線,如圖1所示.

圖1 苯酚-硫酸法測定葡萄糖的標準曲線
1.2.6.2 分子篩層析法測定蛋白質分子量
堿溶性蛋白質和酸溶性蛋白質分別通過酸沉堿溶、堿沉酸溶方法,各取出1 mL溶液,加水稀釋至5 mL,搖勻待用.查閱資料得知馬鈴薯含有的3種蛋白質分子量,選取多糖分子量為1.1×105,6.06×104,1.26×104的3種標準品[7],分別用精密天平準確稱取3.0 mg,一起溶解在5 mL水中,搖勻,待用.精密天平稱取標準藍色聚多糖5.0 mg溶于50 mL容量瓶中.混勻,待用.
1.2.6.3 葡聚糖凝膠柱的制備及實驗方法
(1)裝柱:用 Sephadex G-200填柱.
(2)跑柱:平衡凝膠柱需過夜,使用前要檢查層析床是否均勻,有無“紋路”或氣泡,如果出現,必須重新裝柱[9].
(3)測定V0:取0.5 mL配制好的藍色葡聚糖-2000上柱、洗脫,測出洗脫體積Ve.藍色葡聚糖的Ve即為該柱的V0[8].
(4)上樣:酸提堿溶性蛋白:取上述蛋白質溶液0.5 mL,藍色葡聚糖標準溶液0.5 mL,搖勻,在加入1 mL配置好的葡聚糖標準品溶液,搖勻.加樣,過柱.由于藍色聚多糖分子量最大,所以在柱內走的最快,因此當看到藍色物質流出時,開始收集洗脫液,2 mL一管,共40管.按照1~40號的先后收集順序貼好標簽,待用.
(5)檢樣:依次取洗脫液1 mL加水稀釋至5 mL在490 nm下測吸光度代表標準葡聚糖的吸光度.另依次取0.5 mL洗脫液加水至5 mL在280 nm下吸光度值代表蛋白質的吸光度,可根據標準葡聚糖和馬鈴薯蛋白質的出峰位置計算蛋白質分子量.
2 結果分析
2.1 單因素的分析結果
2.1.1 不同pH值對浸提馬鈴薯蛋白質后離心上清液吸光度的影響
馬鈴薯蛋白質的吸光度在酸性條件和堿性條件下均出現最小吸光度,如圖2所示,說明馬鈴薯蛋白質有兩個等電點.由圖可以看出,隨著pH值在2.0到13.0的范圍內變化時,馬鈴薯蛋白質提取率的變化趨勢. pH在3~4之間時上清液吸光度有一個最低值,預測該PH值與馬鈴薯酸性等電點較接近,pH=8左右時又出現一個吸光度最小值,預測該pH值與馬鈴薯堿性等電點比較接近.比較吸光度可知,馬鈴薯蛋白質酸性等電點蛋白質含量較高.
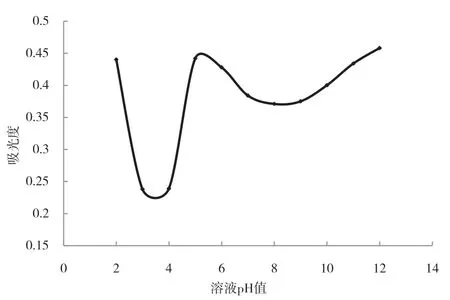
圖 2 pH值對上清液吸光度的影響
2.1.2 不同料液比對浸提馬鈴薯蛋白質后離心上清液吸光度的影響
在酸性和堿性條件下,當提取液的料液比從1∶1上升至2∶1區間時,上清液的吸光度逐漸減少,馬鈴薯蛋白質的提取率不斷升高,料液比達到2∶1為吸光度曲線拐點,如圖3所示.當料液比繼續升高時,溶液因體積增大數倍而吸光度略有下降,說明溶液中不沉淀蛋白質略有增加.考慮到食品加工生產過程中,料液比太大會增加后處理的負擔,浪費資源,使產品成本增大,因此選取料液比2∶1左右進行提取比較適宜.
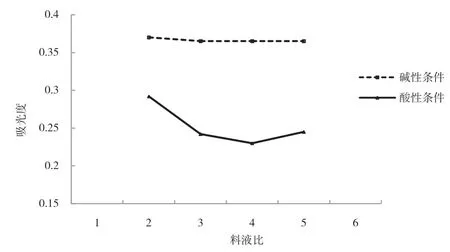
圖3 料液比對上清液吸光度的影響
2.1.3 提取時間對浸提馬鈴薯蛋白質后離心上清液吸光度的影響
在酸性和堿性條件下,提取時間對提取率的影響不是特別大,提取時間在0.5~1.5 h區間時,提取率升高比較明顯,1.5 h之后較為緩慢,逐漸趨于平穩,如圖4所示.考慮到企業生產效益,因此選取提取時間1 h左右進行提取比較適宜.
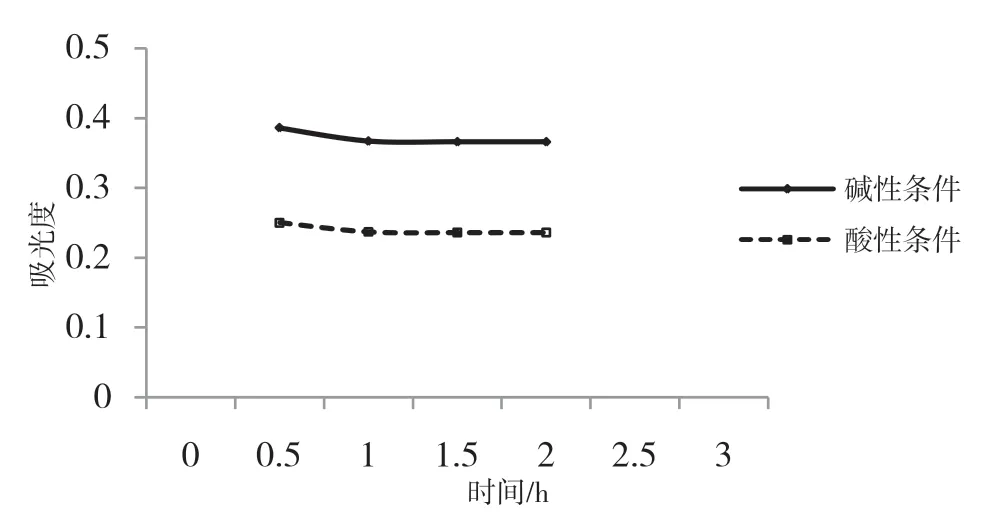
圖4 提取時間對上清液吸光度的影響
2.2 馬鈴薯蛋白質在酸性條件下提取蛋白質正交實驗的結果
由表3可得,酸性條件下,等電點提取馬鈴薯蛋白質的最佳提取條件為A2B2C1,顯著性:A>C>B.說明pH值對馬鈴薯蛋白質提取的影響最大.在最優的提取條件下馬鈴薯蛋白質的提取率為74.3%.
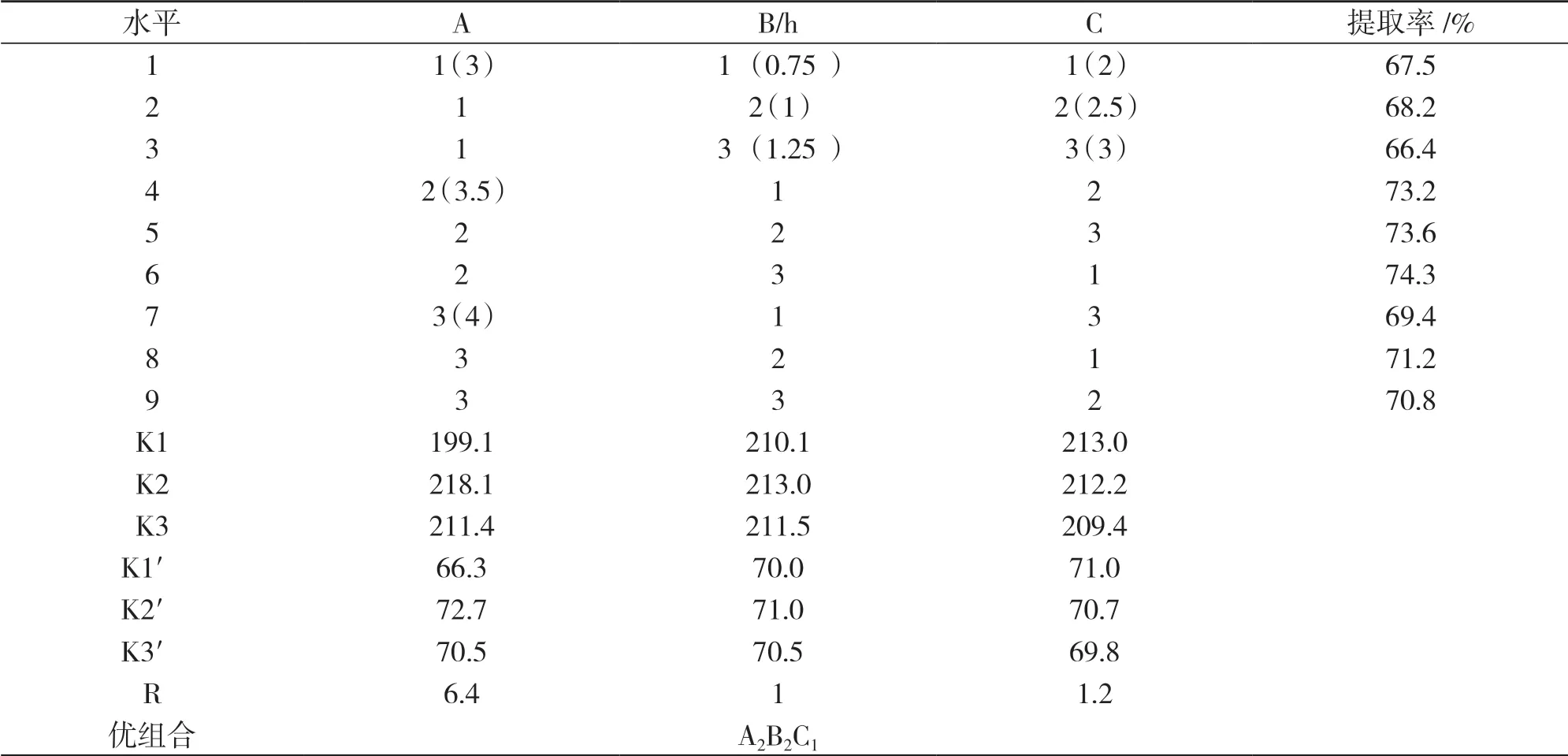
表3 酸性條件下正交實驗結果分析
2.3 馬鈴薯蛋白質在堿性條件下提取蛋白質正交實驗的結果
通過表4可知,堿性條件下,等電點提取馬鈴薯蛋白質的最佳提取條件為A2B2C1,顯著性:A>C>B.說明pH值對馬鈴薯蛋白質提取的影響最大.此時在最優提取條件下馬鈴薯蛋白質的提取率為11.6%.通過上述研究表明,影響馬鈴薯蛋白質提取率的因素顯著(R)值得次序為:pH>液料比>時間,其中以pH值對提取率影響較為顯著.另酸性條件下蛋白質提取率最大為74.3%,堿性條件下馬鈴薯蛋白質最大提取率為11.6%.證明在酸性等電點條件下馬鈴薯沉淀量較大,馬鈴薯含有的大部分蛋白質是堿溶性蛋白質.通過優化提取條件,在液料比2∶1、酸堿等電點分別作用下,提取1 h,總的蛋白質提取率為85.9%.
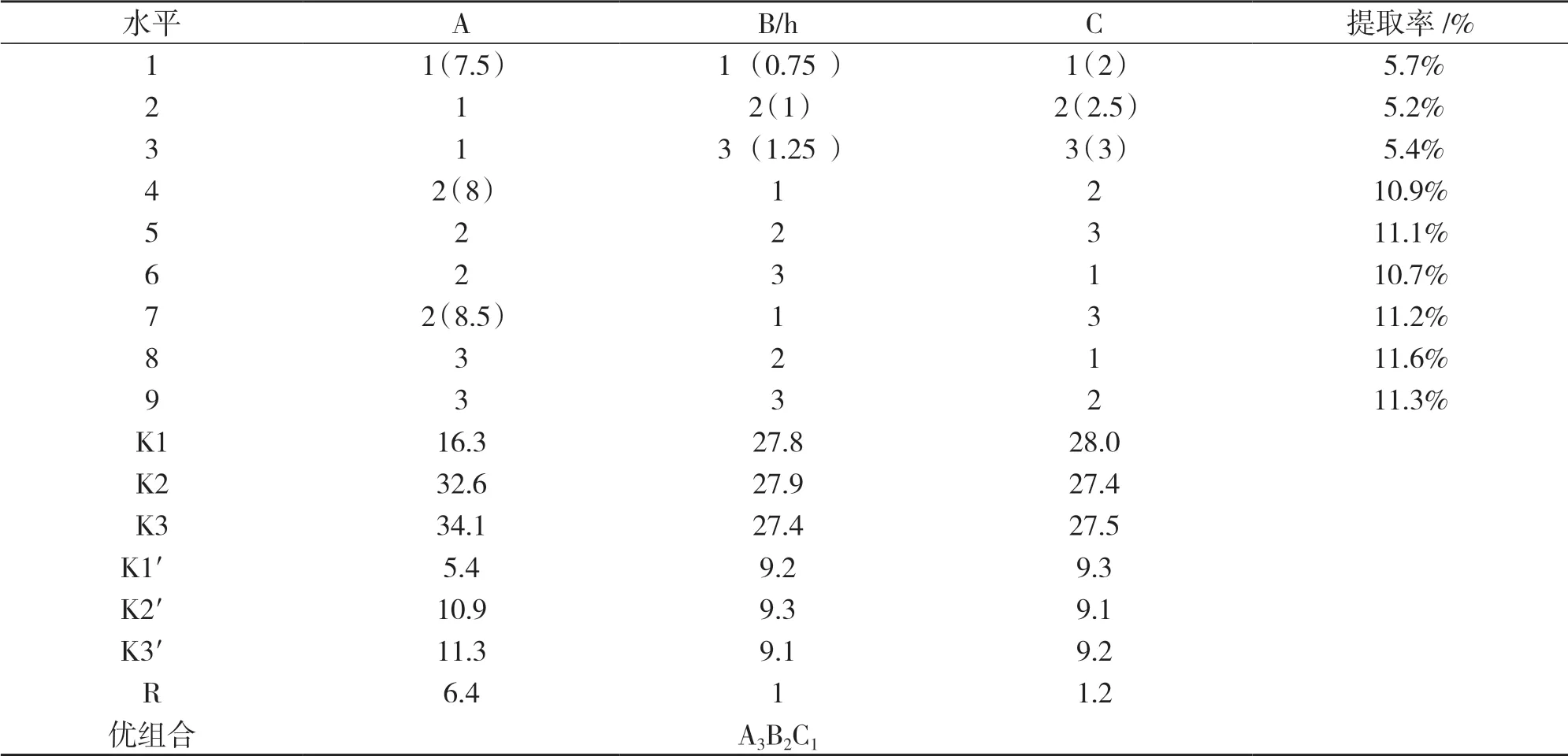
表4 堿性條件下正交實驗結果
2.4 馬鈴薯蛋白質分子量的測定
2.4.1 酸性條件下馬鈴薯蛋白質色譜分析結果
在490 nm下根據凝膠層析的原理和通過標準葡萄糖公式的計算出峰值的含聚多糖量,可以確定3個標準聚多糖的峰值,如圖5所示.由于分子量越小在分析柱流動越慢,流出來也越晚,所以的分子量小的標準品損失也越多,因此越晚流出來的標準品,波峰相對越低.查找資料可得馬鈴薯中存在3種蛋白質,其分子量分別為1.8×104,4.0×104,7.8×104[7].在280 nm下,通過測定蛋白質吸光度,發現在酸性提取條件下,只有一種蛋白質,根據3種標準聚多糖的波峰和分子量,通過馬鈴薯蛋白質出現的波峰管位位置,可判斷其分子量為4.0×104左右.

圖5 酸提堿溶條件下洗脫液的測量曲線
2.4.2 堿性條件下提取馬鈴薯蛋白質色譜分析結果
根據凝膠層析的原理和通過標準葡萄糖公式的計算出峰值的含聚多糖量,可以確定3個標準聚多糖的峰值,如圖6所示.由于分子量越小在分析柱中流動越慢,滯留時間越長,所以的分子量小的標準品擴散波峰越寬,因此越晚流出來的標準品,波峰值相對越低.與圖5相比較,酸性條件下,標準聚多糖和馬鈴薯蛋白質出現的波峰的位置比堿性條件下晚一個管位洗脫液體積.在280 nm下,通過測定蛋白質吸光度,并由此計算蛋白質分子量.研究過程中發現3個峰,2個波峰分別代表2種酸溶性蛋白質,根據其波峰的位置可判斷它們的分子量分別為1.8×104,7.8×104.表明馬鈴薯含有2種酸溶性蛋白質.其中分子量為4.0×104的蛋白質峰值很小,可能在pH=3.5時,分子量4.0×104的蛋白質沒有完全沉淀下來,在酸溶液中還有一定溶解度,在調pH值過程中分子量4.0×104的蛋白質所帶電荷在(pH>3.5)條件下為負,與分子量分別為1.8×104,7.8×104的蛋白質帶正電荷(pH<8.5)產生聚沉效應,導致酸溶性堿沉蛋白凝膠層析有分子量4.0×104蛋白質小波峰出現.以上凝膠層析的實驗結果和舒群芳等的實驗結果一致[7].分子量4.0×104蛋白質在pH8.5參與的聚沉效應很可能使調pH值從3.5 到8.5 的兩步沉淀方法的蛋白質的提取率高于分別調pH值3.5和8.5的提取率加和85.9%,后續實驗將對兩步沉淀方法提取蛋白質得率進一步進行驗證試驗,為兩步沉淀方法提供實驗依據.

圖6 堿提酸溶條件下下洗脫液的測量曲線
3 結論
本文通過單因素試驗和正交試驗的結果可知馬鈴薯蛋白質的最佳提取工藝:pH=3.5,液料比=2∶1,提取時間為1 h和pH=8.5,液料比=2∶1,提取時間為1 h,影響馬鈴薯蛋白質提取率的因素顯著(R)值得次序為:pH>液料比>時間.在酸性、堿性等電點的分別作用下,可以使馬鈴薯蛋白質的提取率達到85.9%.如果采用中和調pH值兩步沉淀法可能進一步提高蛋白質的提取率(>85.9%),此方法在實際食品工廠生產中也具有一定的可操作性,但后續廢液排放前要增加脫鹽處理工序.通過本實驗能夠很明顯的發現這3種蛋白質的存在,并且通過不同pH下的蛋白質吸光度和洗脫液稀釋度的比較計算,確定酸性等電點pH=3.5的情況下主要沉淀出一種蛋白質(堿溶性蛋白),其分子量為4.0×104.堿性等電點pH=8.5的情況下主要沉淀出2種蛋白質(酸溶性蛋白),其分子量分別為1.8×104,7.8×104.通過這種方法對馬鈴薯含有的3種蛋白質進行分類.彌補了對馬鈴薯蛋白質研究的不足,從而為以后研究開發馬鈴薯蛋白質的保健功能和其在食品加工中充分的利用提供了參考.

