核心素養理念下的電化學命題特點探析
◇ 河北 高孝強
電化學是化學學科模型認知、宏觀辨識與微觀探析、變化觀念、社會責任等核心素養體現的最主要載體之一,是高考命題的必考知識點,常同時出現在選擇題與非選擇題中,選擇題難度較大、題境較新穎,常以電化學研究的新成果、新應用為素材,展示電化學工作原理模型;在非選擇題中常常以拓展知識寬度、角度及深度來凸顯命題的綜合性、創新性,常以簡單的電化學裝置圖或文字描述來展示,這不僅利于考查氧化還原反應知識、電化學模型、方程式的書寫等必備化學知識,同時也利于對識圖分析與信息整合、推理與計算等關鍵能力的考查.
1 考查電化學裝置的工作原理,凸顯知識的基礎性
電化學考查內容盡管主要體現在電極類型判斷、電極反應式書寫、總反應方程式書寫、電子轉移數目以及電解液中離子濃度變化等方面,但其命題的基礎就是電化學的基本工作原理,其工作原理就是在電極上發生電極反應,進而可以明確有關微粒的得失電子及存在狀態.
例1一種水基二次電池原理如下,
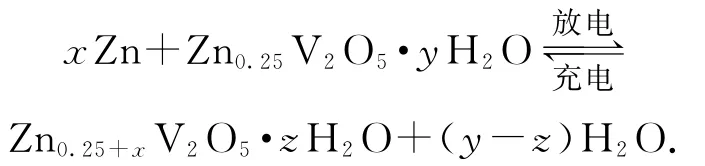
電解液為含Zn2+的水溶液,該電池可用于電網貯能.下列說法正確的是( ).

圖1
A.放電時,Zn2+脫離插層
B.放電時,溶液中Zn2+濃度一直減小
C.充電時,電子由Zn0.25V2O5·yH2O層經電解質溶液流向Zn0.25+xV2O5·zH2O 層
D.充電時,陽極反應為:Zn0.25+xV2O5·zH2O+(y-z)H2O-2xe-=Zn0.25V2O5·yH2O+xZn2+
解析
以一種水基二次電池為題材,考查原電池、電解池的工作原理.從圖示及提供的反應方程式角度來看,有點復雜,但耐心分析就會發現知識落腳點很簡單,無非就是電極判斷、電子(或離子)移動、電極反應式書寫等常規內容.放電時,Zn作負極,Zn0.25V2O5·yH2O得電子,并與Zn2+結合進入插層,選項A錯誤;由反應方程式可知,Zn2+沒有在總反應方程式中出現,故Zn2+濃度不變,選項B錯誤;電子只能通過導線轉移,不能通過電解質溶液轉移,選項C錯誤;充電是與放電完全相反的過程,充電時,陽極的電極反應式為Zn0.25+xV2O5·zH2O+(y-z)H2O-2xe-=Zn0.25V2O5·yH2O+xZn2+,選項 D正確.答案為D.
解題策略電化學的實質就是氧化還原反應,因而在熟練掌握氧化還原反應中的氧化劑與還原產物、還原劑與氧化產物等基本概念的基礎上,理解電化學裝置的工作原理(如圖2),并結合轉化中箭頭指向或信息提示,就可以順利判斷出電極反應類型.
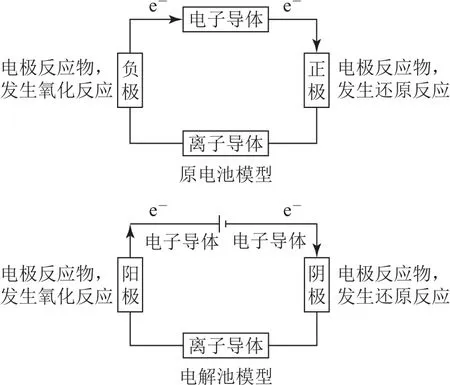
圖2
2 展示新型電池的最新研究成果,凸顯化學的使命感
能源是人類社會可持續發展的三大因素之一,因而對能源危機的解決主要集中在提高現有燃料的利用率與尋找新能源兩個方面,可以說是化學面臨的極大社會責任問題,需要不斷研究創新.
例2微生物燃料電池是指在微生物的作用下將化學能轉化為電能的裝置,某微生物燃料電池的工作原理如圖3所示,下列說法錯誤的是( ).

圖3
A.b電極發生還原反應:4H++O2+4e-=2H2O
B.電路中有4mol電子發生轉移,大約消耗標準狀況下22.4L空氣
C.維持兩種細菌存在,該裝置才能持續將有機物氧化成CO2并產生電子
D.HS-在硫氧化菌作用下轉化為的反應是
解析
以微生物燃料電池為情境素材,展現了電化學研究的多角度.由圖示可知,通O2的b電極為正極,發生的電極反應為4H++O2+4e-=2H2O,選項A正確;電路中有4mol電子發生轉移時,消耗O2為在標準狀況下體積為22.4L,則大約消耗標準狀況下空氣22.4L×5=112 L,選項B錯誤;硫酸鹽還原菌可以將有機物氧化成CO2,硫氧化菌可以將HS-氧化成,故兩種細菌存在時就會循環把有機物氧化成CO2并釋放出電子,所以選項C正確;HS-在硫氧化菌作用下轉化為,其電極反應式是HS-+4H2O-8e-=+9H+,選項D正確.答案為B.
例3一種釕(Ru)基配合物光敏染料敏化太陽能電池的示意圖如圖4所示.電池工作時電極上發生的反 應 為:(激發態),RuⅡ?-e-→RuⅢ,I-3+2e-→3I-.下列關于該電池的敘述正確的是( ).
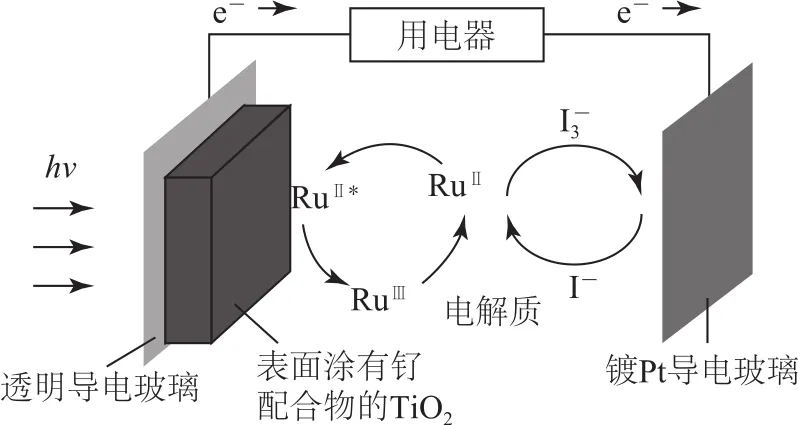
圖4
A.電池工作時,是將化學能轉化為電能
B.電池工作時,電解質溶液中I-和濃度不斷降低
C.透明導電玻璃上的電勢比鍍Pt導電玻璃上的電勢高
D.電解質溶液中發生反應2Ru3++3I-=2Ru2++
解析
本題以太陽能電池為情境素材,既體現科學家在新能源研究方面的成果,同時也從微觀角度圖了解發電的工作原理.根據圖示可知,太陽能電池是將太陽能轉化為電能的裝置,選項A錯誤;電池工作時,電解質溶液中I-3轉化為I-,選項B錯誤;電子由透明導電玻璃經用電器轉移至鍍Pt導電玻璃上,說明透明導電玻璃上的電勢比鍍Pt導電玻璃上的電勢低,選項C錯誤;由圖示可知,電解質溶液中發生協同反應:2Ru3++3I-=2Ru2++,選項D正確.答案為D.
解題策略在關注物質中元素價態的變化及微粒實際存在狀態前提下,利用守恒思想書寫電極反應式及總反應方程式.書寫電極反應式時,首先通過價態升降關系找出氧化劑與還原產物(或還原劑與氧化產物),然后寫出氧化劑+ne-→還原產物(或還原劑-ne-→氧化產物),最后利用電荷守恒、原子守恒配平即可,其中配平電荷守恒時一定要運用離子導體中的導電離子(或電解質溶液中的H+或OH-).
3 以電化學應用為情境,體現社會責任感
化學源于生活又服務于社會,這就是化學不斷向前發展的動力,因此涉及電化學在三廢處理、海水淡化、物質制備與測定等方面的新應用逐漸成為命題的熱點.
例4三室式電滲析法處理含NH4NO3廢水的原理如圖5所示,在直流電場的作用下,兩膜中間的和可通過離子交換膜,而兩端隔室中的離子被阻擋不能進入中間隔室.工作一段時間后,在兩極區均得到副產品NH4NO3.下列敘述正確的是( ).
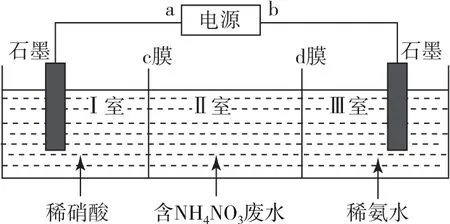
圖5
A.a極為電源負極,b極為電源正極
B.c膜是陰離子交換膜,d膜是陽離子交換膜
D.當電路中通過1mol電子的電荷量時,會有5.6LO2生成
解析
這是一道涉及廢水處理、變廢為寶的電化學試題.由“工作一段時間后,在兩極區均得到副產品NH4NO3”及裝置圖可知,Ⅱ室中的陽離子NH+4、H+向Ⅰ室移動,并與Ⅰ室中的稀硝酸反應生成了NH4NO3,故c膜為陽離子交換膜,Ⅰ室中石墨為電解池陰極,a極為電源負極,陰極電極反應式為2H2O+2e-=H2↑+2OH-;Ⅱ室中的陰離子、OH-向Ⅲ室移動,并與Ⅲ室中的稀氨水反應生成NH4NO3,故d膜為陰離子交換膜,Ⅲ室中石墨為電解池的陽極,b極為電源正極,陽極電極反應式為2H2O-4e-=O2↑+4H+,所以選項A正確、選項B與C錯誤;選項D中沒有給出標準狀況下,無法用氣體摩爾體積公式計算氣體體積,故錯誤.答案為A.
例5我國科學家開發設計出一種天然氣脫硫裝置,利用圖6裝置可實現反應H2S+O2=H2O2+S↓.已知甲池中有如圖7所示的轉化:
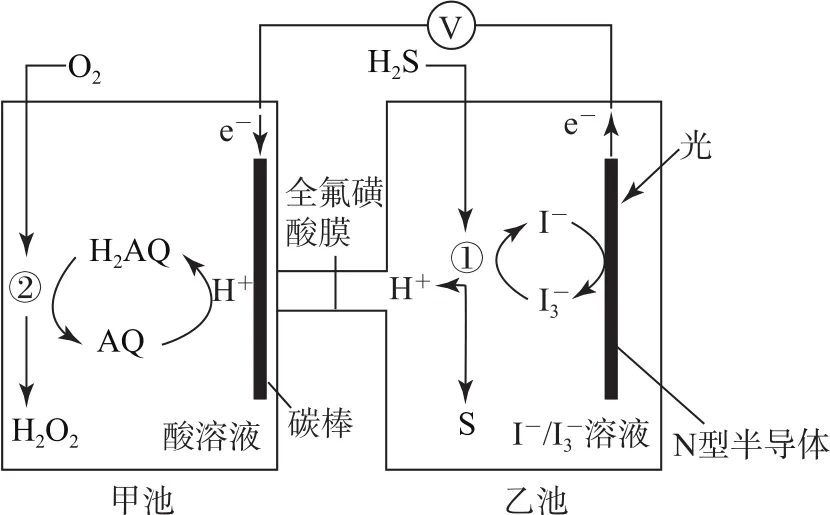
圖6
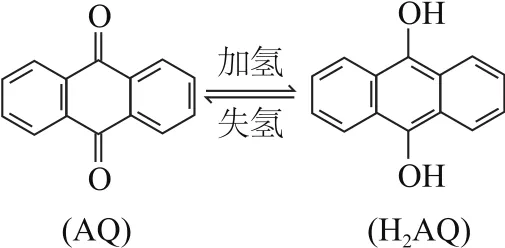
圖7
下列說法錯誤的是( ).
A.該裝置將光能只轉化為電能
B.該裝置工作時,溶液中的H+從甲池經過全氟磺酸膜進入乙池
C.甲池碳棒上發生電極反應:
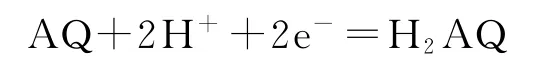
D.乙池①處發生反應:H2S+=3I-+S↓+2H+
解析
這是利用原電池原理來脫硫的試題.由圖中信息知光能轉化為電能和化學能,選項A錯誤;根據甲池中碳棒上發生消耗H+的反應可知,H+應從乙池移向甲池,選項B錯誤;甲池中碳棒是正極,電極反應式為AQ+2H++2e-=H2AQ,選項C正確;根據乙池①處箭頭方向知,發生的協同反應為H2S+I-3=3I-+S↓+2H+,選項D正確.答案為A、B.
知識延伸:電極反應是指在電極表面上進行的反應,其他發生的反應都不屬于電極反應.離子移動的目的一是為了形成閉合電路,二是為了中和(或減少)電極附近多余的電荷,以確保電極附近呈電中性.
4 與實驗探究、平衡與速率等知識相融合,凸顯學科內知識的綜合性
化學是一門以實驗為基礎,以理論與計算為指導的學科,因而諸多化學知識點不是孤立的,而是有機融合在一起成為一個較為完整的系統.
例6(2020年新課標Ⅰ)為驗證不同化合價鐵的氧化還原能力,利用圖8所示電池裝置進行實驗.
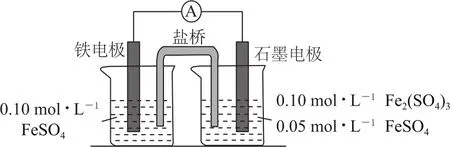
圖8
回答下列問題:
(1)由 FeSO4·7H2O 固體配制0.10mol·L-1FeSO4溶液,需要的儀器有藥匙、玻璃棒、________(從圖9中選擇,寫出名稱).
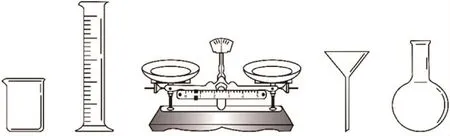
圖9
(2)電池裝置中,鹽橋連接兩電極電解質溶液.鹽橋中陰、陽離子不與溶液中的物質發生化學反應,并且電遷移率(μ∞)應盡可能地相近.根據表1數據,鹽橋中應選擇________作為電解質.
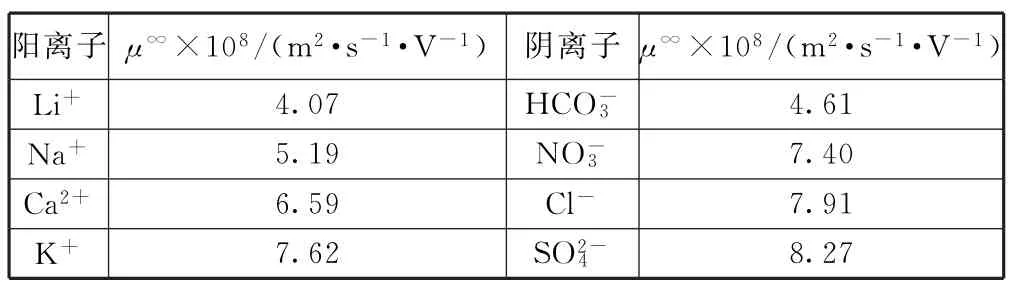
表1
(3)電流表顯示電子由鐵電極流向石墨電極.可知,鹽橋中的陽離子進入________電極溶液中.
(4)電池反應一段時間后,測得鐵電極溶液中c(Fe2+)增加了0.02mol·L-1.石墨電極上未見Fe析出.可知,石墨電極溶液中c(Fe2+)=________.
(5)根據(3)、(4)實驗結果,可知石墨電極的電極反應式為________,鐵電極的電極反應式為________.因此,驗證了Fe2+氧化性小于________,還原性小于________.
(6)實驗前需要對鐵電極表面活化.在FeSO4溶液中加入幾滴Fe2(SO4)3溶液,將鐵電極浸泡一段時間,鐵電極表面被刻蝕活化.檢驗活化反應完成的方法是________.
解析
這是一道實驗探究與電化學知識相融合的試題.(1)由 FeSO4·7H2O 固體配制0.10 mol·L-1FeSO4溶液的步驟為計算、稱量、溶解并冷卻至室溫、移液、洗滌、定容、搖勻、裝瓶、貼標簽,因而需要的儀器有藥匙、托盤天平、合適的量筒、燒杯、玻璃棒、合適的容量瓶、膠頭滴管.(2)FeSO4、Fe2(SO4)3都屬于強酸弱堿鹽,水溶液呈酸性,故Fe2+、Fe3+能與HCO-3反應,酸性條件下NO-3能與Fe2+反應,又因Ca2+能與SO2-4反應,所以根據題意“鹽橋中陰、陽離子不與溶液中的物質發生化學反應”,故鹽橋中陰離子不能選擇HCO-3、NO-3,陽離子不能選擇Ca2+,又因“鹽橋中陰、陽離子的遷移率(μ∞)應盡可能地相近”,故鹽橋中選擇KCl作為電解質.(3)根據“電流表顯示電子由鐵電極流向石墨電極”知,鐵電極為負極,石墨電極為正極,所以鹽橋中的陽離子進入石墨電極溶液中.(4)鐵電極上的反應式為Fe-2e-=Fe2+,石墨電極上的反應式為Fe3++e-=Fe2+,根據“電池反應一段時間后,測得鐵電極溶液中c(Fe2+)增加了0.02mol·L-1”,又由得失電子守恒,石墨電極溶液中c(Fe2+)增加0.04mol·L-1,故c(Fe2+)=0.05mol·L-1+0.04mol·L-1=0.09mol·L-1.(5)電池總反應為Fe+2Fe3+=3Fe2+,根據氧化還原反應強弱規律知:Fe2+氧化性小于Fe3+,還原性小于Fe.(6)鐵電極表面被刻蝕活化,發生的反應為Fe+Fe2(SO4)3=3FeSO4,要檢驗活化反應是否完成,只要檢驗溶液中不含Fe3+即可.
解題策略讀取題干,明確題意要求,運用所學知識及題干中的文字描述或圖示信息提示,解答具體問題即可.
電化學的命題素材比較新穎,命題的方式可以多變,但考查的知識點仍落到電化學的基本原理上,故學習或復習時一定要深度理解電化學的工作原理,以不變應萬變.

