番茄甾體生物堿合成酶基因SlERT1b的功能驗證及轉錄調控
黎晗 史云霞 袁弘倫 劉賢青 羅杰
摘 ?要:綠色番茄中的甾體生物堿主要以α-番茄堿(α-tomatine)形式存在,使得果實帶有苦味而不適宜食用。在果實成熟過程中,α-番茄堿會通過一系列酶促反應生成七葉皂苷A(esculeoside A),使果實適宜食用,然而這一代謝途徑尚未被完全解析。本課題組在先前研究中鑒定出一個參與這一代謝途徑的糖基轉移酶SlERT1b,本研究通過番茄的遺傳轉化實驗研究SlERT1b的功能,并利用LC-MS檢測其中的甾體生物堿,驗證該基因可發揮糖基轉移酶的功能。此外,施加外源乙烯和乙烯抑制劑1-MCP后,發現乙烯可調控SlERT1b基因,并影響甾體生物堿的合成途徑。同時鑒定出可以調控SlERT1b基因的轉錄因子SlJERF1和SlAREB2。該研究結果為今后番茄遺傳育種提供理論基礎。
關鍵詞:番茄;甾體生物堿;乙烯;轉錄因子
中圖分類號:Q946.92 ? ? ?文獻標識碼:A
Abstract: The steroidal glycoalkaloids in green tomatoes mainly exist in the form of α-tomatine, which gives tomatoes bitter taste and are not suitable for consumption. During the fruit ripening process, α-tomatine will generate esculeoside a through a series of enzymatic reactions, which makes fruits eatable. But the metabolic pathway has not been com-pletely elucidated. In the previous research, we identified a glycosyltransferase SlERT1b which is involved in this met-abolic pathway. In the study, the function of SlERT1b was studied by a tomato genetic transformation experiment. The steroidal glycoalkaloids were detected by LC-MS to verify the role in the metabolic pathway as a glycosyltrans-ferase. Furthermore, the application of exogenous ethylene and ethylene inhibitors 1-MCP could regulate SlERT1b and affect the synthesis of steroidal glycoalkaloids. In addition, we identified the transcription factors SlJERF1 and SlAREB2 which can regulate the expression of SlERT1b. This research provide theoretical basis for the tomato genetic breeding.
Keywords: Solanum lycopersicum; steroidal glycoalkaloids; ethylene; transcription factor
DOI: 10.3969/j.issn.1000-2561.2021.12.010
番茄(Solanum lycopersicum)是一種深受人們喜愛的蔬菜,其包含豐富的營養物質,如維生素、番茄紅素、β-類胡蘿卜素、類黃酮和植物甾醇等[1-4]。甾體生物堿(SGAs)是一類在茄科植物(番茄、馬鈴薯和茄子等)中發現的特有次生代謝物,又被稱為茄堿。甾體生物堿由糖苷配基和糖基側鏈組成[5]。馬鈴薯中甾體生物堿的主要形式有α-卡茄堿(α-chaconine)和α-茄堿(α-solanine)[6]。在番茄中甾體生物堿主要由2種形式存在,即α-番茄堿(α-tomatine)和脫氫番茄堿(dehydrotomatine),后者的B環5-6 C-C鍵為雙鍵[7-8]。番茄在生長過程中會遭遇諸多生物脅迫,如真菌、細菌和昆蟲等,甾體生物堿對這些脅迫具有一定的抗性[9]。甾體生物堿具有與生物膜上的膽固醇結合進而裂解膜結構的生物學活性,從而使植物獲得抗性[10]。甾體生物堿可以降低人體飲食中的膽固醇[11-12],另外有研究稱α-番茄堿可通過破壞細胞膜顯著地抑制癌細胞的生長[13]。不同于馬鈴薯中的α-卡茄堿和α-茄堿具有強烈毒性[6],番茄中的α-番茄堿對人體的毒性較低。一項研究發現秘魯存在一種高含量α-番茄堿的番茄品種,在食用后不存在不良反應,并發現番茄的苦味與α-番茄堿的含量呈正相關[14]。普通番茄在成熟過程中,α-番茄堿的含量迅速降低,果實的重量、成熟度和α-番茄堿含量具有顯著的相關性[15-17]。成熟果實中的主要甾體生物堿是七葉皂苷A(esculeoside A),由α-番茄堿合成而來[18-19]。有研究稱七葉皂苷A的生物活性可以改善小鼠的動脈粥樣硬化[20]。有研究推測α-番茄堿到七葉皂苷A的代謝途徑依次為羥化、酰基化、羥化和糖基化[21]。最新的一項研究發現一個酮戊二酸雙加氧酶可以參與該過程的第1步羥化反應[22-23]。然而,后續的代謝途徑受到哪些基因的作用尚未被解析。
研究甾體生物堿合成途徑的調控關系對解析其合成的分子機理具有重要意義,植物激素在植物生長發育和代謝物合成中起到關鍵的調控作用,激素通過影響響應的轉錄因子進而改變下游基因的表達。在成熟過程中,為使種子得以擴散,番茄生理、生化和細胞結構上的變化影響其外觀、質地和風味[24]。果實成熟受乙烯的調控[25],包括乙烯依賴性和非乙烯依賴性調控基因同時發揮作用,其中乙烯依賴性基因負責番茄紅素和芳香物質等的合成[26]。rin是一種番茄成熟突變體,rin基因與乙烯調控有關[27]。Picton等[28]從rin突變體差異cDNA文庫中分離出一些與番茄成熟過程中代謝途徑密切相關的成熟特異性基因。乙烯可促進成熟番茄中七葉皂苷A的積累[29],是乙烯可能調控甾體生物堿合成的一項有力證據。番茄成熟過程伴隨著甾體生物堿的變化從而改變其口感,這其中的轉錄調控值得探索。研究證實了一個ERF家族轉錄因子GAME9可作用于多個α-番茄堿的合成基因,因此顯著地調控甾體生物堿合成途徑[30-31],但是GAME9僅在植物葉片和未成熟果實中表達。番茄成熟過程中甾體生物堿的種類與含量發生顯著變化,但其受到哪些轉錄因子的調控尚未被發現,這有待進一步解析。
本課題組的前期研究通過對番茄的代謝物全基因組關聯分析,在10號染色體上定位到一個與多個甾體生物堿含量顯著相關的位點[32],并在該位點找到一個包含7個糖基轉移酶、1個酰基轉移酶、1個酰基輔酶A脫氫酶和1個細胞色素p450的基因簇,轉錄組分析表明,該基因簇上的基因均在紅果時期特異表達[32]。糖基轉移酶在甾體生物堿合成中發揮重要作用[33]。篩選基因簇上所有注釋的糖基轉移酶,發現存在一個關鍵的候選基因Solyc10g085230,與七葉皂苷A的含量呈顯著相關。其最初是從rin突變體差異cDNA文庫中分離出的成熟特異性基因,并命名為SlERT1b[28]。有報道稱SlERT1b的功能可能與果實成熟密切相關[28],本課題組推測SlERT1b很可能在成熟過程甾體生物堿的合成中發揮關鍵作用。本研究從轉基因水平,包括超表達和RNA干擾基因沉默,解析SlERT1b基因的生物學功能,并研究乙烯是否影響成熟過程中的甾體生物堿代謝,以及其中的轉錄調控關系,為完善番茄果實中甾體生物堿合成途徑提供理論基礎。
1 ?材料與方法
1.1 ?材料
1.1.1 ?植物材料 ?栽培種番茄(Solanum lycoper-sicum cv. MicroTOM)種子購自PanAmerican Seed公司(美國),于2020年秋至2021年春種植于海南大學熱帶農林實驗基地。本氏煙草(Nicotiana benthamiana)種子由本實驗室提供,種植于海南大學代謝生物學實驗室室內光照培養箱。
1.1.2 ?載體和菌株 ?本研究使用的載體包括Gateway克隆入門載體pDONR207,植物雙元表達載體pBI121,植物雙元超表達載體pK2GW7,植物雙元RNA干擾基因沉默載體pK7GWI?WG (II),酵母單雜交載體pHIS2和pGADT7和煙草LUC轉錄激活載體PJG094,均由本實驗室提供。所用大腸桿菌菌株T1、農桿菌菌株GV3101和酵母菌株Y187感受態細胞均購自上海唯地生物技術有限公司。
1.1.3 ?試劑和儀器 ?提取RNA的TransZol試劑和一步法反轉錄試劑盒購自北京全式金生物技術有限公司,限制性內切酶XbaⅠ、SacⅠ和T4連接酶購自NEB(北京)有限公司,Gateway克隆體系BP酶和LR酶購自賽默飛公司,乙烯利購自北京索萊寶科技有限公司,1-甲基環丙烯(1-MCP)購自上海源葉生物科技有限公司,PCR和qPCR引物由北京擎科新業生物技術有限公司合成,qPCR使用ChamQ Universal SYBR qPCR Master Mix購自諾唯贊公司,酵母轉化試劑盒(Frozen-EZ Yeast Transformation II)購自ZYMO RESEARCH公司(美國),雙熒光素酶報告分析系統試劑盒(Dual-Luciferase? Reporter Assay System)購自Promega公司(美國)。實時熒光定量PCR儀為賽默飛公司產品型號為QuantStudio 7 Flex,冷凍干燥機為CHRIST公司產品型號為Delta 2-24 LSCplus,代謝物檢測使用AB SCIEX公司的液相色譜質譜聯用儀器QTRAP 6500+,酶標儀為賽默飛公司產品型號為Varioskan LUX。
1.1.4 ?番茄遺傳轉化培養基 ?番茄種子萌發使用T0培養基,為1/2 MS培養基;預培養及共培養使用T1培養基,為添加有1 mg/L 6-芐氨基嘌呤和0.1 mg/L吲哚-3-乙酸的MS培養基;配制侵染液首先準備活化的OD600值約0.5的農桿菌,經過4 ℃離心后用添加40 mg/L乙酰丁香酮和2 g/L葡萄糖的MS液體培養基重懸菌體,并稀釋到OD600值為0.1~0.2方可使用;誘導生芽使用T21培養基,為添加有10 mg/L卡納霉素、200 mg/L特美汀、1 mg/L玉米素和0.1 mg/L吲哚-3-乙酸的MS培養基;誘導芽伸長使用T22培養基,為添加有10 mg/L卡納霉素、200 mg/L特美汀、1 mg/L赤霉素和0.5 mg/L玉米素的MS培養基;誘導生根使用T3培養基,為添加有5 mg/L卡納霉素、150 mg/L特美汀和2 mg/L吲哚-3-丁酸的1/2 MS培養基。
1.2 ?方法
1.2.1 ?基因克隆和轉基因載體構建 ?提取MicroTOM番茄紅果組織的RNA,并對RNA進行反轉錄,得到果肉cDNA用于基因克隆。下載番茄基因的參考序列(https://solgenomics.net),并使用Oligo 7設計引物,以cDNA為模板對候選基因進行PCR擴增,PCR程序為:94 ℃預變性2 min;98 ℃變性15 s,56 ℃退火30 s,68 ℃延伸90 s,32個循環;68 ℃延伸5 min。瓊脂糖凝膠電泳分析擴增結果。通過BP酶連接進pDONR207并送擎科公司進行測序。利用限制性內切酶XbaⅠ和SacⅠ對pBI121載體進行37 ℃酶切過夜得到線性化載體,同時使用帶XbaⅠ和SacⅠ的酶切接頭序列的引物擴增適應于Gateway體系的attR1-attR2序列,使用T4連接酶16 ℃過夜連接線性化載體和片段,得到適應于Gateway體系的帶有35S啟動子的植物雙元超表達載體pBI121-OE。使用LR酶將目標基因連接進pBI121-OE得到超表達載體。再在候選基因上擴增一段約250 bp的片段連接進pK7GWIWG(II)得到RNAi載體。
1.2.2 ?轉基因番茄的構建 ?利用得到的超表達和RNAi載體進行番茄遺傳轉化。用5%次氯酸鈉和75%乙醇溶液對MicroTOM番茄種子進行消毒后在T0培養基上培養。約7 d后取下番茄子葉并切下葉尖和尾部,在T1培養基培養2 d,準備侵染液侵染葉片15 min,接著置于T1培養基上暗培養2 d,然后置于T21培養基在16 h光照/8 h黑暗條件下培養,每隔14 d更換1次培養基,待幼芽長至2 cm時置于T22培養基中,待幼芽生長成形,將其切下置于T3培養基中,培養至幼苗長出根和新葉后移栽至室外。
1.2.3 ?實時熒光定量PCR ?使用基因特異性引物,以TIP41作為內參基因[34]。擴增反應體系和程序參照SYBR qPCR Master Mix說明書,反應總體系為10 μL,200 ng/μL的cDNA 1 μL,濃度10 μmol/L的上下游引物各0.25 μL,SYBR Mix 5 μL,雙蒸水3.5 μL。反應程序為:50 ℃ 2 min;95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,40個循環;95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s。采用2-ΔΔCT法計算相對表達量。
1.2.4 ?代謝物的檢測 ?(1)組織的選取:超表達和RNAi植株的甾體生物堿在不同組織中的含量檢測:在獲得SlERT1b的超表達和RNAi基因沉默的陽性植株后,取其葉片(L)、成熟綠色果實(MG)、破色期果實(Br)、破色期后5 d果實(Br+5)和破色期后10 d(Br+10)果實組織提取代謝物。乙烯處理后甾體生物堿的含量檢測:乙烯利(ET)處理組選擇成熟綠色果實(MG)和破色期果實(Br)組織提取代謝物,乙烯抑制劑(1-MCP)處理組選擇破色期果實(Br)組織提取代謝物。番茄果實發育的不同時期不同組織中的甾體生物堿含量檢測:采集番茄葉片(L)、未成熟綠果(IMG)、果肉為固體狀態的成熟綠果(MG1)、果肉介于固體和凝膠狀態的成熟綠果(MG2)、果肉為凝膠狀態的成熟綠果(MG3)、介于MG2和MG3的成熟綠果(MG2-3)、破色期果實(Br)、破色后5 d果實(Br+5)、破色后10 d果實(Br+10)和破色后15 d果實(Br+15)組織提取代謝物。
(2)提取與檢測:采集番茄組織樣品在液氮中速凍,使用冷凍干燥機進行凍干處理7 d,已凍干的樣品在研磨儀上研磨至粉末,稱取0.05~0.1 g粉末至2 mL離心管中,加入70%甲醇渦旋30 s后置于4 ℃冰箱,每隔10 min后渦旋1次,共3次,放置在4 ℃冰箱過夜,過夜后的樣品于4 ℃ 12 000 r/min離心10 min,吸取上清液過濾至進樣瓶中保存。在QTRAP 6500+儀器中用Scheduled MRM掃描模式進行檢測。
1.2.5 ?激素處理 ?分別對野生型MicroTOM番茄進行乙烯利和乙烯抑制劑1-MCP兩組處理,每組處理至少3株野生型。選取破色期后2 d的果實和成熟綠色果實作為對照,實驗組分別對相應的植株進行處理,植株上需要至少有1個破色期果實。對植株噴灑乙烯利溶液使密閉容器中含有500 mg/L乙烯氣體;噴灑1-MCP溶液使密閉容器中含有1 mg/L 1-MCP氣體。待植株上水珠自然滴落為止,處理時間48 h,處理完的植株取破色期果實和成熟綠色果實,所有樣品在液氮中速凍并在?80 ℃冰箱保存備用。
1.2.6 ?甾體生物堿合成的轉錄調控驗證 ?首先預測了SlERT1b啟動子上可能存在的轉錄因子結合元件,結合共表達和轉錄組分析[35]可能的轉錄因子,對候選轉錄因子進行酵母單雜交實驗,并進行煙草雙熒光素酶報告實驗。轉錄組數據選用如下組織:R85(番茄萌發后85 d的根)、S85(萌發后85 d的莖)、L85(萌發后85 d的葉)、IMG、MG、Br和Br15。
2 ?結果與分析
2.1 ?候選基因的分析
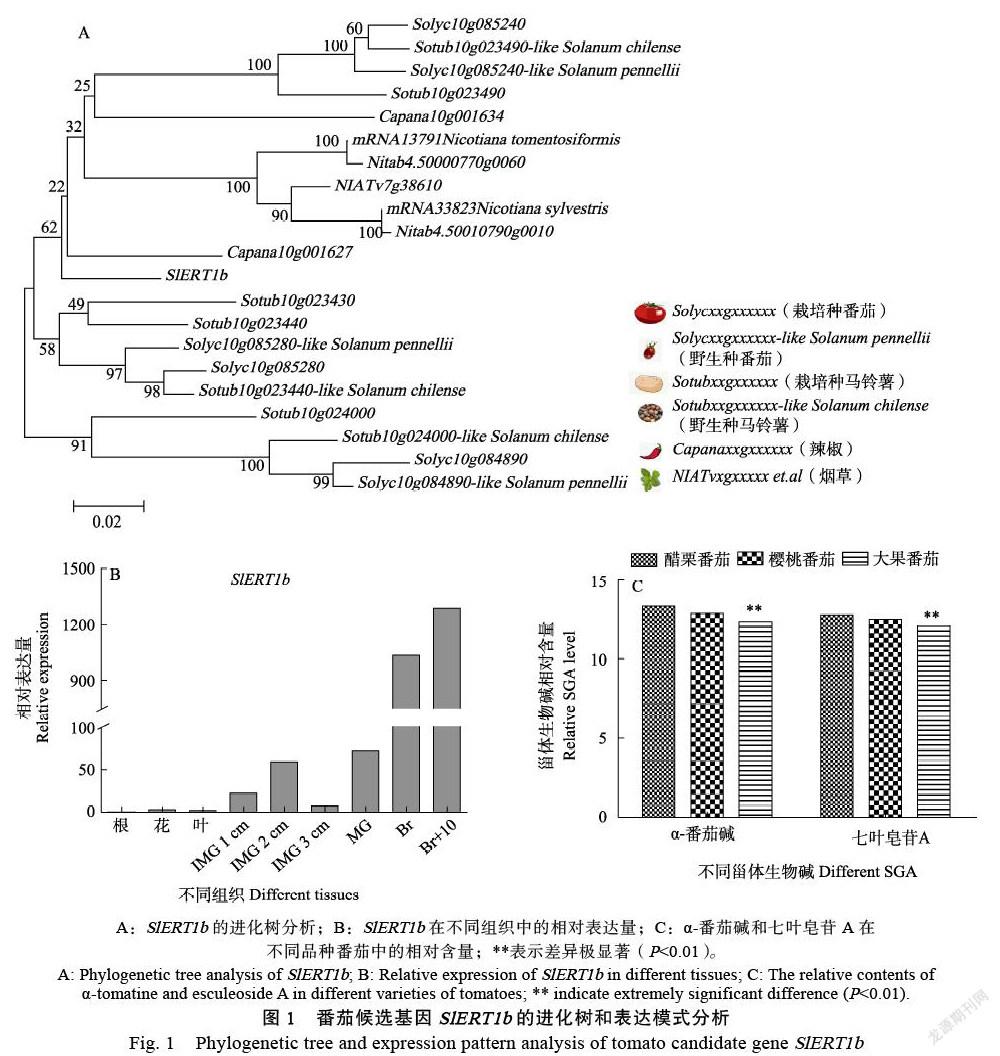
經系統進化樹分析(MEGA6),結果發現SlERT1b基因是茄科植物所特有的,并且與栽培型馬鈴薯的親緣關系最近(圖1A)。通過查閱番茄表達譜數據庫(http://ted.bti.cornell.edu/),發現SlERT1b在破色期及之后的果實中特異性表達(圖1B)。同時比較了不同番茄品種中主要甾體生物堿的含量,發現馴化后的栽培種番茄的含量低于野生型番茄(圖1C)。
2.2 ?番茄轉基因的構建
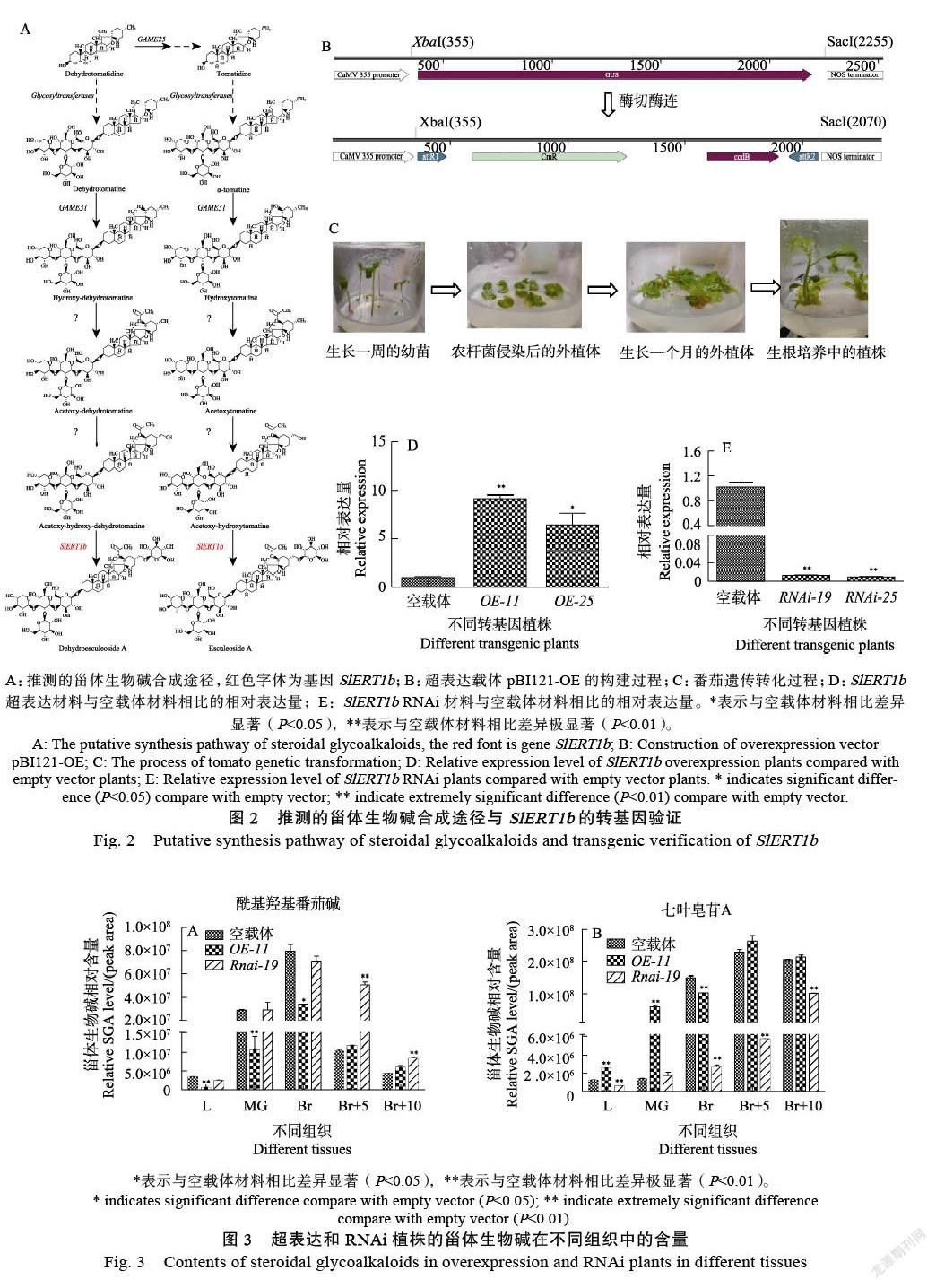
根據α-番茄堿在果實成熟中生成七葉皂苷A等皂苷類物質,中間相差4步推測的化學反應,分別有4個酶促反應(圖2A)。GAME31參與該過程的第1步是羥化反應,推測剩下3步反應分別是酰基化、羥化和糖基化反應,由于候選基因是一個糖基轉移酶基因,因此推測其參與最后一步糖基化反應。
由于該步反應的底物酰基羥基番茄堿(acetoxy-hydroxytomatine)難以獲取,所以本研究未進行體外驗證實驗。通過酶切酶連改造得到超表達載體pBI121-OE(圖2B)。對SlERT1b進行了轉基因驗證,經過番茄的遺傳轉化過程獲得了SlERT1b的超表達和RNAi株系(圖2C)。另外發現改變番茄中SlERT1b的表達,與野生型植株相比不會影響其正常生長發育。由于基因在紅果中特異表達,收集了轉基因株系紅果的RNA并進行實時熒光定量PCR檢測,其中OE-11和OE-25為超表達株系的陽性植株,Rnai-19和Rnai-25為RNAi株系的陽性植株(圖2D、圖2E)。
2.3 ?甾體生物堿含量的檢測
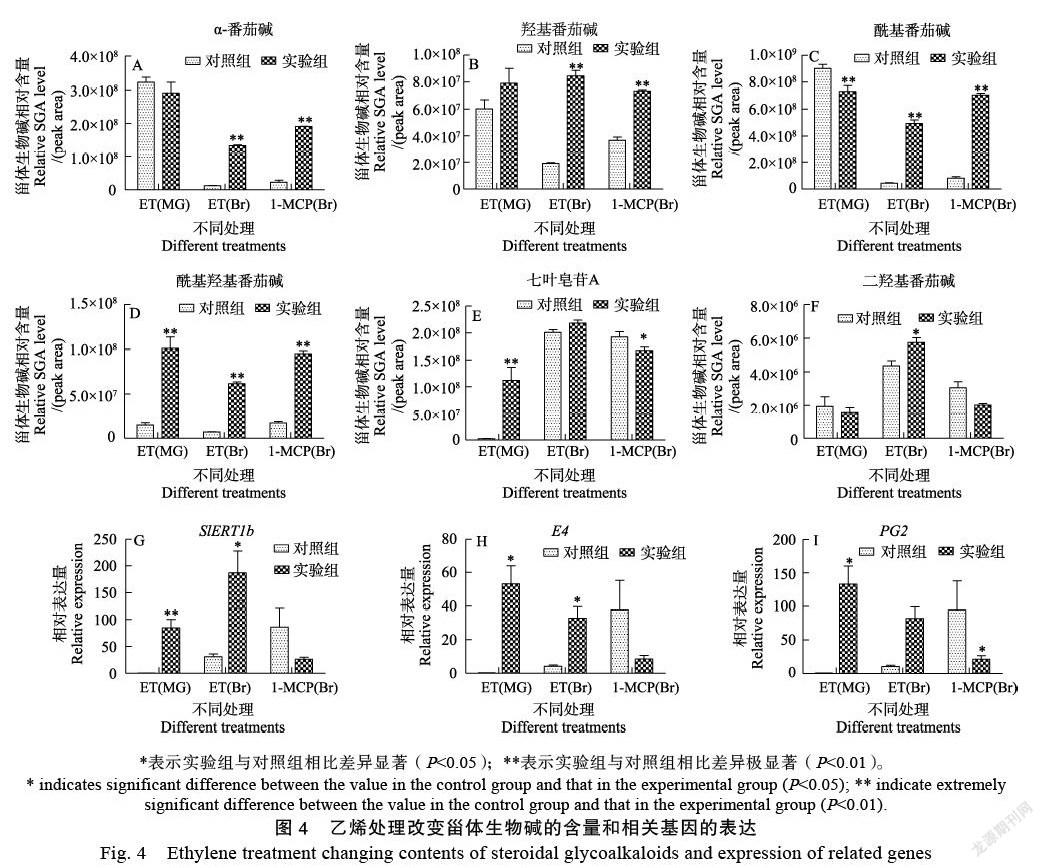
根據多反應監測-觸發增強子離子掃描模式(MRM-IDA-EPI)確定了α-番茄堿、羥基番茄堿(hydroxytomatine)、酰基番茄堿(acetoxyt?om?atine)、酰基羥基番茄堿和七葉皂苷A的碎片模式和保留時間。由于脫氫番茄堿及其下游物質的含量遠低于α-番茄堿及其下游物質,所以未能成功檢測到。分別對SlERT1b的超表達和RNA干擾基因沉默植株檢測了5個不同組織的α-番茄堿等5種物質的相對含量。發現超表達植株的葉片、成熟綠色果實和破色期果實中的酰基羥基番茄堿含量顯著低于空載體植株,RNAi植株的破色期后5 d和破色期后10 d的酰基羥基番茄堿含量顯著高于空載體植株(圖3A)。另外發現超表達植株在葉片和成熟綠色果實中的七葉皂苷A含量顯著高于空載體植株,而RNAi植株在葉片、破色期果實、破色期后5 d和破色期后10 d的七葉皂苷A含量顯著低于空載體植株(圖3B)。
2.4 ?乙烯參與甾體生物堿合成的調控
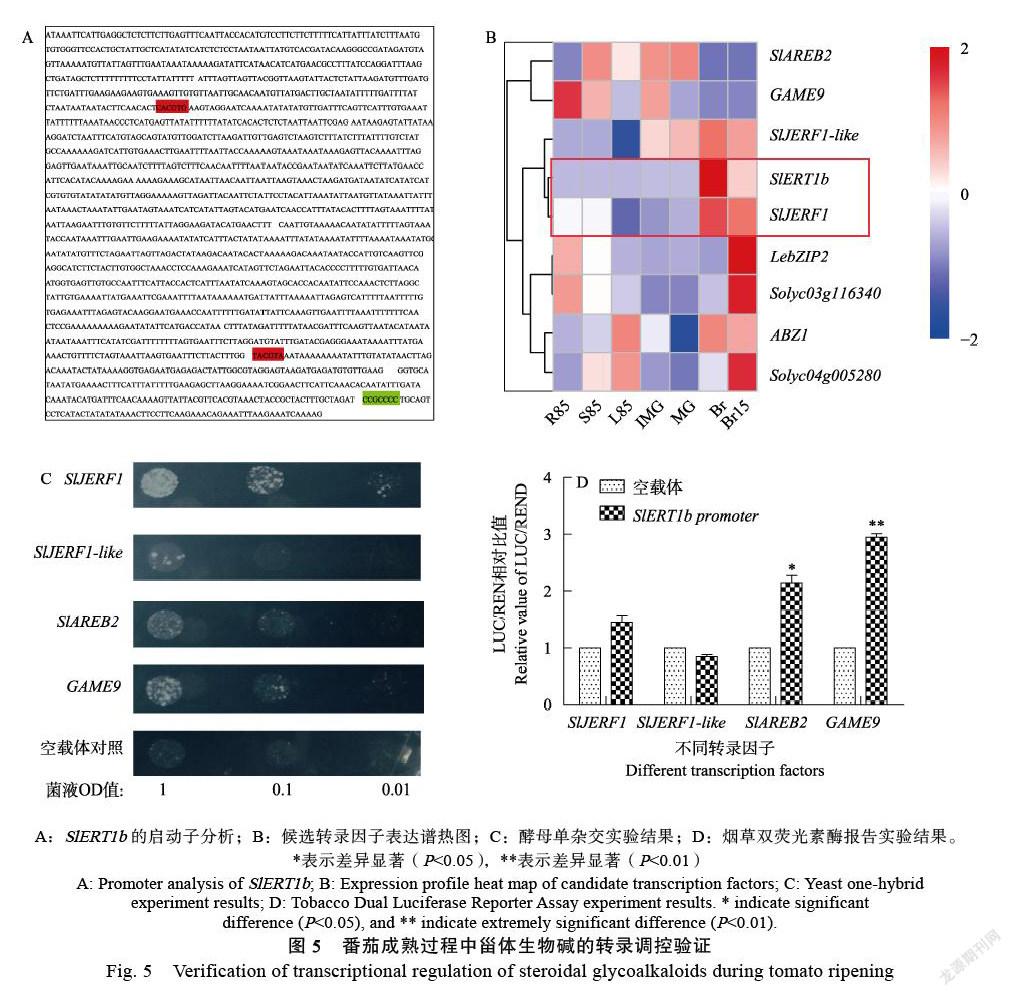
乙烯處理后成熟綠色果實的α-番茄堿和羥基番茄堿含量無顯著變化,酰基番茄堿的含量顯著下降,酰基羥基番茄堿和七葉皂苷A的含量顯著升高。乙烯處理后的破色期果實除七葉皂苷A含量升高不顯著,其他都顯著升高。乙烯利抑制劑1-MCP處理后的破色期果實除七葉皂苷A和二羥基番茄堿(di-hydroxytomatine)含量顯著降低外,?其他含量均顯著升高(圖4A~圖4F)。
為了解乙烯處理是否是通過影響SlERT1b的表達進而影響代謝物的含量,提取了對照組和實驗組的果實RNA并進行實時熒光定量PCR檢測。結果發現乙烯處理后不論是成熟綠色果實還是破色期果實,SlERT1b的相對表達量比對照顯著升高,而1-MCP處理后其表達量降低(圖4G)。PG2和E4是乙烯響應基因,受到乙烯的誘導表達,表達量變化符合預期,證明乙烯處理有效(圖4H、圖4I)。
2.5 ?果實成熟過程甾體生物堿合成的轉錄調控
本研究預測SlERT1b啟動子上可能存在的轉錄因子結合元件,紅色區域為G-Box元件,綠色區域為GCC-Box元件(圖5A)。結合共表達和轉錄組分析,找到一些可能與SlERT1b互作的轉錄因子,發現SlJERF1與SlERT1b的表達譜在一個聚類中(圖5B)。對其中4個候選轉錄因子進行酵母單雜交實驗,分別為SlJERF1、SlJERF1-like、SlAREB2和GAME9與SlERT1b啟動子的組合,發現SlJERF1可以在三缺培養基上生長,說明SlJERF1與SlERT1b啟動子區存在互作(圖5C)。另外進行了煙草雙熒光素酶報告實驗,結果發現SlERT1b可被SlJERF1、SlAREB2和GAME9反式激活(圖5D)。
2.6 ?番茄果實發育的不同時期不同組織中甾體生物堿的含量變化
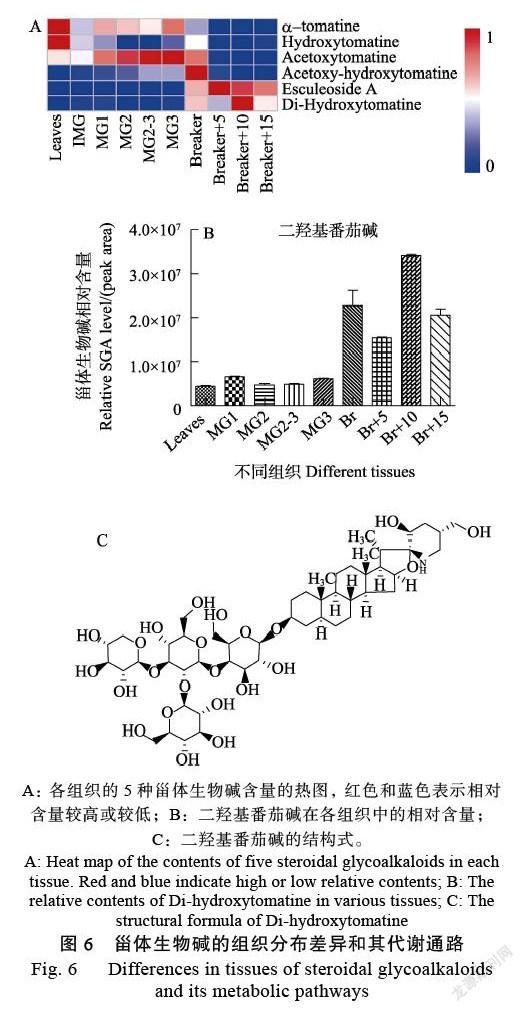
在番茄果實發育的不同時期,α-番茄堿及其下游的4種物質羥基番茄堿、酰基番茄堿、酰基羥基番茄堿和七葉皂苷A發生了動態變化。檢測了所有組織中的5種甾體生物堿的含量變化,首次發現5種甾體生物堿的含量在發育過程中依次出現峰值,α-番茄堿和羥基番茄堿主要存在于未成熟綠色果實,酰基番茄堿主要存在于MG2和MG3之間,酰基羥基番茄堿主要存在于破色期果實,而七葉皂苷A主要存在于破色后的果實中(圖6A)。此外,α-番茄堿在MG3時的含量較其他時期較高,羥基番茄堿在破色期的含量較其他時期較高,推測在這一階段,α-番茄堿被誘導大量合成,隨之轉化為羥基番茄堿。存在一種二羥基番茄堿,它在α-番茄堿的結構上加上2個羥基(圖6C)。通過檢測發現二羥基番茄堿在破色期及之后的階段顯著積累,推測在破色期含量異常上升的羥基番茄堿被轉化為二羥基番茄堿(圖6B)。
3 ?討論
本研究驗證了一個參與番茄成熟過程甾體生物堿合成的糖基轉移酶SlERT1b。由于酰基羥基番茄堿是SlERT1b的潛在上游底物,而七葉皂苷A是它的潛在下游產物,本研究結果初步證明SlERT1b發揮著催化酰基羥基番茄堿生成七葉皂苷A的糖基轉移酶活性,因此可以使果實中高毒性的α-番茄堿減少,低毒性的七葉皂苷A等皂苷類物質增加。可以推測,植物在發育早期,葉片和未成熟果實中的α-番茄堿可以有效地防止昆蟲等的侵害。在發育的后期,成熟的果實中帶苦味的α-番茄堿向不帶苦味的七葉皂苷A等物質的轉變使果實適宜食用,因而可以吸引動物的取食,使種子得以傳播。在對SlERT1b進行系統發育樹分析后發現該基因是茄科植物中特有的,僅存在于番茄、馬鈴薯、辣椒和煙草等。其中與馬鈴薯中的同源基因同源性最高。我們推測馬鈴薯的同源基因可能也具有類似的甾體生物堿糖基轉移酶活性。
番茄果實的成熟伴隨著肉眼可見的顏色、質地及其中的代謝物等變化,這一過程通常是由于乙烯等激素的產生而發生。類胡蘿卜素如番茄紅素在成熟番茄中受到乙烯的誘導而大量積累[36],還有諸多糖、酸和揮發物在成熟過程中被合成,使得果實具有良好的口感和風味[37]。番茄作為一種呼吸躍變植物,擁有2套乙烯調節系統,系統1在全部組織中保持基礎的乙烯水平,系統2在果實成熟時大量生成乙烯,進而影響整個成熟過程[38]。乙烯積累誘導了一系列果實成熟相關的基因,進而改變番茄的顏色、質地及代謝物等[39-40]。在本研究的乙烯及1-MCP處理實驗中,相關的甾體生物堿含量被顯著地上調或下調。其中,乙烯處理后的成熟綠色果實的酰基番茄堿含量下降,而二羥基番茄堿含量上升,他們擁有共同的上游物質羥基番茄堿,這意味著乙烯的處理可能激活了一種潛在的羥化酶,使得代謝途徑從主要合成酰基番茄堿變為合成二羥基番茄堿,而下游物質酰基羥基番茄堿和七葉皂苷A的含量上升意味著二羥基番茄堿可以繼續合成下游物質。因此,乙烯可能誘導這一代謝途徑的所有羥化酶和糖基轉移酶,而其中的酰基轉移酶不能被其誘導。先前的研究認為一個酮戊二酸雙加氧酶GAME31可以催化α-番茄堿合成羥基番茄堿,但同時也指出其在栽培種番茄中基因表達量較低[22]。本研究進行了實時熒光定量PCR發現GAME31不論是正常水平還是乙烯處理水平均沒有表達,因此認為GAME31可能不是栽培種番茄中的甾體生物堿羥化酶。另外,在本研究進行的同時,有一項研究也驗證了SlERT1b能夠參與這一糖基轉移反應[41]。雖然這一甾體生物堿合成途徑中只有SlERT1b的功能已知,尚不確定其他步驟是由哪些酶催化的,但是本研究證明了乙烯可以影響這一代謝途徑,這將為今后的研究提供一定的理論基礎。
轉錄因子在轉錄調控中發揮重要作用,GAME9是甾體生物堿合成中已被報道的最重要的轉錄因子,在葉片和綠果等不可食用組織中特異表達,參與甾體生物堿合成途徑的調控[30]。但是在番茄成熟過程中,并沒有報道其合成的調控機理。本研究發現SlJERF1、SlAREB2和GAME9均對SlERT1b有調控作用,但是GAME9的表達模式不同于SlERT1b,因此不能確定其在植物中發揮調控SlERT1b的功能。SlJERF1是一個可被茉莉酸、乙烯、脫落酸和鹽脅迫誘導表達的ERF家族轉錄因子[42],SlAREB2是一個響應脫落酸信號的轉錄因子,但其功能尚不清楚[43-44]。這些結果可以證明SlJERF1、SlAREB2和GAME9可以在轉錄水平上調控SlERT1b。但目前尚不確定這些轉錄因子是否為成熟過程中影響甾體生物堿合成的最主要轉錄因子,有待今后研究。
參考文獻
[1] 趙美佳, 鄒 ?通, 湯澤君, 等. 番茄營養成分以及國內外加工現狀[J]. 食品研究與開發, 2016, 37(10): 215-218.
[2] 尚樂樂, 宋建文, 王嘉穎, 等. 番茄果實品質形成及其分子機理研究進展[J]. 中國蔬菜, 2019(4): 21-28.
[3] Beecher G R. Nutrient content of tomatoes and tomato products[J]. Proceedings of the Society for Experimental Biology and Medicine, 1998, 218(2): 98-100.
[4] Dorais M, Ehret D L, Papadopoulos A P. Tomato (Solanum lycopersicum) health components: from the seed to the con-sumer[J]. Phytochemistry Reviews, 2008, 7(2): 231-250.
[5] Fontaine T D, Irving G W. Isolation and partial characterization of crystalline tomatine, an antibiotic agent from the tomato plant[J]. Archives of Biochemistry, 1948, 18(3): 467-475.
[6] Friedman M. Potato glycoalkaloids and metabolites: roles in the plant and in the diet[J]. Journal of Agricultural and Food Chemistry, 2006, 54(23): 8655-8681.
[7] Fontaine T D, Ard J S, Ma R M. Tomatidine, a steroid sec-ondary amine1[J]. Journal of the American Chemical Society, 1951, 73(2): 878-879.
[8] Friedman M, Levin C E, Mcdonald G M. α-tomatine deter-mination in tomatoes by HPLC using pulsed amperometric detection[J]. Journal of Agricultural and Food Chemistry, 1994, 42(9): 1959-1964.
[9] Friedman M. Tomato glycoalkaloids: role in the plant and in the diet[J]. Journal of Agricultural and Food Chemistry, 2002, 50(21): 5751-5780.
[10] Elias P M, Friend D S, Goerke J. Membrane sterol hetero-geneity. Freeze-fracture detection with saponins and fili-pin[J]. Journal of Histochemistry and Cytochemistry, 1979, 27(9): 1247-1260.
[11] Friedman M, Fitch T E, Yokoyama W E. Lowering of plas-ma LDL cholesterol in hamsters by the tomato glycoal-kaloid tomatine[J]. Food and Chemical Toxicology, 2000, 38(7): 549-553.
[12] Friedman M, Fitch T E, Levin C E, et al. Feeding tomatoes to hamsters reduces their plasma low-density lipoprotein cholesterol and triglycerides[J]. Journal of Food Science, 2000, 65(5): 897-900.
[13] Friedman M, Mcquistan T, Hendricks J D, et al. Protective effect of dietary tomatine against dibenzo[a, l]Pyrene (DBP)-induced liver and stomach tumors in rainbow trout[J]. Molecular Nutrition and Food Research, 2007, 51(12): 1485-1491.
[14] Rick C M, Uhlig J W, Jones A D. High alpha-tomatine con-tent in ripe fruit of Andean Lycopersicon esculentum var. Cerasiforme: developmental and genetic aspects[J]. Pro-ceedings of the National Academy of Sciences, 1994, 91(26): 12877-12881.
[15] Kozukue N, Friedman M. Tomatine, chlorophyll, β-carotene and lycopene content in tomatoes during growth and maturation[J]. Journal of the Science of Food and Agriculture, 2003, 83(3): 195-200.
[16] Eltayeb E A, Roddick J G. Biosynthesis and degradation of α-tomatine in developing tomato fruits[J]. Phytochemistry, 1985, 24(2): 253-257.
[17] Eltayeb E A, Roddick J G. Changes in the alkaloid content of developing fruits of tomato (Lycopersicon esculentum Mill.): I. Analyses of cultivars and mutants with different ripening characteristics[J]. Journal of Experimental Botany, 1984, 35(151): 252-260.
[18] Yahara S, Uda N, Yoshio E, et al. Steroidal alkaloid glyco-sides from tomato (Lycopersicon esculentum)[J]. Journal of Natural Products, 2004, 67(3): 500-502.
[19] Yamanaka T, Vincken J P, De Waard P, et al. Isolation, characterization, and surfactant properties of the major tri-terpenoid glycosides from unripe tomato fruits[J]. Journal of Agricultural and Food Chemistry, 2008, 56(23): 11432- 11440.
[20] Fujiwara Y, Kiyota N, Hori M, et al. Esculeogenin A, a new tomato sapogenol, ameliorates hyperlipidemia and atheros-clerosis in ApoE-deficient mice by inhibiting ACAT[J]. Ar-teriosclerosis Thrombosis and Vascular Biology, 2007, 27(11): 2400-2406.
[21] Iijima Y, Nakamura Y, Ogata Y, et al. Metabolite annota-tions based on the integration of mass spectral information[J]. Plant Journal, 2008, 54(5): 949-962.
[22] Cárdenas P D, Sonawane P D, Heinig U, et al. Pathways to defense metabolites and evading fruit bitterness in genus Solanum evolved through 2-oxoglutarate-dependent dioxygenases[J]. Nature Communications, 2019, 10(1): 5169.
[23] Nakayasu M, Akiyama R, Kobayashi M, et al. Identification of α-tomatine 23-hydroxylase involved in the detoxification of a bitter glycoalkaloid[J]. Plant and Cell Physiology, 2020, 61(1): 21-28.
[24] Seymour G I, Taylor J, Tucker G A. Biochemistry of fruit ripening[J]. Indian Journal of Agricultural Biochemistry, 1993, 18(2): 51-60.
[25] Oeller P W, Lu M W, Taylor L P, et al. Reversible inhibition of tomato fruit senescence by antisense RNA[J]. Science, 1991, 254(5030): 437-439.
[26] Theologis A, Oeller P W, Wong L M, et al. Use of a tomato mutant constructed with reverse genetics to study fruit ri-pening, a complex developmental process[J]. Developments in Genetics, 1993, 14(4): 282-295.
[27] Lincoln J E, Fischer R L. Regulation of gene expression by ethylene in wild-type and rin tomato (Lycopersicon esculen-tum) fruit[J]. Plant Physiology, 1988, 88(2): 370-374.
[28] Picton S, Gray J, Barton S, et al. cDNA cloning and charac-terisation of novel ripening-related mRNAs with altered pat-terns of accumulation in the ripening inhibitor (rin) tomato ripening mutant[J]. Plant Molecular Biology, 1993, 23(1): 193-207.
[29] Iijima Y, Fujiwara Y, Tokita T, et al. Involvement of ethy-lene in the accumulation of esculeoside A during fruit ripening of tomato (Solanum lycopersicum)[J]. Journal of Agricultural and Food Chemistry, 2009, 57(8): 3247-3252.
[30] Cárdenas P D, Sonawane P D, Pollier J, et al. GAME9 regu-lates the biosynthesis of steroidal alkaloids and upstream isoprenoids in the plant mevalonate pathway[J]. Nature Communications, 2016, 7: 10654.
[31] Nakayasu M, Shioya N, Shikata M, et al. JRE4 is a master transcriptional regulator of defense-related steroidal gly-coalkaloids in tomato[J]. Plant Journal, 2018, 94(6): 975- 990.
[32] Zhu G, Wang S, Huang Z, et al. Rewiring of the fruit meta-bolome in tomato breeding[J]. Cell, 2018, 172(1-2): 249- 261.
[33] Expósito-Rodríguez M, Borges A A, Borges-Pérez A, et al. Selection of internal control genes for quantitative real-time RT-PCR studies during tomato development process[J]. BMC Plant Biology, 2008, 8: 131.
[34] Li Y, Chen Y, Zhou L, et al. MicroTom metabolic network: rewiring tomato metabolic regulatory network throughout the growth cycle[J]. Molecular Plant, 2020, 13(8): 1203-1218.
[35] Itkin M, Rogachev I, Alkan N, et al. GLYCOALKALOID METABOLISM1 is required for steroidal alkaloid glycosy-lation and prevention of phytotoxicity in tomato[J]. Plant Cell, 2011, 23(12): 4507-4525.
[36] Liu L, Shao Z, Zhang M, et al. Regulation of carotenoid metabolism in tomato[J]. Molecular Plant, 2015, 8(1): 28-39.
[37] Klee H J, Giovannoni J J. Genetics and control of tomato fruit ripening and quality attributes[J]. Annual Review of Genetics, 2011, 45: 41-59.
[38] Mcmurchie E J, Mcglasson W B, Eaks I L. Treatment of fruit with propylene gives information about the biogenesis of ethylene[J]. Nature, 1972, 237(5352): 235-236.
[39] Carrari F, Fernie A R. Metabolic regulation underlying to-mato fruit development[J]. Journal of Experimental Botany, 2006, 57(9): 1883-1897.
[40] Lucille A, Don G. Ethylene biosynthesis and action in tomato: a model for climacteric fruit ripening[J]. Journal of Experimental Botany, 2002(377): 2039-2055.
[41] Szymański J, Bocobza S, Panda S, et al. Analysis of wild tomato introgression lines elucidates the genetic basis of transcriptome and metabolome variation underlying fruit traits and pathogen response[J]. Nature Genetics, 2020, 52(10): 1111-1121.
[42] Zhang H, Huang Z, Xie B, et al. The ethylene-, jasmonate-, abscisic acid-and NaCl-responsive tomato transcription fac-tor JERF1 modulates expression of GCC box-containing genes and salt tolerance in tobacco[J]. Planta, 2004, 220(2): 262-270.
[43] Mou W, Li D, Luo Z, et al. SlAREB1 transcriptional activa-tion of NOR is involved in abscisic acid-modulated ethylene biosynthesis during tomato fruit ripening[J]. Plant Science, 2018, 276: 239-249.
[44] Orellana S, Ya?ez M, Espinoza A, et al. The transcription factor SlAREB1 confers drought, salt stress tolerance and regulates biotic and abiotic stress-related genes in tomato[J]. Plant Cell Environment, 2010, 33(12): 2191-2208.
責任編輯:黃東杰

