烤煙根腐病對煙株根際土壤真菌群落結構的影響
鄭元仙 楊敏 王繼明 許銀蓮 蔡憲杰 黃飛燕 童文杰 陳小龍 余磊 何元勝

摘要:為從微生物生態學角度探求烤煙根腐病的發生原因并為其防控提供理論依據,利用Illumina Miseq高通量測序分析了煙草根腐病發病和健康植株根際土壤真菌群落結構的差異,結果表明,烤煙根腐病發生對烤煙根際士壤真菌的豐富度有顯著影響,其中健康和患病煙株根際土壤樣品中真菌OTU數分別為904個和647個,健康煙株真菌OTU總數為患病煙株的40倍,特有OTUs數是患病煙株的2.59倍;患病煙株根際土壤真菌群落多樣性水平顯著低于健康煙株土壤,患病煙株根際土壤的Shannon、ACE和Chaol指數分別較健康植株降低了29.81%6、40.12%6和40.61%;同時,患病煙株與健康煙株根際土壤真菌群落的優勢物種顯著不同,患病煙株根際土壤中烤煙根腐病病原菌茄鐮刀菌(F.solani)相對豐度較健康煙株根際土壤增加了303.45%,為健康煙株的4.03倍,且棘孢木霉(7 ichoderma asperella)和青霉菌(Penicillium raper)的相對豐度亦較健康煙株分別增加了17.62%和50.46%。煙草植株根際土壤中真菌群落結構改變及物種多樣性降低是烤煙根腐病發生的重要特征。研究可為該病害的早期預防或生態調控提供科學依據。
關鍵詞:烤煙;根腐病;根際生物;群落結構;多樣性
煙草是云南重要的經濟作物之一。由鐮刀菌屬(Fusarium spp)真菌侵染引起的烤煙根腐病是云南臨滄等植煙區重要土傳病害之一,發病煙株葉片變黃,莖稈變黑,維管束常變黑壞死,根系腐爛,嚴重時煙株常整株枯死山。該病在臨滄部分植煙區發病率為15.5%~56.3%,嚴重影響了煙葉的產量與質量。目前生產中尚無有效的防治根腐病方法。因此,尋求該病害早期預防或生態調控措施尤為迫切。
土壤是作物生長的基礎,同時也是土傳病原物和各類土壤微生物棲息的重要場所。根際土壤微生物與土傳病原物同時生長在一個環境中,二者互作會對植物病害的發生和發展產生直接或間接影響。大量研究表明,土壤微生物的數量和活性與土傳病害的發生存在一定聯系,在微生物多樣性豐富的土壤中病原菌較難生存,而土傳病害的發生也會導致土壤微生物的多樣性降低。研究表明,健康植株與患病植株根際微生物在數量上存在一定差異。同時,根際微生物與植物抗病性也有著密切的關系,研究發現通過調節土壤微生態可以很好地防治煙草青枯病的發生,黃瓜根際土壤的某些真菌對黃瓜土傳病害有防治作用。由此可見,了解病原菌與根際其他微生物的功能及二者互作關系對土傳病害的防治具有重要意義。
根際微生物組成復雜、活性高,常被稱為植物的第二基因組,而高通量測序技術具有獲得的信息量大、樣品間平行性好等優點,可快速、準確、全面地探究樣品中微生物的群落種類、數量,獲取更加豐富的微生物多樣性信息。因此,本研究采用Illumina Miseq高通量測序技術分析健康煙株與患烤煙根腐病煙株根際土壤真菌群落多樣性的差異,旨在從微生物生態學角度分析烤煙根腐病的發生原因,并為該病害的有效預防或生態防控提供科學依據。
1材料與方法
1.1試驗地點
供試土壤樣品于2018年7月采集于云南省臨滄市耿馬縣勐撒鎮烤煙植煙區(99°232”E,23°3340N),試驗區植煙土壤類型為紅壤,土壤質地為輕黏土,供試烤煙品種為云煙87,試驗區施肥及其他田間管理措施一致,均參照當地優質煙葉生產管理辦法執行。
1.2土樣采集
選取烤煙根腐病典型發病煙田,在同一地塊中(自然條件及土壤性質相似)選取具烤煙根腐病典型癥狀的煙株和健康煙株各3株,收集附著在根上04mm的土壤作為根際土,分別命名為Pathogen(發病土)和Health(健康土),去除土樣中的雜物、細根后放入自封袋中(各煙株根際土樣單獨保存),立即置于液氮中運回實驗室,置于-80℃冰箱中保存備用。
1.3土壤真菌多樣性的測定
1.3.1基因組DNA的提取和PCR擴增參照FASTDNARSPINKitforSoil(MP,USA)土壤基因組DNA提取試劑盒的步驟提取各根際壤樣品DNA,DNA濃度和純度利用Nanodrop2000進行檢測,利用1%瓊脂糖凝膠電泳檢測DNA提取質量。使用弓ITS1F(5'ACTTGGTCATTTAGAGGAAGTAA-3)/ITS2R(5'-BGCTGCGTTCTTCATCGATGC-3)對18SIRNA基因的ITS-1可變區進行PCR擴增,擴增程序為:95℃預變性3min;95℃變性30s,55℃退火30s,72℃延伸45,36個循環;72℃延伸10min。擴增體系為20uL:4uL5×Fastpfu緩沖液;2uL2.5mmol/LDNTPS;0.8uLForwardPrimer(5umol/L);0.8HLReversePrimer(5umol/L);0.4ulFastpfu:聚合酶;02HLBSA10ngDNA模板;加dHO至20uL。使用2%6瓊脂糖凝膠回收PCR產物,利用AxyprepDNAGelExtractionKit(Axygen,USA)試劑盒進一步純化回收后,送上海美吉生物醫藥科技有限公司進行Mise測序。
1.3.2數據的質控與分析原始測序序列使用Irimmomatic軟件質控,用FLASH軟件進行序列拼接;通過Search軟件(Version7.0)過濾并去除嵌合體序列得到有效序列;用Uparsell軟件(Version7.1)在97%的相似性水平上劃分操作分類單元;代表序列用RDPclassifier軟件剛和SIVA數據庫進行物種注釋,利用Mothur軟件(versionV.1.30.1作稀釋度曲線,計算文庫覆蓋率Coverage)、Shannon、Simpson、ACE及Chaol指數,對物種的多樣性和豐富度指數進行評價;利用Qime軟件(Version1.7.0)建立的Bray-Curtis距離算法進行主坐標分析(PCOA)。
2結果
2.1真菌的OTU豐度和Alpha多樣性
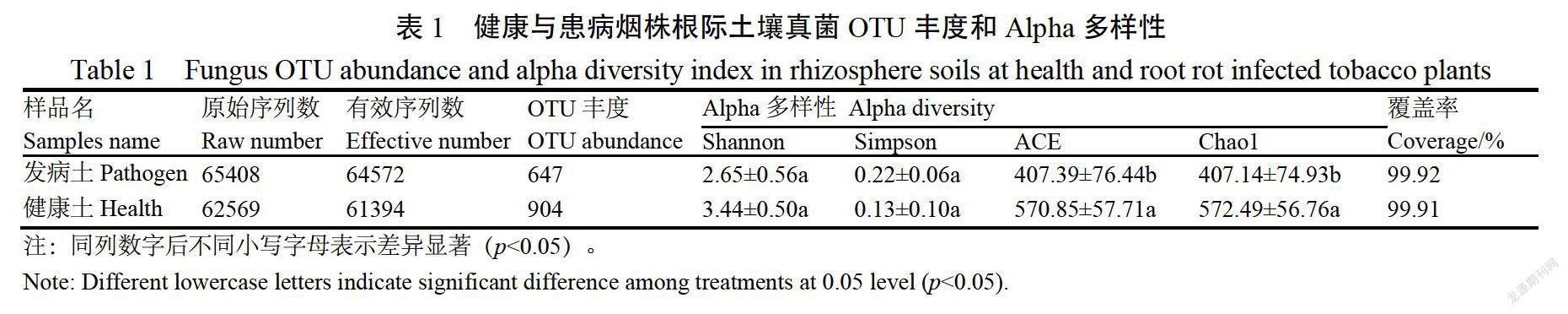
在97%相似水平上土壤樣品真菌群落OTU豐度和多樣性指數如表1所示,香農指數稀釋度曲線顯示(圖1),隨著測序數量的上升,稀釋度曲線斜率逐漸下降,趨向平坦,說明測序數量足夠。覆蓋率(Coverage)是指樣本中序列被檢測出的概率,其值越高,代表本次測序結果越符合樣本中微生物的實際情況,在本試驗中,2個處理的覆蓋率分別為9%和99.91%(表1),表明測序讀長足以進行此項分析。
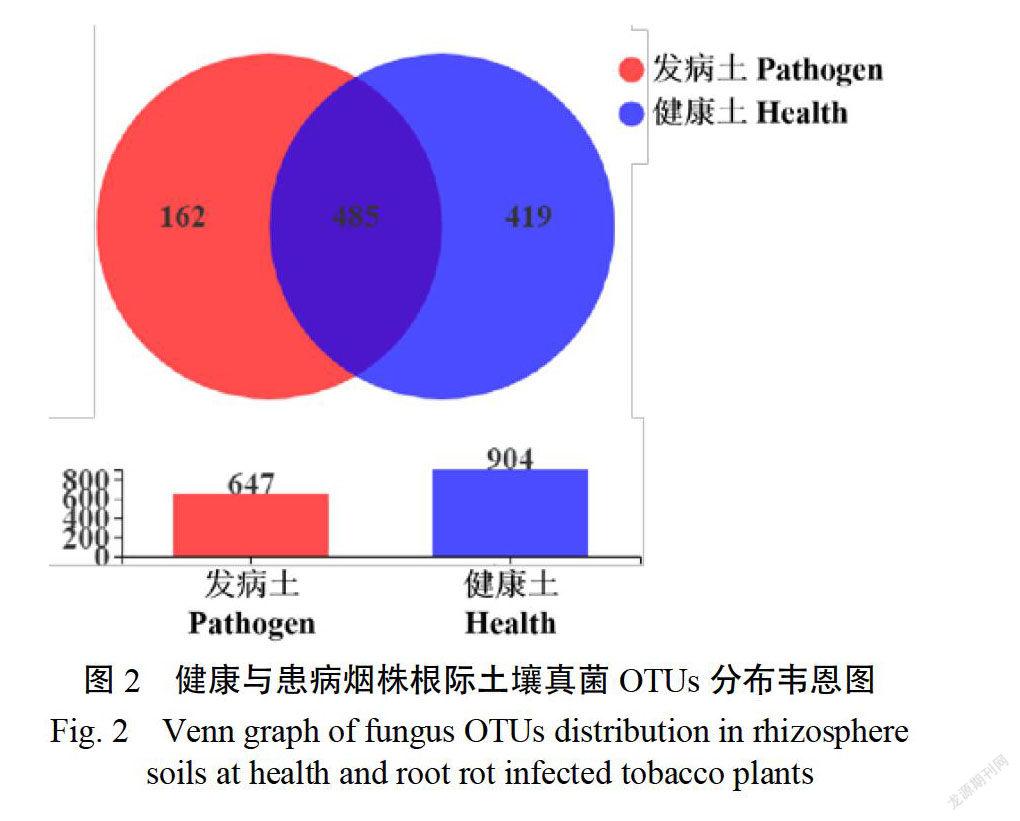
患病和健康煙株根際土壤樣品中真菌的OTU豐度分別為647個和904個,健康煙株根際土壤的真菌OTU豐度是患病煙株的1.40倍(表1)。真菌OTUs分布韋恩圖表明,兩個處理根際土壤中一共有1551個OUs(圖2),共有的OTUs為485個,只占總數的31.27%,健康煙株根際土壤所特有的OUs數是患病煙株的2.59倍,說明病害的發生明顯降低真菌OTU豐度。此外,病害的發生對烤煙根際土壤真菌的豐富度和多樣性均有顯著影響。患病煙株根際土壤的Shannon指數較健康煙株降低了29.81%,Simpson指數升高了69,23%,說明患病煙株根際士壤真菌群落多樣性水平低于健康煙株土壤(Shannon指數值越大,Simpson指數值越小,群落多樣性越高)。除群落多樣性外,病害的發生還會造成烤煙根際土壤真菌群落的豐富度顯著降低,患病煙株根際壤的ACE和Chao1指數較健康煙株分別降低了40.12%和40.61%6,差異均達顯著水平(p《0.05)。
2.2真菌的群落種類組成及相對豐度
各處理根際土壤樣品中真菌在門(Phylum)分類水平上物種相對豐度堆積柱形圖如圖3所示。由圖3可知,不同處理煙株根際土壤真菌區系在門水平上主要由子囊菌門(Ascomycota)和被孢霉門(Mortierellomycota)組成,二者均占各處理總量的90%以上。但患病煙株根際土壤中子囊菌門相對豐度較健康煙株增加了4.23%,而被孢霉門和擔子菌門相對豐度卻較健康煙株分別減少了12%和45.42%。
由圖4可知,患病煙株根際土壤真菌區系在屬水平上主要由木霉屬(Trichoderma,36.97%)、鐮刀菌屬(Fusarium,28.50%)、被孢霉屬(Mortierella,6.48%)和青霉屬(Penicillium,5.13%)組成,四者約占總量的77.08%;而健康煙株根際土壤真菌在屬水平上則主要由木霉屬(33.12%)、鐮刀菌屬(14.37%)、被孢霉屬(8.14%)、青霉屬(3.33%)、unclassified k Fungi(3.78%),unclassified pAscomycota(4.73%)和枝頂孢霉屬(Acremonium3.37%)組成,七者約占總量的70.84%。病害對烤煙根際土壤真菌群落的相對豐度影響較大,易造成某些優勢菌群的大量繁殖,患病煙株根際士壤中木霉屬、鐮刀菌屬和青霉菌屬的相對豐度分別是健康煙株根際土壤的1.12、1.98和1.54倍。說明病害的發生對烤煙根際土壤真菌群落分布具有一定影響,可造成部分真菌屬水平上的比例失衡。
從種的分類水平看(圖5),木霉屬真菌主要分布于棘孢木霉(L.asperella),鐮刀菌屬真菌主要分布于茄鐮刀菌(Fsolani)和unclassified Fusariun,青霉屬真菌主要分布于青霉菌(Praper)患病煙株根際士壤中棘孢木霉(35.65%)和茄鐮刀菌(18.72%)相對豐度之和為54.37%,而健康煙株根際土壤中二者相對豐度分別為30.31%和464%,僅占總量的3495%。烤煙根腐病病菌茄鐮刀菌(solani)在患病煙株根際士壤中積累明顯,相對豐度較健康煙株根際土壤增加了303.45%,約為健康煙株的4.03倍。同時,患病煙株根際土壤中棘孢木霉和青霉菌的相對豐度亦較健康煙株增加了17.62%和50.46%。總體看來,病害對烤煙根際土壤的真菌群落組成及相對豐度均有顯著影響。
2.3真菌群落組成的PCoA聚類分析
PcoA主成分分析表明(圖6),主成分1(PC1)和主成分2(PC2)對樣品差異性的解釋度分別為43.14%6和27.05%,兩者總計可解釋全部壤樣品的70.19%。總體看來,患病煙株根際土壤真菌群落(Pathogen)主要分布在PC2的正值區域,而健康煙株根際土壤真菌群落(Health)主要分布在PC2的負值區域,進一步說明患病煙株與健康煙株根際土壤真菌物種組成存在明顯差異。
3討論
土壤微生物是土壤中最活躍的生物體,對土壤環境變化敏感,在一定程度上反應著土壤質量和生態功能的變化,土壤微生物多樣性和群落結構穩定性是評判土壤生態系統健康的重要指標。土傳病害的病原菌棲息于壤中,難以根除,病原菌與植物根際微生物生長在同一個環境中,病原菌與根際其他微生物類群之間營養物質、生態位等有限資源的竟爭常造成各微生物群落分布比例失衡。從生態學角度開展土傳病害發生與根際土壤微生物多樣性關系的研究表明,土壤微生物多樣性的喪失易導致植物土傳病害增加22,而高微生物多樣性和活性有利于促進植物生長23-2,增強植物自身抗性并抑制土傳病害的發生。本研究中患烤煙根腐病煙株根際壤Shannon、ACE和Chaol指數分別較健康植株降低了29.81%、40.12%和40.61%;烤煙根腐病病原菌茄病鐮刀菌(E solani)在患病煙株根際土壤真菌群落中占絕對優勢,其相對豐度為健康煙株的4.03倍,顯示根際土壤中病原菌大量繁殖、真菌群落多樣性和豐富度明顯降低是烤煙患根腐病的重要特征。這與罹病玉米植株根際真菌區系中病原菌占絕對優勢,其他種真菌很少,根系微群落已轉化為病理組合的研究結論相似。總體看來,植物根際士壤微生物群落是一個綜合體,病害的發生與群落結構失衡密切相關。
研究指出,植物抗病性除與其形態結構和生理生化代謝有關外,還與根際微生物有著密切關系,植物根際中可能存在著大量的拮抗微生物。本研究中,患病煙株根際土壤中茄病鐮刀菌(Fsolan)顯著增加的同時,棘孢木霉(T:asperellum)和青霉菌(PTaper)的相對豐度亦較健康煙株也有不同程度增加,二者增量分別為17.62%和50.46%,木霉屬(Trichodermaspp)真菌具有解磷、解鉀和固氮等作用,可通過競爭、重寄生、抗生和誘導宿主抗性等作用抑制病原體,是一類重要的生防真菌2青霉屬(Penicilliumspp)真菌可參與有機物的分解,促進C、N、P等多種元素的循環,還能產生多種重要的活性代謝產物,降解多種環境有害物質2相關研究表明,該類真菌均可對部分鐮刀菌屬(Fusariumspp)表現出明顯抑制作用28-2。這可能是植物病原菌侵染時為抵制病害發生,而引起的植物自身抗性或其根際生態系統抗性響應的結果,但這兩種微生物對茄病鐮刀菌(F.solani)是否存在明顯的拮抗作用以及其作用機理還有待進一步研究。
4結論
本研究表明,煙草植株根際土壤中真菌群落結構改變及物種多樣性和豐富度降低是烤煙根腐病發生的重要特征,煙株根際生態系統失衡可能是促進病原菌大量繁殖并進一步加重病害發生的原因。因此,通過采取有效措施重塑穩定和更多樣化的根際微生物群落結構,進而提升煙株根際生態抗性來預防或減輕土傳病原菌的危害可作為烤煙根腐病的防控途徑之一。此外,健康煙株根際微生物中拮抗微生物篩選,以及各種微生物尤其是優勢菌種與病原菌及其他有益微生物之間的相互關系的進一步研究,也將為有效利用植物生態調控措施防治烤煙根腐病提供新的思路和科學依據。
參考文獻
[1] YANG M, CAO J D, ZHENG Y X, et al. First report of Fusarium root rot of tobacco caused by Fusarium solani in Lincang, China[J]Plant Disease, 2020, 104(5): 1541
[2]楊波,郭成瑾,王喜剛,等.新疆馬鈴薯鐮刀菌根腐病發生危害調查及病原菌鑒定.西北農業學報,2019,28(12):2069-2077
[3]扈順,高婧,王勇,等,西芹根腐病病原菌的分離與鑒定北方農業學報,2019,47(5):65-69
[4]李洪連,王守正.根際微生物與植物病害.河南農業大學學報,1989(4):401-408
[5] ARANCON NQ, EDWARDS C A, BIERMAN P, et al. Influences of vermicomposts on field strawberries: 1. Effects on growth and yields[J]. Bioresource Technology, 2004, 93(2): 145-153
[6]徐麗慧,曾蓉,高士剛,等土壤真菌多樣性對土傳病害影響的研究進展.上海農業學報,2017,33(3):161-165
[7]段春梅,薛泉宏,呼世斌,等.連作黃瓜枯萎病株、健株根域士壤微生物生態研究.西北農林科技大學學報(自然科學版),2010,38(4):143-150
[8]苗則彥,趙奎華,劉長遠,等.健康與罹病黃瓜根際微生物數量及真菌區系研究.中國生態農業學報,2004(3):161-162
[9]陸寧海,吳利民.健康與罹病玉米根際微生物數量及真菌區系研究玉米科學,2007(5):136-138
[10]馬云艷,王東勝,李玉龍,等辣椒疫病病株與健株根區土壤微生態研究.西北農業學報,2015,24(4):129-137
[11]鄧曉,李勤奮,武春媛,等.健康香蕉(Masa paradisiaca)植株與枯萎病患病植株根區士壤細菌多樣性的比較研究生態環境學報,2015,24(3):402-408.
[12]李紅麗,李清飛,郭夏麗,等.調節土壤微生態防治煙草青枯病.河南農業科學,2006(2):57-60
[13]呂恒,牛永春,鄧暉,等.根際真菌對黃瓜土傳病害的抑制作用[J].應用生態學報,2015,26(12):3759-3765
[14]楊珍,戴傳超,王興,等作物土傳真菌病害發生的根際微生物機制研究進展土壤學報,2019,56(1):12-22
[15]狄曉慧.黃土高原次生演替過程中植被恢復對微生物群落的影響[D]楊凌:西北農林科技大學,2017
[16] CAPORASOJG, LAUBER C L, WALTERS W A, et al. Global patterns of 16S RRNA diversity at a depth of millions of sequences per sample [J]. Proceedings of the National Academy of Sciences.
2011,108(S):45164522
[17] EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads J]. Nature Methods, 2013, 10(10): 996
[18] WANG Q, GARRITY G M, TIEDJE J M, et al. Naive bayesian classifier for rapid assignment of RRNA sequences into the new acterial taxonomy[J]. Applied and Environmental Microbiology,2007,73(16):5261-5267
[19] ALTSCHUL S F, GISH W, MILLER W, et al. Basic local alignment search tool [J] Journal of Molecular Biology, 1990, 215(3): 403-410
[20]李雪萍,李建宏,漆紅,等.青稞根腐病對根際土壤微生物及酶活性的影響.生態學報,2017,37(17):5640-5649
[21] ELSAS JD V, GARBEVA P, SALLES [J]. Effects of agronomical measures on the microbial diversity of soils as related to the suppression of soil-borne plant pathogens [J]. Biodegradation, 200213(1)29-40
[22] MENDES L W, TSA S M, NAVARRETE AA, et al. Soll-borne Microbiome: linking diversity to function [J]. Microbial Ecology2015,70(1):255-265
[23] HUNTER P J, PETCH G M CALVOBADO L A, et al. Differences in microbial activity and microbial populations of peat associated with suppression of damping-off disease caused by Pythium sy/ [J]. Applied Environmental Microbiology, 2006, 72(10)
[24] JAISWAL A K, ELAD Y, PAUDEL L, et al. Linking the belowground microbial composition, diversity and activity to soilborne disease suppression and growth promotion of tomato amended with biochar[J]. Scientific Reports, 2017, 7: 44382
[25] RAALMAKERS J M, MAZZOLA [M]. Soil immune responses soil microbiomes may be harnessed for plant health [J]. Science, 2016352:1392-1393
[26]胡嫻,何珊,史紅安,等.木霉菌應用研究進展.湖北工程學院學報,2019,39(6):50-55
[27]羅清,彭程,葉波平.青霉屬真菌研究新進展.藥物生物技術,2016,23(5):452-456
[28]曾志海,趙晉,朱廣,等木霉菌對黃芩根腐病病原菌抑制作用初探.陜西農業科學,2018,64(3):33-34
[29]王芳,李靜,張歡.青霉菌、放線菌株和石灰水對尖孢鐮刀菌抑制作用的研究.中國農學通報,2013,29(12):185-189
[30] RAGHAVENDRA A K H, BISSETT R B, THRALL P H, et al Characterisation of above-ground endophytic and soil fungal communities associated with dieback-affected and healthy plants in five exotic invasive species [J]. Fungal Ecology, 2017(26): 114-124

