自支撐的納米多孔Al摻雜NiCu-S電極的制備及其電解水析氫性能研究
鄭雙杰,馬自在,原荷峰,李晉平,王孝廣
(太原理工大學 a.新型碳材料研究院,山西 晉中 030600,b.氣體能源清潔高效利用山西省重點實驗室,太原 030024)
氫能由于具有高能量密度、制取方式多樣、對環境友好等特點被認為是最有潛力的傳統化石燃料替代品[1]。電解水技術由于析氫效率高、產物純凈,被認為是最理想的制氫方法[2]。電催化劑對降低反應過程中的能量勢壘起著至關重要的作用。目前基于Pt等的貴金屬催化劑仍然是析氫(HER)過程中最優異的電催化劑[3],然而,高成本和稀缺性阻礙了其在制氫過程中的大規模應用。因此,尋找一種廉價、高催化活性且具有優異穩定性的非貴金屬基HER催化劑具有重要的實際意義。
近年來,過渡金屬硫屬化物由于在酸性介質中的高效率制氫而備受關注,常見的過渡金屬硫屬化物制備方法有:固相法,將過渡金屬粉末直接與硫粉按一定的比例混合置于石英管瓷舟中,在惰性保護氣體氛圍下通過管式爐高溫加熱即可得到過渡金屬硫屬化物的晶體[4];化學氣相沉積法(CVD),需要把含有過渡金屬元素的固態或液態反應劑蒸氣化,然后將該蒸氣與反應所需的硫屬元素氣體引入反應室,通過高溫加熱,在襯底表面發生化學反應生成過渡金屬硫化物,通常用來制備超薄的二維過渡金屬硫屬化物材料[5];液相法,主要包括水熱法和溶劑熱法,反應過程中以水或有機溶液為溶劑,施加高溫高壓在反應釜中形成一定的溫度梯度和壓力梯度,然后進行化學反應[6-7]。液相反應通常避免了高溫反應過程中所造成的樣品團聚現象,從而可以得到具有良好分散性和較高結晶度的納米材料,并且通過調節液相合成方法中的溫度、前驅物種類、反應時間等不同參數,可以實現不同形貌的納米材料的合成,具有更多的靈活性。
一些純金屬原子被引入到過渡金屬硫屬化物中,占據了結構邊緣從而增加了活性位點[8]。Ni、Co、Cu和Fe等過渡金屬由于低成本和特殊的電子結構而被認為是Pt基催化劑的替代品[9-10]。但是,其相對較低的催化性能依然無法讓人滿意。據報道,通過合金化進行Al摻雜可以提高Ni或Co基催化劑的HER活性[11-12]。Ni或Co原子可以從摻雜的Al原子中接收額外的電子,然后將局部電子重新分布在Ni或Co活性位點上。另外,Al摻雜會影響反應物的表面吸附能,促使在HER過程中過渡金屬位點和反應物分子之間建立更好的相互作用[13]。CHEREPANOV et al[14]通過理論計算研究了Al3Ni2相的催化性能,結果表明,Al3Ni2相的(100)晶面在酸性溶液中的HER反應中具有活性。納米多孔催化劑具有充足的比表面積,快速的質量和電子轉移通道以及獨特的物理化學性能,因此在電催化領域展現出獨特的優勢[15]。脫合金策略被廣泛應用于制造具有雙連續結構的多孔金屬[16],多孔結構可在催化過程中提供反應物與電極表面之間大的有效接觸面積,并避免由于納米顆粒的脫離和聚集而導致的催化性能的衰減和失效[17]。雙連續的多孔結構可以加速氣體釋放并保留原始的活性位,這保證了工業上大電流密度下高的制氫效率[18]。在本文中,我們通過化學脫合金方法結合水熱硫化的方法設計了一種自支撐的納米多孔Al摻雜NiCu硫化物電極。研究了不同Ni/Cu原子比對電極材料的結構形貌和電解水析氫性能的影響。這項工作為高效的非貴金屬析氫電催化劑的設計和合成提供了新的思路。
1 實驗部分
1.1 催化電極的制備
對照合金相圖和元素活性分析構建原子比為Al72Ni7Cu21、Al72Ni14Cu14、Al72Ni21Cu7的三元母合金。按照原子比稱量好所需的純金屬Al、Ni、Cu,在真空感應熔煉爐中反復熔煉三次,待冷卻后得到成分均勻的AlCuNi合金鑄錠。隨后將合金錠再次放入底部帶孔的石英管(孔徑為1.0 mm)中,利用真空單輥激冷甩帶機控制銅輥轉速為1 500 r/min,通過快速冷卻得到母合金條帶,寬度為2 mm,厚度為30~50 μm.然后在室溫下將合金條帶置于6.0 mol/L NaOH溶液中進行脫合金化處理,自由腐蝕40 min后取出試樣,用超純水和無水乙醇反復沖洗殘留的NaOH溶液直至無明顯的氣泡冒出。為了防止氧化,樣品放入真空干燥箱中在60 ℃下干燥8 h備用。最后將脫合金后的np-NiCu(Al)多孔合金電極置于30 mL濃度為0.3 mol/L的硫脲溶液(CH4N2S)中,在真空干燥箱中180 ℃下反應24 h,待自然冷卻到室溫后取出,依次用超純水和無水乙醇清洗干凈后干燥過夜,得到S-np-NiCu雙金屬硫化物自支撐電極。
1.2 材料表征與測試
使用丹東浩元DX-2700型X射線衍射分析儀(Cu Kα,λ=0.154 18 nm)對脫合金后多孔前驅體合金材料以及水熱反應后獲得的硫化物電極材料進行物相表征,管電壓為40 kV,管電流為30 mA,掃描范圍為10°~90°,步長為0.03°.使用日本日立公司生產的S-4800型場發射掃描電鏡對電極的微觀形貌進行表征,電壓為10 kV.使用X射線光電子能譜分析儀(XPS,Thermo ESCALAB 250Xi)對樣品表面的元素成分和價態進行了分析,以C1s=284.8 eV為標準進行荷電校準。
本文使用武漢科思特公司生產的CS-2350雙恒電位儀在標準三電極體系下對催化劑材料進行電化學性能評估。在室溫條件下,將制備得到的樣品直接作為工作電極,Pt片為對電極,采用飽和甘汞電極(SCE)作為參比電極,0.5 mol/L H2SO4水溶液為電解液,以5 mV/s的掃描速率進行極化曲線及相關測試。工作電位根據如下公式轉換成相對于可逆氫電極(RHE)的電位:
ERHE=ESCE+0.059×pH+0.241 .
(1)
式中:ERHE和ESCE的單位為V.
2 結果與討論
2.1 脫合金后的物相與表面形貌
我們初步估計Al-Ni-Cu三元合金條帶的脫合金過程大概分為兩步,首先將母合金條帶中的ɑ-Al單質相進行快速溶出,然后是Al-Ni和Al-Cu中金屬間化合物的Al元素進行選擇性溶出形成多孔骨架。通過對比三者的XRD和SEM圖,如圖1(a)所示,脫合金以后得到的np-Ni7Cu21、np-Ni14Cu14、np-Ni21Cu7電極對應的物相主要是Al3Ni2(PDF#97-010-7937)、Al7Cu4Ni(PDF#00-028-0016)和Al(PDF#97-060-6006).可以發現脫合金以后形成了熱力學更穩定的三元Al7Cu4Ni相,同時少量殘余的Al單質相依然摻雜于合金結構當中。脫合金后條帶的孔道微觀結構可以通過改變Ni/Cu的原子比來調節,對其表面進行SEM表征,如圖1(b)-(d)所示,可以看出母合金條帶在經歷脫合金化之后形成了金屬韌帶和孔道相互連通的微觀形貌。隨著Ni/Cu原子比的提高,由于Ni具有較好的耐蝕性能,同時Ni的表面擴散率(5.83×10-19m2·s-1)比Cu的表面擴散率(2.03×10-18m2·s-1)低一個數量級,Ni原子抑制了脫合金過程中Cu原子的擴散和重排,所以Al3Ni2相在脫合金過程中會阻礙Al從中繼續溶出,從而阻礙孔道結構的形成。
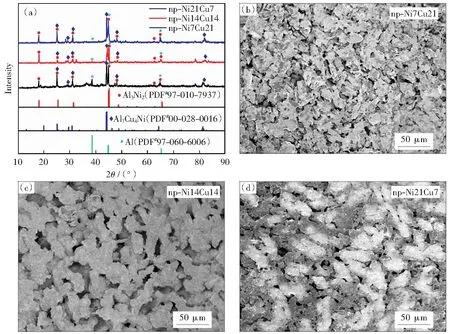
圖1 (a) np-Ni7Cu21、np-Ni14Cu14、np-Ni21Cu7電極的XRD圖譜;(b) np-Ni7Cu21,(c) np-Ni14Cu14,(d) np-Ni21Cu7電極的SEM照片Fig.1 (a) XRD patterns of np-Ni7Cu21, np-Ni14Cu14, and np-Ni21Cu7 electrodes. SEM images of (b) np-Ni7Cu21 electrode, (c) np-Ni14Cu14 electrode, and (d) np-Ni21Cu7 electrode
2.2 Al摻雜雙金屬硫化物催化劑的物相及形貌
對制備的硫化物電極進行XRD和SEM表征分析其物相組成和微觀形貌,當Ni/Cu原子比為1∶2時(圖2(a)(b)),S-np-Ni7Cu21電極表面生成NiS相(PDF#98-000-0308)和CuS2相(PDF#98-000-0454),同時存在少量的單質Al相(PDF#98-00-0062),其微觀形貌表現為在脫合金后形成的多孔韌帶表面均勻整齊地生長了一層厚度為50 nm左右的納米片結構。當Ni/Cu原子比為1∶1時(圖2(c)(d)),S-np-Ni14Cu14電極的衍射峰主要與CuS2(PDF#98-000-0454)和Ni3S2(PDF#98-002-7521)相匹配,依然存在單質Al相(PDF#98-00-0062),其XRD物相繼承了np-Ni7Cu21電極中的CuS2,同時隨著Ni元素增加,形成了新的富含Ni的Ni3S2,并發現其微觀形貌由原來的納米片演變為疊加交叉的條狀納米棒,厚度約為100 nm左右。當繼續增加Ni/Cu原子比為2∶1時(圖2(e)(f)),S-np-Ni21Cu7電極表面的物相主要與Cu1.8S(PDF#00-056-1256)和Ni3S2(PDF#97-001-0424)相匹配,依然存在單質Al相(PDF#98-00-0062),其XRD物相繼承了np-Ni14Cu14電極中的Ni3S2,且微觀形貌由納米棒演變為緊密疊加的納米板結構,厚度增至150 nm左右。隨著Ni/Cu原子比的變化,三者的物相成分和微觀結構也表現出規律性的變化,調控母合金的成分不僅可以調控孔道結構的尺寸,而且會影響孔道和韌帶表面硫化物的生長形態和微觀形貌。
通過XPS譜圖來分析樣品表面元素價態和成分,圖3為S-np-Cu7Ni21的XPS擬合圖譜,從總譜掃描圖(圖3(a))中可以得知,樣品表面含有Cu、Ni、Al、S、O、C元素,其中O的存在可能是因為樣品暴露在空氣中發生了部分氧化。在Cu 2p的XPS圖譜(圖3(b))中,結合能為932.6 eV和952.5 eV的特征峰分別對應Cu+2p3/2和Cu+2p1/2,與文獻中Cu1.8S的報道相一致[19];另外,在結合能為933.1 eV和955.9 eV處的特征峰對應Cu2+2p3/2和Cu2+2p1/2[20],主要來源于銅的氧化物,位于944.3 eV的特征峰對應Cu+的伴峰,說明樣品表面部分發生氧化,在總掃描圖譜中有O元素也佐證了這點。在Ni 2p的XPS圖譜(圖3(c))中,位于856.4 eV和874.1 eV處的特征峰對應于Ni 2p3/2和Ni 2p1/2[21]。在高分辨Al 2p光譜中(圖3(d)),位于74.1 eV處的特征峰代表Al3+[22]。高分辨S 2p圖譜如圖3e,在161.7 eV、168.6 eV處的特征峰分別對應S 2p1/2和S 2p3/2[23]。
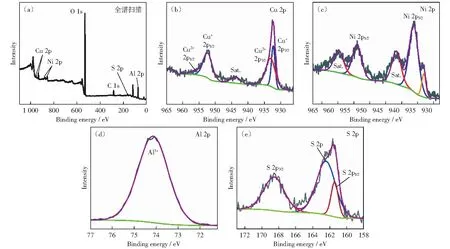
圖3 S-np-Ni21Cu7電極的XPS圖譜Fig.3 XPS spectra of S-np-Ni21Cu7 electrode
2.3 Al摻雜NiCu-S多孔電極在酸性條件下的析氫性能
在一個標準三電極電解池體系里對S-np-CuNi電極的HER活性進行了評估,首先探究的是S-np-Ni7Cu21、S-np-Ni14Cu14和S-np-Ni21Cu7電極的線性掃描曲線(LSV),同時以商業20% Pt/C作為對比樣品,如圖4(a)所示,商業Pt/C電極依然表現出了最好的析氫性能,與其他兩個對照電極相比,S-np-Ni21Cu7電極的析氫性能顯著增強。通過圖4(b)所示的過電位柱狀圖可以直觀地看到,在電流密度達到50 mA/cm2和100 mA/cm2時,過電位僅僅需要245 mV和262 mV,表現出最小的析氫過電位,表明其具有較好的催化性能,表1為近期報道的電解水催化劑與本文HER活性比較。結合圖2結果分析,從電極幾何因素來看,通過進一步硫化后,S-np-Ni21Cu7表面形成了數量眾多的納米平板狀結構,顯然表現出更大的電化學表面積;從電極的成分和電子結構角度發現,形成了具有明顯析氫活性的Ni3S2和Cu1.8S雙金屬硫化物,二者的協同耦合作用對降低過電位具有積極的促進作用。圖4(c)所示為S-np-Ni7Cu21、S-np-Ni14Cu14和S-np-Ni21Cu7析氫電極的Tafel曲線,對應的斜率分別為102.1,80.3和65.2 mV/dec,其中S-np-Ni21Cu7電極具有較小的Tafel斜率,表明S-np-Cu29Ni1電極在催化過程中具有較快的HER反應動力學。采用交流阻抗(EIS)研究S-np-CuNi自支撐電極在析氫反應過程中電極與電解液界面間的電子傳輸行為,結合擬合得到的Nyquist阻抗曲線,如圖4(d)所示,發現電荷轉移電阻(Rct)由小到大的順序為S-np-Ni21Cu7(18.3 Ω)、S-np-Ni14Cu14(47.6 Ω)、S-np-Ni7Cu21(114.2 Ω),表明S-np-Ni21Cu7電極表面與電解液之間具有較快的電荷轉移速率。圖4(e)所示為S-np-Ni21Cu7電極在50 mV/s的掃描速率下連續1 000次線性循環伏安掃描(CV)前后所測得的LSV曲線,當析氫電流密度為50 mA/cm2和100 mA/cm2時,測試后的S-np-Ni21Cu7電極過電位僅分別增加了25 mV和31 mV,說明在酸性介質中S-np-Ni21Cu7催化劑擁有優異的穩定性。圖4(f)為用計時電位法在恒定電流密度為50 mA/cm2下進行的長期耐久性測試,可以觀察到在20 h的測試時間內,S-np-Ni21Cu7催化劑表面維持50 mA/cm2析氫電流時的過電位僅僅在反應開始的短時間內出現微弱的增加,后續電位十分穩定,表明S-np-Ni21Cu7電極具有優越的耐久性能。
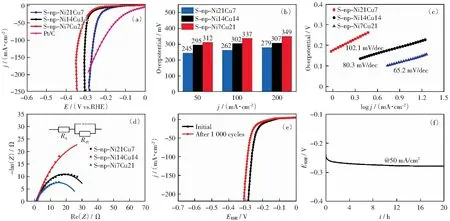
圖4 (a) S-np-Ni7Cu21、S-np-Ni14Cu14、S-np-Ni21Cu7和Pt/C在0.5 mol/L H2SO4中經過iR補償后HER極化曲線;(b) 電極在50、100、200 mA/cm2下的過電位柱狀圖;(c) Tafel曲線;(d) EIS圖譜,插圖為擬合等效電路圖;(e) S-np-Ni21Cu7電極在1 000次CV循環前后的LSV曲線;(f) 在恒電流50 mA/cm2下極化12 h的E-t曲線Fig.4 (a) HER Polarization curves of S-np-Ni7Cu21, S-np-Ni14Cu14, S-np-Ni21Cu7, and Pt/C in 0.5 mol/L H2SO4; (b) Overpotentials at 50, 100, 200 mA/cm2; (c) Tafel plots; (d) Nyquist plots, inset is the equivalent circuit for fitting; (e) Polarization curves of the S-np-Ni21Cu7with a scan rate of 10 mV/s before and after 1 000 ADT continuous cycles; and (f) The E-t profile recorded at a constant current of 50 mA/cm2 for 20 h

表1 近期報道的電解水催化劑HER活性比較Table 1 HER performance comparison with recently reported catalysts
最后,我們準確測量了S-np-Ni21Cu7催化劑電極在200 mV過電位下電解水產生的氫氣量,如圖5所示。通過對比發現,理論和實際產氫量幾乎一致,說明S-np-Ni21Cu7在催化HER反應過程中的法拉第效率接近100%.
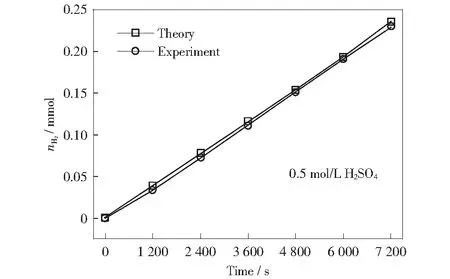
圖5 S-np-Ni21Cu7電極在200 mV過電位下理論和實驗的產氫量Fig.5 Theoretical and experimental results of H2 production on S-np-Ni21Cu7 at an overpotential of 200 mV in 0.5 mol/L H2SO4 for 7 200 s
電化學活性表面積(ECSA)是評定催化劑電催化活性的重要指標之一,電化學活性表面積越大,電催化活性越高。根據文獻報道,電化學活性表面積與雙電層電容(Cdl)呈正比例關系,因此為了評估硫化物電極的電化學活性表面積(ECSA),如圖6(a)-(c)所示,首先采用循環伏安法在不同掃描速率下研究了S-np-Ni7Cu21,S-np-Ni14Cu14和S-np-Ni21Cu7電極的雙電層電容(Cdl)。圖6(d)為在中間電位0.11 V(vs. RHE)處電流密度差Δj(Δj=janode-jcathode)與掃描速率函數關系相應的雙電層電容擬合圖,S-np-Ni21Cu7的Cdl值為117 mF/cm2,遠高于S-np-Ni7Cu21的Cdl值65 mF/cm2及S-np-Ni14Cu14的Cdl值73 mF/cm2.根據各催化劑的Cdl值,可通過公式(2)估算ECSA的值[31]。
(2)
其中電極比電容Cs通常的取值為40 μF/cm2[32].通過計算,S-np-Ni21Cu7電極的ECSA(2 925 cm2)遠大于S-np-Ni7Cu21電極(1 625 cm2)和S-np-Ni14Cu14電極(1 825 cm2).因此,相比于S-np-Ni7Cu21電極和S-np-Ni14Cu14電極,S-np-Ni21Cu7電極具有較大的電化學活性表面積,因而能夠通過暴露出更多的活性位點增強析氫行為。

圖6 (a) S-np-Ni7Cu21,(b) S-np-Ni14Cu14和(c) S-np-Ni21Cu7在不同掃描速率下的CV曲線(0.06~0.16 V vs. RHE);(d) 電位窗口中間的電容電流與掃描速率之間的關系圖Fig.6 CV curves of (a) S-np-Ni7Cu21, (b) S-np-Ni14Cu14, and (c) S-np-Ni21Cu7 at different scan rates in the potential range of 0.06~0.16 V vs RHE. (d) The capacitive currents at the middle of potential window as a function of scan rate
3 結論
1) 在經過合金化和脫合金化處理后,形成高導電性的多孔Ni-Cu電極,主要由穩定的Al7Cu4Ni和Al3Ni2相構成,Ni-Cu(Al)多孔骨架能夠顯著增大催化劑的比表面積,同時為電解液中的離子輸運和氫氣析出提供傳輸通道。
2) 對前驅體母合金進行水熱硫化處理后,形成了Al摻雜的NiCu雙金屬硫化物,隨著Ni/Cu原子比的提高,Ni-S和Cu-S物相出現了“結構遺傳”的規律性變化,其微觀形貌也從厚度約為50 nm的納米片結構,演變為厚度約為150 nm的納米板狀結構,整體結構緊密且均勻分布,可獲得更多的活性位點。
3) 對所制備的硫化物催化電極進行電化學測試表明,S-np-Ni21Cu7電極表現出了最佳的電催化析氫性能,析氫電流密度為50 mA/cm2時,其過電位僅為245 mV,在200 mA/cm2的大電流析氫密度下,過電位僅為279 mV,且表現出良好的穩定性。

