糖皮質激素對高氧誘導的新生小鼠肺功能損傷、炎癥反應和JAK2/STAT5通路的影響*
劉 露 馮 偉 郭軼男
(沈陽市第四人民醫院重癥醫學科,沈陽 110031)
支氣管肺發育不良 (bronchopulmonary dysplasia, BPD) 是多發于早產兒的慢性呼吸系統疾病。由于早產兒各器官、系統未完全發育,BPD的發病率隨孕齡和胎兒出生體質量的減少而增加[1-2]。補充高濃度氧氣、感染、炎癥、機械通氣以及遺傳因素都是誘發BPD的重要原因[3-5]。糖皮質激素 (Glucocorticoid, Gluc) 具有抗炎、抗過敏、免疫抑制、抗微生物毒素和抗休克等作用,可促進肺泡Ⅱ型細胞成熟和肺表面活性物質產生[6-7]。有研究顯示糖皮質激素可通過調節 JAK2/STAT5 信號抑制小鼠氣道重塑平滑肌細胞的增殖作用, 而氣道重塑指氣道在炎癥刺激下發生的氣道壁增厚,細胞外基質沉淀等。JAK2/STAT5 信號通路可介導機體炎癥反應,并參與調控細胞凋亡、增殖與分化[8-10],因此,我們猜測JAK2/STAT5 通路的激活可能與糖皮質激素緩解小鼠肺功能損傷有關。本研究旨在通過研究糖皮質激素對高氧誘導的小鼠肺臟炎癥反應、肺功能損傷及對JAK2/STAT5 通路的影響,為治療肺功能損傷提供理論依據。
1 材料與方法
1.1 材料
30只新生一日齡SPF級C57BL/6 小鼠購自重慶醫科大學實驗動物中心,雌雄不限,許可證號[SYXK (渝) 2017-0023];地塞米松購自中國食品藥品檢定研究院;TUNEL細胞凋亡檢測試劑盒、RIPA裂解液購自碧云天公司;反轉錄試劑盒、PCR試劑盒購自日本TaKaRa公司,IL-6、 MCP-1、 iNOS檢測試劑盒均購自Abcam公司;本研究所用抗體均購自CST公司;引物由北京華大基因公司合成。細胞培養箱購自美國Thermo公司;PCR 儀、垂直電泳槽購自美國Bio-Rad公司;AniRes2005 動物肺功能分析系統購自北京貝蘭博科技公司。
1.2 試驗動物處理及分組
將新生小鼠隨機分為對照組、Hyperoxia組、低劑量 Gluc組(Hyperoxia+ 1.2 mg/kg體質量 Gluc)、中劑量Gluc組(Hyperoxia+2.4 mg/kg體質量 Gluc)、高劑量Gluc組(Hyperoxia+4.8 mg/kg體質量 Gluc),每組6只。將各組小鼠飼養于相同的氧箱中,對照組小鼠供應正常空氣,造模小鼠均提供濃度 ≥ 90%的氧氣,連續飼養7 d。低、中、高劑量 Gluc組于造模后進行尾靜脈注射地塞米松(1 mg/kg),2天1次,共3次。對照組與Hyperoxia組僅需注射等體積生理鹽水即可。
1.3 肺功能檢測
使用1%戊巴比妥鈉進行腹腔注射,小鼠麻醉后行氣管切開術。將小鼠仰臥放置于體描箱并記錄靜息呼吸狀態,連接呼吸機后連續檢測各組小鼠靜息通氣量、氣道阻力、氣道壓力、肺容積、最大吸氣流量5次,取平均值。
1.4 石蠟切片及HE染色
將各組小鼠頸椎脫臼處死后,取出肺臟浸泡于4%多聚甲醛中固定,按照常規方法制作石蠟切片。將切片在二甲苯中脫蠟,再經梯度酒精水化。根據HE染色試劑盒說明書進行染色,經中性樹膠封固后在顯微鏡下觀察。
1.5 TUNEL染色檢測肺組織的細胞凋亡
將肺組織石蠟切片進行脫蠟、水化,并按照TUNEL細胞凋亡檢測試劑盒程序進行操作,封片后顯微鏡下觀察。
1.6 RT-PCR檢測
Trizol法提取總RNA,按反轉錄試劑盒說明書合成cDNA。β-actin引物:上游5′-CATCCGTAAAGACCTCTATGCCAAC-3′,下游5′-ATGGAGCCACC GATCCACA-3′;TGF-β引物:上游5′-ATAC GCCTGAGTGGCTGTCTTT-3′,下游5′-AAAGCCCTGTATTCCGTCTCC-3′;α-SMA引物:上游5′-GCCAAGCAC TGTCAGGAATCC-3′,下游5′-CACAATGG ATGGGAAAACAGCC-3′。擴增條件:95 ℃預變性30 s,95 ℃變性5 s,60 ℃退火延伸30 s,40個循環。
1.7 Western Blot檢測
將肺組織充分勻漿,每20 mg組織加入150 μL的RIPA裂解液。蛋白上清中加入loading buffer并經沸水加熱變性,經電泳分離蛋白后轉印蛋白質至PVDF膜,5% 脫脂牛奶室溫封閉2 h,分別孵育一抗、二抗,PBST洗脫后,加入BCL,進行曝光,用ImageJ軟件對蛋白質條帶灰度值進行分析。
1.8 ELISA檢測
將各組小鼠頸椎脫臼處死后,結扎靠近鼻腔端的氣管和右肺,從氣管處向右肺內注入3 mL PBS,充分灌洗后回收支氣管肺泡灌洗液至離心管,將灌洗液1 000 r/min離心5 min,取上清。用ELISA試劑盒分別檢測各組小鼠支氣管肺泡灌洗液中IL-6、 MCP-1、 iNOS的含量。
1.9 白細胞計數
同上取得各組小鼠的支氣管肺泡灌洗液,將灌洗液1 000 r/min離心5 min,棄上清。取500 μL PBS重懸細胞,充分混勻后取10 μL滴加至細胞計數板,分別計數嗜酸性粒細胞和白細胞。
1.10 統計方法
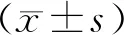
2 結果
2.1 糖皮質激素緩解高氧誘導的小鼠肺功能下降
使用動物肺功能分析系統檢測小鼠肺功能。如圖1所示,與對照組相比,Hyperoxia組、低劑量 Gluc組中小鼠的靜息通氣量、氣道阻力、氣道壓力、肺容積、最大吸氣流量均顯著降低(P<0.05)。其次,與對照組相比,中劑量Gluc組靜息通氣量、氣道壓力、肺容積、最大吸氣流量均顯著下降 (P<0.05),而氣道阻力無顯著變化。與Hyperoxia組相比,中、高劑量Gluc組中小鼠各肺功能指標均顯著升高(P<0.05)。
2.2 糖皮質激素緩解高氧誘導的小鼠肺組織損傷
通過HE染色和TUNEL染色觀察各組小鼠肺組織形態及凋亡情況。如圖2-A所示,對照組新生小鼠肺泡結構規整,肺泡間隔無炎癥細胞浸潤;Hyperoxia組小鼠肺實質結構紊亂,肺泡腔內可見壞死細胞、炎性細胞、紅細胞,肺泡間隔增寬且有大量炎癥細胞浸潤;低、中、高劑量 Gluc組小鼠肺實質結構改變程度逐漸降低。

圖1 糖皮質激素對模型小鼠肺功能的影響

圖2 糖皮質激素對模型小鼠肺組織形態及細胞凋亡的影響
如圖2-A和2-B所示,與對照組相比,Hyperoxia組、低、中劑量Gluc組中凋亡細胞數均顯著增多 (P<0.05)。與Hyperoxia組相比,中、高劑量Gluc組中細胞凋亡數量顯著減少 (P<0.05)。由此可見,糖皮質激素可以減輕高氧誘導的小鼠肺組織損傷。
2.3 糖皮質激素抑制高氧誘導的小鼠肺組織纖維化
通過RT-PCR、Western Blot檢測α-SMA、TGF-β表達水平。如圖3所示,與對照組相比,Hyperoxia組、低、中劑量Gluc組中α-SMA, TGF-β在mRNA和蛋白水平的表達量均顯著增加 (P<0.05);與Hyperoxia組相比,中、高劑量Gluc組中α-SMA, TGF-β在mRNA和蛋白水平均顯著下降(P<0.05)。提示,糖皮質激素可下調模型小鼠肺組織中肺纖維化標記物α-SMA、TGF-β的表達。
2.4 糖皮質激素緩解模型小鼠肺臟中炎癥反應
收集小鼠支氣管肺泡灌洗液,統計嗜酸性粒細胞占白細胞總數的百分比。如圖4-A所示,與對照組相比,Hyperoxia組、低、中劑量Gluc組中嗜酸性粒細胞占比顯著升高 (P<0.05);與Hyperoxia組相比,中、高劑量Gluc組中嗜酸性粒細胞占比均顯著下降 (P<0.05)。ELISA檢測灌洗液中IL-6、 MCP-1、 iNOS的含量。如圖4-B~4-D所示,與對照組相比,Hyperoxia組、低、中劑量Gluc組中IL-6、 MCP-1、 iNOS的含量均顯著增高 (P<0.05);與Hyperoxia組相比,中、高劑量Gluc組中IL-6、 MCP-1、 iNOS的含量均顯著下降 (P<0.05)。由此可見,糖皮質激素可緩解高氧誘導的小鼠肺組織中的炎癥反應。
通過Western Blot檢測JAK2和STAT5的磷酸化情況。如圖5所示,與對照組相比,Hyperoxia組、低、中劑量Gluc組中p-JAK2/JAK2、p-STAT5/STAT5比例均顯著增高 (P<0.05);與Hyperoxia組相比,高劑量Gluc組中p-JAK2/JAK2、p-STAT5/STAT5比例均顯著下降 (P< 0.05)。由此可見,糖皮質激素模型小鼠組織中JAK2/STAT5通路活性。

圖3 糖皮質激素對模型小鼠肺纖維化的影響

圖4 糖皮質激素對模型小鼠肺臟炎癥反應的影響

圖5 糖皮質激素對JAK2和STAT5蛋白磷酸化的影響
3 討論
目前,對于BPD的治療依舊是個難題。有報道稱,糖皮質激素具有抗炎、抗過敏、抗休克等作用。因此,糖皮質激素有望成為BPD的治療藥物。
高氧是誘導肺功能損傷的重要原因。有研究表明,持續性高氧可誘導小鼠的肺泡容積、肺容量顯著增加,而肺泡表面積、肺微血管容量顯著減少[11],這提示,高氧可降低功能性肺泡-毛細管氣體擴散效率。還有研究顯示,高氧誘導早產幼兔氣道阻力和總肺活量下降,而增加肺組織彈性和組織阻尼[12],造成肺功能低下。本研究結果顯示,高氧處理誘導新生小鼠靜息通氣量、氣道阻力、氣道壓力、肺容積、最大吸氣流量降低,而糖皮質激素可緩解高氧對小鼠肺功能的影響所用。
在高氧作用下,肺臟組織發生病理性變化。有相關研究顯示,高氧導致早產幼兔肺泡數量減少且肺泡腔變大,肺泡壁增厚,遠端氣道減少,且炎性細胞浸潤增多[13]。此外,Luan等人通過徑向肺泡計數 (RAC) 評估肺泡發育程度發現暴露于高氧的新生小鼠肺組織中肺泡數量明顯減少,同時高氧還誘導I型膠原 (COL1)、MMP-9、TIMP-1、α-SMA、TGF-β的表達水平升高,促進小鼠肺組織的纖維化[14]。肺纖維化是各種間質性肺疾病的最終病理表現,而上皮細胞間質轉化在其中發揮重要作用[15]。在EMT過程中,E-鈣粘素 (E-Cadherin)表達量降低,間質細胞標記物 α-SMA 表達量增加,最終使得細胞增殖和遷移能力增強[16-17]。在本研究中,Hyperoxia組小鼠肺實質結構紊亂,肺泡腔內可見壞死細胞、紅細胞,肺泡間隔增寬且有大量炎癥細胞浸潤,TUNEL染色發現大量細胞凋亡;而糖皮質激素可以緩解高氧誘導的小鼠肺組織形態改變,并減少凋亡細胞數量。此外,糖皮質激素可逆轉高氧誘導的小鼠肺組織中肺纖維化標記物α-SMA, TGF-β的表達量增加,抑制肺組織的進一步損傷。
炎癥反應是機體的正常保護性反應,而過度的炎癥反應會加重細胞和組織損傷。目前已有大量的研究證實高氧誘導的肺功能損傷與肺內的炎癥有關。Jin等發現,高氧處理的早產小鼠支氣管肺泡灌洗液中IL-1β和腫瘤壞死因子α(TNF-α)水平升高,且肺組織中細胞凋亡數量增多[18]。Kumar等發現,高氧誘導小鼠肺臟中炎癥標志物MCP-1,IL-12,INF-γ含量增高,且肺泡灌洗液中淋巴細胞數量增加[19]。嗜酸性粒細胞主要存在于組織中,當發生間質性肺炎或支氣管哮喘等疾病時會出現嗜酸性粒細胞增高的現象[20-21]。本研究結果顯示,糖皮質激素可以逆轉高氧誘導的小鼠肺臟中嗜酸性粒細胞增多和炎癥因子IL-6、 MCP-1、 iNOS含量增加,這提示糖皮質激素可有效緩解高氧損傷所造成的肺臟炎癥反應。
JAKS家族是一類非受體型酪氨酸蛋白激酶,而信號傳導及轉錄激活因子(signal transducer and activator of transcription, STAT)可被JAK磷酸化而發生二聚化,參與基因表達調控。JAK/STAT通路是細胞信號轉導的重要途徑之一,參與調控機體炎癥反應、細胞增殖、凋亡、分化等多個方面[22]。有研究表明,糖皮質激素可通過抑制JAK2/STAT5通路緩解小鼠支氣管膠原沉積、氣道重塑,并降低嗜酸性粒細胞占白細胞的比例[8]。而氣道重塑指氣道在炎癥刺激下發生的氣道壁增厚,細胞外基質沉淀等。在本研究中,我們發現糖皮質激素可以抑制高氧誘導的小鼠肺組織中JAK2/STAT5通路磷酸化水平升高。這提示,JAK2/STAT5通路高度磷酸化可能與高氧誘導的肺組織損傷及炎癥有關,而糖皮質激素可能通過抑制該通路活性而緩解小鼠的肺損傷。
綜上所述,糖皮質激素可緩解肺組織損傷并下調模型小鼠肺臟組織中炎癥因子含量,同時抑制JAK2/STAT5通路活性。下一步我們將深入探究JAK2/STAT5通路活性與糖皮質激素作用的關系,進一步探究糖皮質激素緩解肺功能損傷的分子機制。

