靜脈旁路移植疾病動物模型的建立及應用進展
楊仁從楊豐華李小輝李相念李文華廖勝杰張曉慎?
(1.暨南大學附屬第一醫院心血管外科,廣州 510630; 2.廣東省實驗動物監測所/ 廣東省實驗動物重點實驗室,廣州 510633)
心血管疾病是世界上發病率、致死率最高的疾病。 數據顯示,我國心血管疾病的發病率和致死率仍處于上升階段,其死亡占居民疾病死亡構成40%以上,居于首位,高于腫瘤及其他疾病,其中冠心病的死亡率占到心血管疾病的24.1%,且一直呈現上升態勢[1]。 因此,冠心病的防治工作負擔嚴重,面臨著巨大挑戰。 冠心病的最主要原因是心肌缺血,治療缺血性心臟病的主要方式有藥物治療、經皮冠狀動脈介入治療(percutaneous coronary intervention,PCI)和冠狀動脈旁路移植術(coronary artery bypass grafting,CABG)[2],雖然藥物治療像他汀類藥物的應用大大降低了心臟的不良反應,PCI 手術可治療大部分急性心肌梗死,但是CABG 仍然是治療冠脈多支病變患者的優先選擇,并且在長期生存率和緩解心絞痛方面具有顯著優勢[2-3]。 自從1964 年,Vasilii Kolesov 完成了第一例使用自體乳內動脈的冠脈旁路移植術[2],1967 年Favalovo 完成第一例使用自體大隱靜脈的冠脈旁路移植術以來,冠狀動脈旁路移植手術在臨床上得以廣泛應用,大隱靜脈和乳內動脈也是至今為止最常用的橋血管[2]。 提高靜脈橋血管的通暢率和醫師微創手術技術培訓是目前CABG 發展存在的問題,這需要建立穩定可重復的實驗動物模型,為評估手術效果、防治冠脈靜脈旁路移植病、外科醫師培訓提供一個可靠的工具。
1 靜脈旁路移植疾病實驗動物模型概況
1.1 建立靜脈旁路移植疾病模型實驗動物種類特征
國內外為研究旁路移植疾病建立了各種各樣的實驗動物模型,從動物種類的選擇上來看,有小鼠、大鼠、家兔等小動物和犬、羊、豬等大動物,在小動物和大動物在建立模型上各有利弊。 小動物具有來源方便、價格便宜、容易飼養和獲得大量樣本數據的優點,但是小動物的心血管和人類心血管系統差異大,不能完全模擬人心血管疾病病變,具有明顯的局限性,盡管大動物比小動物更加昂貴、需要較多的藥物、外科手術成本以及飼養成本更高,也不容易獲得大量的樣本數據,但大動物心血管在生理解剖結構與生理指標上,較小動物更接近于人類的心血管系統。 目前,在小鼠、大鼠和家兔等小動物上建立的模型有頸靜脈-頸總動脈移植血管病變模型,頸動脈-股動脈移植模型,下腔靜脈-頸動脈移植血管病變模型等;使用犬、羊和豬等大動物上建立的模型主要有大隱靜脈-冠狀動脈移植血管病變模型,乳內動脈-冠狀動脈移植血管病變模型,股靜脈-股動脈橋血管模型等。
1.2 靜脈旁路移植病動物模型建立方法
1.2.1 小動物模型建立方法
為與大動物靜脈旁路移植病模型進行類比研究,我們總結了小動物模型建立的現狀,在小動物上其他部位手術可以在一定程度模擬病變的發生與進展,造模方式按照縫合方式來劃分,主要分為直接縫合和Cuff 套管技術輔助縫合。 小鼠、大鼠和家兔都常用直接縫合法,取下腔靜脈、頸靜脈或者腹壁靜脈縫合至頸總動脈或股動脈上,通常用8/0或10/0 無損傷縫線進行縫合,縫合法操作直接,易于掌握,但增加了實驗誤差[4-7]。 Cuff 套管技術主要應用在小鼠模型的建立上,簡單來講就是采集移植靜脈如下腔靜脈縫合到左側或右側頸總動脈上,將靜脈留置針剪成適宜長度的套管,在套管一端做一小柄,游離頸總動脈,在近心端阻斷,在分叉處結扎、切斷,然后從做好的套管內穿出,血管內膜外翻至套管上固定,再將取下的橋血管在翻折邊緣處與動脈縫合,放開血管夾使下腔靜脈充盈,血流恢復。因為小鼠血管很細,若直接縫合容易發生吻合口處狹窄,所得靜脈旁路移植病模型不能排除手術技術帶來的實驗誤差,Cuff 套管技術使得吻合口處不易狹窄,操作簡便迅速,內膜光滑不易發生血栓,因此在小鼠模型的建立上具有顯著優勢[8-10]。
造模方式若按照搭橋方法來劃分則分為端側吻合、端端吻合以及血管壁補丁三種。 大小鼠體型較小,通常進行端側吻合,頸靜脈或下腔靜脈可以游離一端縫合至動脈管壁上;家兔則進行端端吻合,將家兔頸內靜脈或頸外靜脈整段游離,并將頸總動脈阻斷,兩端進行吻合,橋血管全段灌注動脈血流,使內膜增生的病變更加明顯[6,8];此外,小鼠可做另一種特殊的吻合方式即血管壁補丁,只取小面積頸總靜脈血管壁縫合至頸總動脈上也能觀察到內膜變化[11]。 小鼠、大鼠和家兔的靜脈旁路移植疾病病理學改變呈現遞進的變化,動物體型越大,則病變越呈現一定的層次,觀察越清晰。 因此,家兔在術后2 d 即可發現炎癥細胞粘附于內皮細胞,術后7~10 d 觀察到靜脈橋出現阻塞,術后2 周內膜、中膜增厚,膠原纖維和彈力纖維增生,術后4 周則顯示內膜破裂, 中膜顯著增厚, 彈力纖維斷裂[12-13]。
1.2.2 小型豬模型建立方法
大動物的靜脈旁路移植病模型相比小動物要少,但是大動物在建立模型上具有巨大的潛力。 上世紀七十年代,研究者們開始將豬用于心血管疾病的研究當中,發現豬的心血管系統比其他動物和人具有更高的相似性。 用于實驗的小型豬(25 ~30 公斤)的心、體比率與人相同,在解剖上,豬的冠狀動脈分布與人相似,都幾乎完全缺乏先天性的側枝和吻合,而且豬的心臟代謝和動脈粥樣硬化的過程也和人類相似[14]。 有研究顯示,通過給豬喂食高膽固醇飲食,豬發展了冠脈粥樣硬化病變且能發生心肌梗死,這與人類冠心病發生發展類似,測定冠心病豬模型和人的血清蛋白組,發現二者在疾病相關的8 個功能組上存在相似性[15-16],豬在心血管疾病研究的應用價值得到人們重視。 在豬身上通常取乳內動脈與左前降支進行搭橋或是建立雙側、Y 型乳內動脈橋[17-18],但是靜脈搭橋作為傳統方法有靜脈橋血管來源豐富,獲取技術簡單,實驗人員也容易掌握的優勢,具有建模的潛力。 有研究用長白豬作為實驗動物,用no touch 技術剝取大隱靜脈與頸總動脈進行端端吻合[19]。 豬不僅可用于靜脈旁路移植病研究,還適用于麻醉技術、體外循環和外科手術培訓的創新與改造。 然而目前對于豬靜脈橋狹窄模型還沒有統一的標準,這是豬作為實驗動物疾病模型需要深入研究的一個方向,該模型將會是一個非常有用的工具。
1.2.3 其它大動物模型建立方法
犬的心臟很大,占其體重的0.72%~0.96%,血液循環系統發達,適于做心臟手術及慢性實驗,比格犬是常用的實驗犬類品種。 在犬身上通常建立的是動脈橋血管模型有頸總動脈-左旋支模型、股動脈-左旋支模型和乳內動脈-左前降支模型[20-21]。有文獻報道在雜種犬上通過靜脈移植物將停博液注入升主動脈來檢測一種自動吻合裝置,但并未觀察靜脈移植物狹窄病變[22];也有研究采集比格犬的雙側股靜脈,吻合至股動脈,采用端端吻合方法建立了股靜脈-股動脈移植模型來模擬CABG 手術吻合口病變[23]。 但還未見到靜脈旁路移植病實驗犬模型,這也有待建立。
用羊建立心臟疾病模型的研究很少,有研究者采取成年綿羊的大隱靜脈,每只羊接受兩次靜脈移植,一段靜脈吻合至左前降支,另一段吻合至鈍緣支,成功建立了靜脈旁路移植病模型[24]。
非人靈長類動物主要指猿猴類如恒河猴、紅面斷尾猴等,它們在種屬上和人類最為接近,所建立的非人靈長類動物疾病模型具有更高的相似性和可類比性。 它們容易誘發動脈粥樣硬化,是較理想的模型。 但它不能完全模擬人類粥樣硬化的病變,猴的病變部位經常在小動脈,人則在大動脈,猴的病變即使出現在大動脈也與人類分布不同。 此外,非人靈長類動物價格昂貴,飼養成本高且不易獲取大樣本,這也是它們作為實驗動物的局限性。 目前,尚未在靈長類動物上建立靜脈旁路移植病模型。
通常來說,大動物模型在術后4 ~12 周都可觀察到靜脈橋內膜增生、中膜平滑肌增厚、管腔狹窄甚至閉塞,它們病變過程長,有利于做慢性實驗。
1.3 常用取材橋血管
乳內動脈是臨床上最常用的橋血管,術后患者的隨訪中也證明了乳內動脈橋具有良好的長期通暢性。 但是,當患者需要緊急血運重建時,乳內動脈的使用率占61.5%,在非緊急情況下,其使用率占92.5%,也即血流動力學不穩定時會有相當一部分患者取靜脈作為橋血管,因為在這種情況下,只有靜脈血管才能繞過所有重要的冠狀動脈狹窄病變,利于快速取材[25]。 此外,近年來橈動脈也逐漸成為繼乳內動脈后第二常規使用的動脈橋血管,它長度足夠,血管壁寬厚,對吻合技術的要求較低,且早期效果很好,相對靜脈橋也可以改善中遠期預后;但是橈動脈的缺點也非常明顯,由于它管壁中層有大量平滑肌細胞,對手術過程中的外界刺激非常敏感,容易發生痙攣,這可能是遠期血管狹窄的原因。 另一項研究表明橈動脈遠期死亡率為24.5%(平均隨訪6.6 年),因此,橈動脈的采集有賴于無接觸技術,它與乳內動脈早中期效果相當,遠期效果尚不確定[26-27]。 胃網膜動脈是另一種可用導管,雖然使用較少,但有研究證實它能夠長期通暢,患者也有良好的術后生活質量[28]。 這是三種人類常用的動脈搭橋血管,通常在動物上使用的是乳內動脈橋和股動脈橋。
人類動脈血管橋存在長度不足的問題,而這正是靜脈血管橋的優勢所在。 CABG 手術最常用的靜脈是大隱靜脈,也是大動物模型常用的靜脈橋。 但是大隱靜脈較高的遠期閉塞率,成為它使用的一個局限。 血管造影顯示,大隱靜脈在術后平均7.6 年的閉塞率是橈動脈的2 倍,接受大隱靜脈移植的患者在平均7.6 年內的死亡風險比橈動脈移植患者高了44%[27]。 乳內靜脈也逐漸開始作為動物模型的取材血管,尤其在豬的身上,由于其大隱靜脈不像人的那樣長,且管徑小不易進行手術操作,而乳內靜脈可以方便得與冠狀動脈吻合并且距離足夠。雖然乳內靜脈在臨床上并不常用,但是有患者由于右乳內動脈遠端的內膜質量和口徑不理想,不得不縮短乳內動脈的獲取長度,這也導致到右冠脈的長度不夠,于是醫生用2 ~3 cm 的右乳內靜脈與右乳內動脈吻合,延長了橋血管長度,且在六個月內通暢率良好。 除此之外就沒有其它類似病歷了,使用豬作乳內靜脈搭橋的研究也只有一項,且成功建立了其內膜增生的模型[29-30]。 這兩項研究為建立乳內靜脈橋動物模型提供了可能性。 不同動物模型種類及橋血管取材總結如表1。
1.4 模型評價指標
在模型整體上超聲檢測是一種判斷血管是否狹窄,血流是否通暢的比較直觀的方法,超聲血流檢測儀可以測量不同狹窄程度時橋血管的即時血流,也可以觀察到靜脈橋內膜是否有斑塊形成、增厚和管腔是否狹窄[17,21]。 血管造影也可以準確得反映橋血管的病變部位和程度[21,31]。 在組織水平上,病理學改變是模型建立是否成功的金標準,大多數研究都能夠在術后4 周觀察到典型靜脈旁路移植病變,即內膜增生、中膜平滑肌細胞增殖與遷移、管壁增厚和管腔狹窄,長時間的病理觀察則需要進一步驗證。 在細胞水平上,通常培養大隱靜脈細胞來觀察不同擴張液等對細胞形態及活力的影響[32-33],也有用AngⅡ誘導人臍靜脈細胞模擬建立靜脈橋內皮細胞損傷模型,MTT 法檢測細胞活力表明1 μmol/L 濃度誘導24 h 為最佳,此時細胞活力下降率最大,適宜進行各種基因或藥物研究[34]。 在分子水平上,主要探索CABG 術后橋血管狹窄的體外診斷指標,如在非人靈長類動物術后測定血漿IL-6 水平、內皮素等[32,35]。
2 靜脈旁路移植病動物模型存在的問題
靜脈旁路移植病模型也存在各自的問題。 大小鼠的血管重建也只能誘導最小程度的炎癥和血栓形成,大多數野生型小鼠僅發育有限的肌內膜,僅由幾個細胞層組成,因此小鼠模型易出現Ⅱ型錯誤,很難進行早期評估,可用于后續分析的樣本量也較少;家兔同樣如此。 犬模型中未見明顯的狹窄病變;羊和豬的麻醉成本太高,且樣本量太少不足以證明有臨床意義。 所有的動物模型都有藥物療效等測試時間的有限性,血管重構不能長期維持,也沒有理想的模型可以完全概括人類血管損傷后的多變量反應,外推不能有最大意義[36]。
3 靜脈旁路移植病動物模型的應用
3.1 基因治療的應用
CABG 術后靜脈橋血管狹窄或閉塞是需要解決的一個問題,大隱靜脈取材方便,長度足夠,且采集后對下肢供血影響不大,是臨床上最常用的移植靜脈,研究發現,大隱靜脈作為橋血管術后10 年中有超過60%出現了再狹窄[36]。 靜脈橋再狹窄由多種因素導致:早期(術后1 月內)的狹窄多與血栓形成有關,血栓的形成可與手術操作技術不當、血液的高凝性等有關;中期(術后1 個月~1 年)狹窄多與橋血管內膜增厚、中膜平滑肌細胞增殖有關;晚期(術后1 年以上)狹窄主要是由于動脈粥樣硬化血管疾病所致[37-38]。 其中中晚期狹窄是需要預防治療的階段。
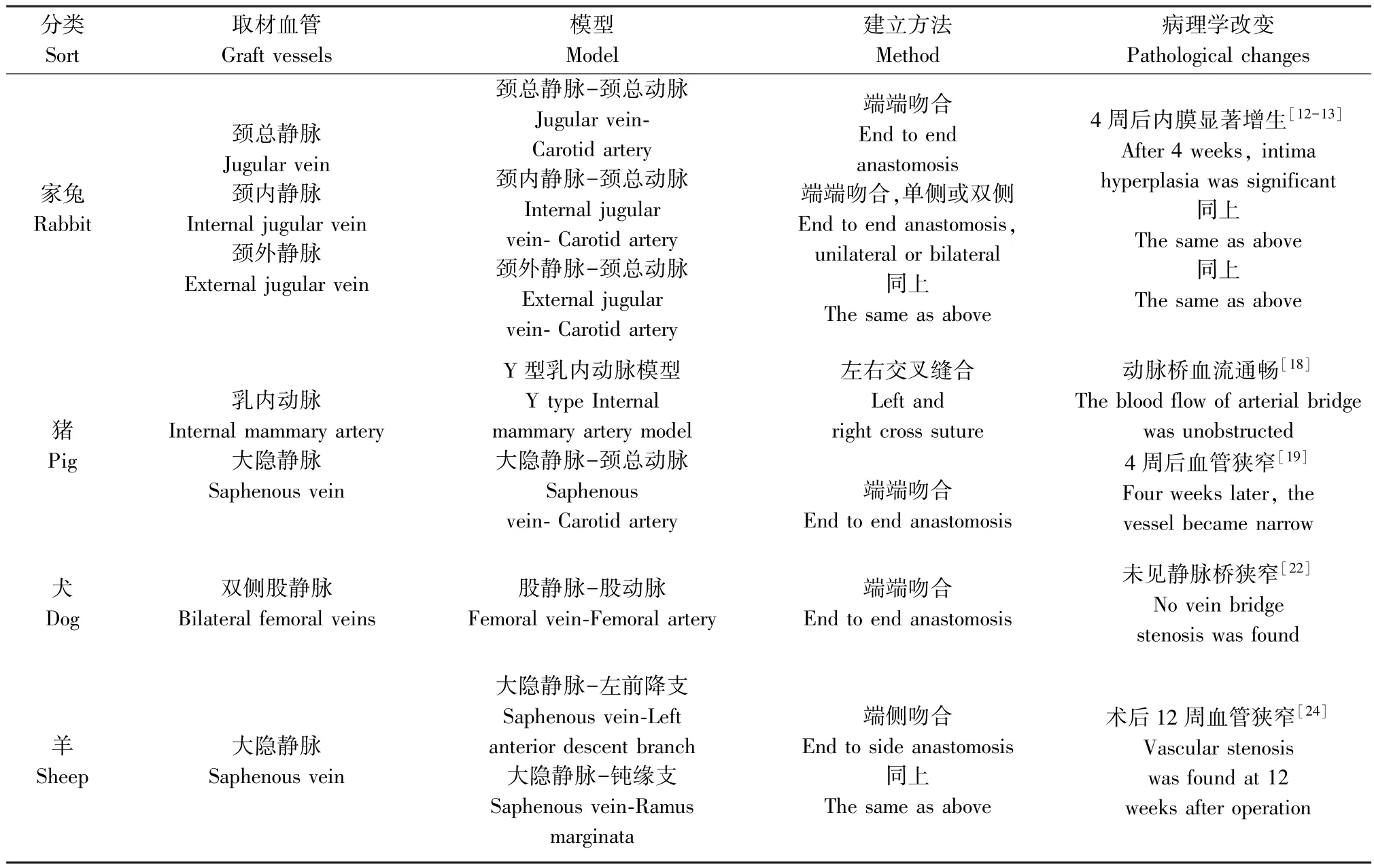
表1 實驗動物種類、橋血管模型種類與人的比較Table 1 Comparison of experimental animal species, bridge vascular model and human
了解移植靜脈橋血管狹窄的病理機制有助于我們尋找多種多樣的預防方法,預防靜脈橋血管狹窄的方法如藥物治療等雖然取得了一定的效果,但是都未從根本上改變靜脈橋血管遠期通暢率低的問題,研究者們希望從靜脈移植病的病理生理機制上尋找新的基因靶點來進行干預。 用于治療的基因靶點研究有eNOS 基因(一氧化氮合酶基因)轉染防治靜脈橋狹窄、CatS 基因(組織蛋白酶S 基因)敲除后觀察內膜增生等等,它們可能通過釋放NO 或者減少MMP-9 酶的含量來抑制狹窄[8,39];用于診斷靶點的有VEGFR-3(血管內皮生長因子受體)和CAV3(鈣通道蛋白),它們的表達增高或是C-Myc蛋白增多可作為反映早期血管損傷后內膜擴張、預測早期狹窄的指標,這些指標有利于患者及時得到篩查與干預[12,40];在藥效毒理及安全性評價方面,雪絨花中木酚素成分、白藜蘆醇聯合應用山楂總黃酮都可有效抑制血管平滑肌細胞的增殖,對內皮細胞具有保護作用,可以作為候選藥物和療法[7,41];模型還可用于器械儀器的創新及評價,如新型橋血管外支撐裝置、新型血流分析儀器、新型自動吻合裝置的研發等等[22,24,42]。 除了尋找相關基因進行治療以外,基因治療本身的技術難題也需要解決,比如在目的基因傳遞載體的表達持續性問題上有待研究,從而獲得遠期的臨床反應。
3.2 微創外科技術的醫師培訓
開胸手術對患者手術創傷大,嚴重并發癥多,恢復慢,增加了住院負擔,微創手術很好地改善了這些不足。 20 世紀90 年代胸腔鏡技術應用于心臟外科,微創心臟外科由此誕生并迅速發展,現今微創心血管外科技術主要包括小切口技術、胸腔鏡技術、復合技術和機器人應用等[43-44]。 但是,這些微創技術手術難度增大,醫生要適應窄小的術野與加長的手術器械,成員配合困難,外科醫生需要通過反復模擬練習與實踐才能掌握并精通。 外科醫師技術成長不僅需要器械模型或數字虛擬模型的創新,更需要建立疾病動物模型來給醫生提供更加真實的技術實踐,這是我們研究靜脈旁路移植疾病動物模型一個非常重要的應用目的。
分析外科醫生學習CABG 手術的學習曲線顯示,隨著外科醫生經驗的增加,術中體外循環和動脈阻斷的時間得到了改善,并且在術前可以提高這段時間的預測性與計劃性,其他技能如主動脈瓣置換、二尖瓣置換等也得到了提高,但是CABG 手術的效率并沒有隨外科醫生經驗豐富而提高[45]。 CABG手術技術朝著微創的方向發展,技術難度增加,延長了醫生學習周期。 此外CABG 大多用于有復雜病變的患者,手術風險大、狀況復雜,這更加需要構建動物模型為外科醫生提供實踐操作的機會。 研究顯示,一些外科手術的學習曲線會呈現典型的特征,即在剛開始接觸一項新的手術時,不同醫生的熟練程度表現出差異性,隨后是一個快速提升的階段,最后進入平穩期。 CABG 手術的熟練程度隨著練習時間的增加呈線性上升,在大概完成30 例手術后,手術效率提升顯著,足夠數目的操作練習對醫生熟練掌握這項手術十分重要[46-47]。 因此,動物模型模擬訓練會對外科醫生的成長有很大的幫助。
4 總結與展望
實驗動物模型的建立是醫學研究的重要方法,有助于我們在體外模擬疾病的發生發展過程,研究新的預防與治療方法。 靜脈旁路移植疾病動物模型有助于我們了解其病理生理機制,為預防治療奠定基礎,也為外科醫生手術技術培訓提供更多的機會。 考慮到小動物經濟實用的因素,目前用小動物建立模型的研究居多,但大動物如犬、豬具有造模的良好前景,找到最合適的建模方法制定標準是研究者努力的方向。

