阿米替林對非酒精性脂肪性肝病細胞模型脂質沉積及生化代謝的影響
劉 勤,張 強,吳方雄,閆 蓉,李 蓉,王 佳,牛春燕,3
1 廈門大學 醫學院,福建 廈門 361102; 2 西安醫學院第一附屬醫院 消化內科,西安 710077;3 南京市溧水區人民醫院,東南大學附屬中大醫院溧水分院 消化內科,南京 211200
非酒精性脂肪性肝病(NAFLD)正在成為世界最常見的慢性肝病,全球患病率已達25%[1]。NAFLD的發病機制涉及胰島素抵抗(insulin resistance,IR)、脂毒性、炎癥反應、內質網應激(endoplasmic reticulum stress,ERS)、遺傳因素、腸道微生態改變等多個方面[2]。近年研究發現,具有脂毒性特征的鞘脂類介質如神經酰胺(ceramide, CE)、酸性鞘磷脂酶(acid sphingomyelinase, ASM)等參與介導脂代謝紊亂及炎癥發生等多種生物學過程,且ASM/CE通路在肝臟疾病的病理生理機制中發揮重要作用,這一通路可被包括TNFα在內的多種生物因素激活[3]。三環類抗抑郁藥阿米替林(amitriptyline)是ASM的功能性抑制劑,可促使ASM降解失活,進而抑制CE的產生及其進一步的毒性生物學效應。以往僅在動物實驗研究發現阿米替林對脂質代謝的改善作用,但體外研究在國內外尚未見報道。本研究通過建立NAFLD細胞模型,擬從ASM/CE通路方向探討阿米替林在改善NAFLD肝臟脂質代謝中的作用及其機制。
1 材料與方法
1.1 材料
1.1.1 細胞 HepG2細胞株(procell,CL-0103)和L02細胞株(武漢巴菲爾生物技術有限公司)。
1.1.2 主要藥品與試劑 油酸(sigma,O1383),棕櫚酸(sigma,P5585),油紅O染色液(sigma,O0625),阿米替林(阿拉丁,A129730,以下簡稱Ami),人TNFα(PeproTech,96-300-01A),Acid sphingomyelinase抗體(affinity,DF13384),HRP標記羊抗兔二抗(武漢博士德生物工程有限公司),TG測定試劑盒、TC測定試劑盒、ALT測定試劑盒、AST測定試劑盒(長春匯力生物技術有限公司),游離脂肪酸(FFA)測定試劑盒(南京建成科技有限公司),人神經酰胺ELISA試劑盒(江萊生物,JL19781),人ASM ELISA測定試劑盒(武漢伊萊瑞特生物科技有限公司)。
1.1.3 儀器與設備 倒置熒光顯微鏡(Olympus),冷凍離心機(Eppendorf),CO2恒溫培養箱(SANYO),全自動生化分析儀(Rayto),酶標儀(Thermo),垂直電泳槽、電轉儀(北京六一儀器廠),PCR儀(東勝創新生物科技有限公司),實時熒光定量PCR儀(ABI)。
1.2 方法
1.2.1 細胞培養及分組 HepG2和L02細胞在培養基為RPMI 1640+10%FBS+1%青鏈霉素溶液,37 ℃、5%CO2飽和濕度條件下培養。正常對照組進行常規培養;NAFLD模型組加入含1 mmol/L FFA(油酸∶棕櫚酸=2∶1)培養基培養24 h;Ami組加入100 μmol/L Ami,TNFα組加入20 ng/ml人重組TNFα,Ami+TNFα組同時加入100 μmol/L Ami與20 ng/ml人重組TNFα;Ami組、TNFα組、Ami+TNFα組均于造模前預處理1 h,造模過程中不換液。
1.2.2 MTT比色法測定細胞活力 取處于對數生長期,生長狀態良好的L02和HepG2細胞,調整細胞密度到8×104/ml,接入96孔板,同時設空白孔,37 ℃培養過夜。待細胞貼壁后,按照分組進行換液處理(每組3個復孔),37 ℃培養24 h后每孔加入10 μl MTT,37 ℃培養4 h。吸出培養基,加入150 μl DMSO震蕩10 min,酶標儀測定568 nm下各孔吸光度值。
1.2.3 油紅O染色 分別取對數生長期的各組細胞,以5×104/孔的密度接種于放玻片的 24 孔板上,細胞培養至密度達到60%~70%時,放入孵箱培養48 h后,取出培養板,PBS洗3次,用4%多聚甲醛固定15 min,蒸餾水洗,60%異丙醇浸洗,油紅O染液染10 min;60%異丙醇分色至背景無色,蒸餾水洗;Mayer蘇木素復染數分鐘,自來水洗1~3 min;用水性封片劑封片,顯微鏡下觀察細胞內的脂滴。
1.2.4 Western Blot檢測ASM的蛋白表達 細胞按分組處理24 h后,提取各組細胞總蛋白,通過BCA法檢測蛋白濃度。蛋白經凝膠電泳法分離后,再轉至PVDF膜上,在5%脫脂奶粉于室溫封閉2 h,按1∶1000稀釋抗體ASM與抗體GAPDH,使PVDF膜浸泡于一抗孵育液中,4 ℃孵育過夜。次日 TBST漂洗3次,按1∶50 000稀釋相應的HRP標記二抗,使PVDF膜浸泡于二抗孵育液中,37 ℃搖床孵育2 h。洗膜后ECL法壓片顯影。
1.2.5 實時熒光定量PCR檢測ASM表達水平 Trizol法分別提取各組細胞總 RNA,用紫外分光光度計檢測RNA的純度和濃度,并逆轉錄為cDNA,采用實時熒光定量PCR檢測ASM mRNA表達。以GAPDH為內參基因,最終數據以2-△△Ct進行分析。引物由擎科生物科技有限公司設計合成,引物序列:ASM上游引物為5′- CCGGCCCTTTTGATATGGTG-3′,下游引物為5′- GGGGAGGGAAGCTATTGACA-3′,擴增產物大小為189 bp;GAPDH上游引物為5′- TCAAGAAGGTGGTGAAGCAGG -3′,下游引物為5′- TCAAAGGTGGAGGAGTGGGT -3′,擴增產物大小為115 bp。
1.2.6 ELISA法測定細胞ASM、CE總水平 收集各組細胞培養液,1000 r/min離心20 min,取上清保存于-20 ℃備用。根據 ELISA 試劑盒說明書進行操作,檢測細胞ASM、CE總水平。
1.2.7 生化指標的測定 TG、TC、ALT、AST由全自動生化分析儀檢測,FFA含量按照FFA測定試劑盒說明書進行測定。
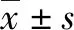
2 結果
2.1 NAFLD細胞模型的建立 HepG2和L02細胞的增殖率隨FFA濃度的增加而降低。與空白組比較,FFA濃度為2 mmol/L時,兩種細胞的吸光度值及增殖率下降明顯(表1)。選擇FFA濃度為1 mmol/L進行后續實驗,誘導細胞脂肪變,油紅O染色結果顯示,正常對照組HepG2和L02細胞生長形態呈梭形或卵圓形,胞質無明顯紅染或淡染,NAFLD模型組細胞胞質廣泛染色,橘紅色脂滴聚集明顯增多(圖1);與正常對照組比較,NAFLD模型組細胞內TG、TC、FFA水平明顯增加(P值均<0.05)(表2),表明 NAFLD細胞模型建立成功。
2.2 不同濃度Ami對NAFLD細胞模型脂質蓄積的影響
正常對照組,NAFLD模型組,Ami 25 μmol/L、50 μmol/L、100 μmol/L干預組的HepG2和L02細胞均生長良好,吸光度值和細胞增殖率組間比較,差異均無統計學意義(P值均>0.05)(表3)。油紅O染色結果可見,與NAFLD模型組相比,Ami干預的各組細胞內橘紅色脂滴聚集減少,且脂滴隨Ami濃度的增加而減少,這一變化在HepG2細胞中更為明顯(圖2)。進一步定量檢測結果顯示,與正常對照組比較,NAFLD模型組細胞內TG、TC、FFA水平明顯升高;Ami干預組細胞內TG、TC、FFA水平隨Ami濃度的升高而降低,與NAFLD模型組比較,Ami 50 μmol/L與Ami 100 μmol/L組細胞內TG、TC、FFA水平下降明顯(P<0.05)(表4、5)。綜上,Ami可抑制NAFLD細胞模型的脂質蓄積,且在一定濃度范圍內,抑制作用隨濃度的增加而增強。故選擇濃度為100 μmol/L(抑制作用最佳)的Ami進行進一步研究。
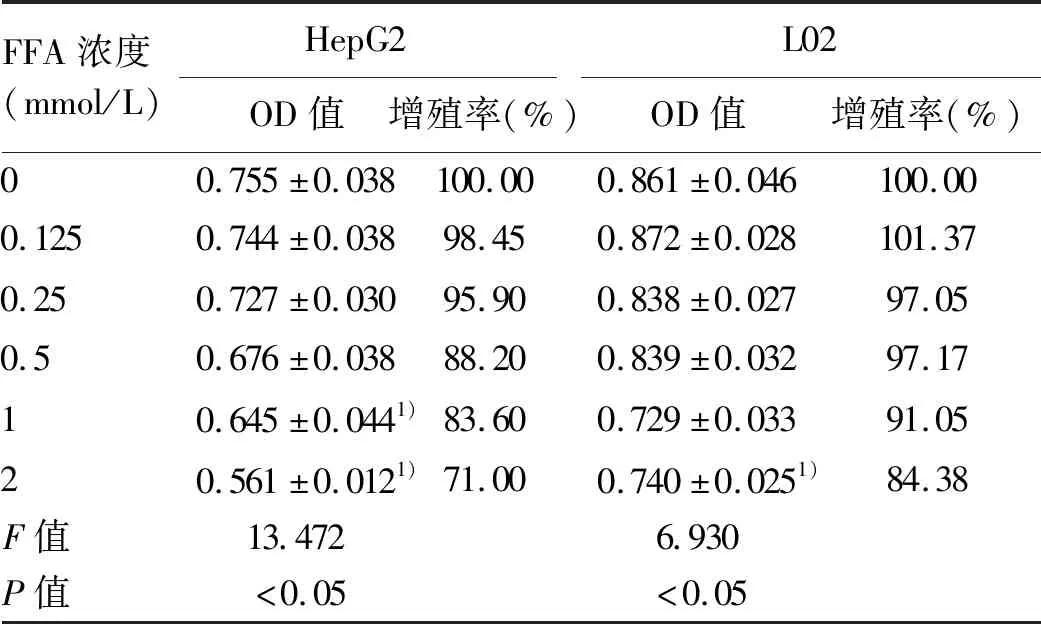
表1 不同濃度FFA干預細胞的OD值和細胞增殖率
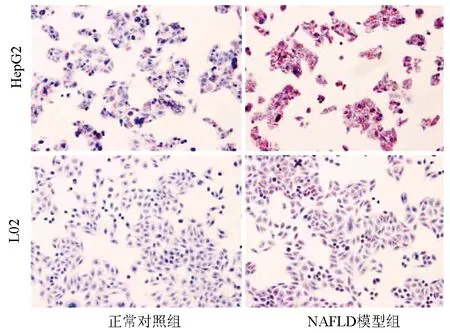
圖1 油紅O染色結果(×200)
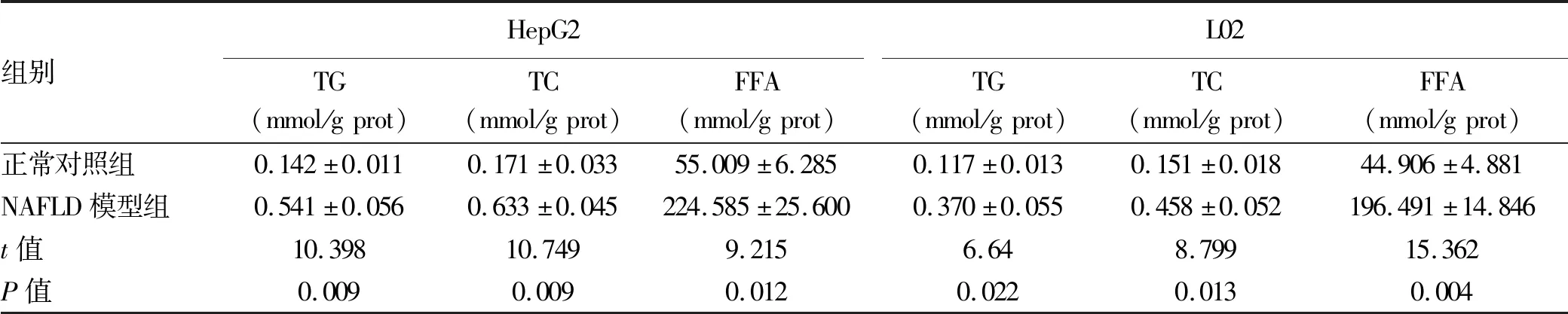
表2 正常對照組和NAFLD模型組細胞內TG、TC、FFA含量比較
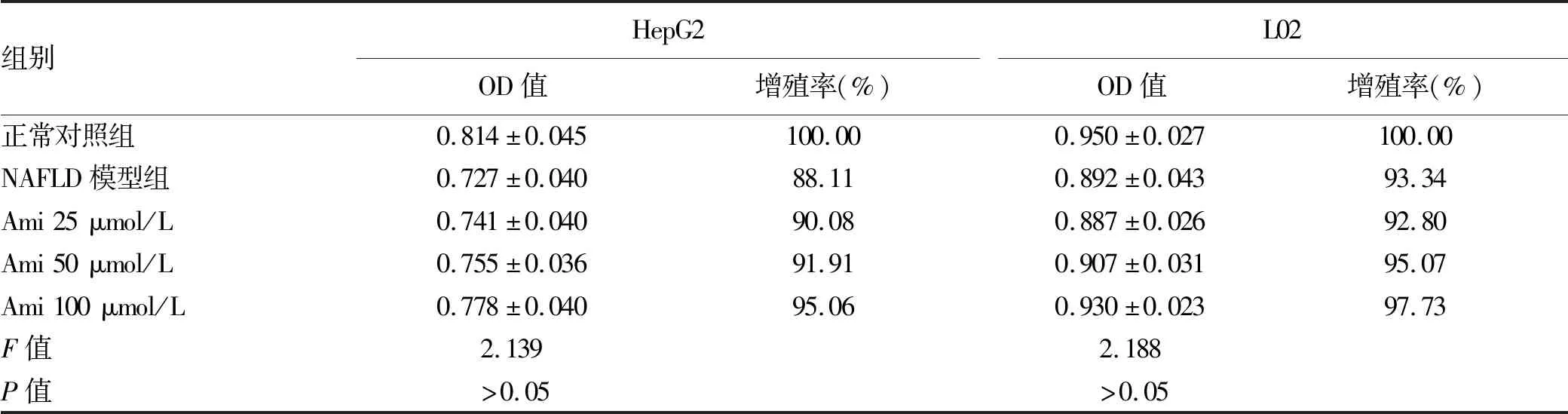
表3 不同濃度阿米替林干預脂肪變細胞的OD值和增殖率
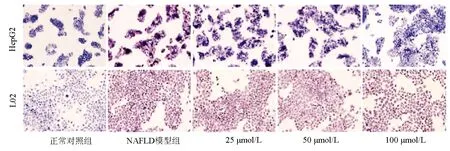
圖2 不同濃度Ami干預HepG2和L02細胞的油紅O染色結果(×200)
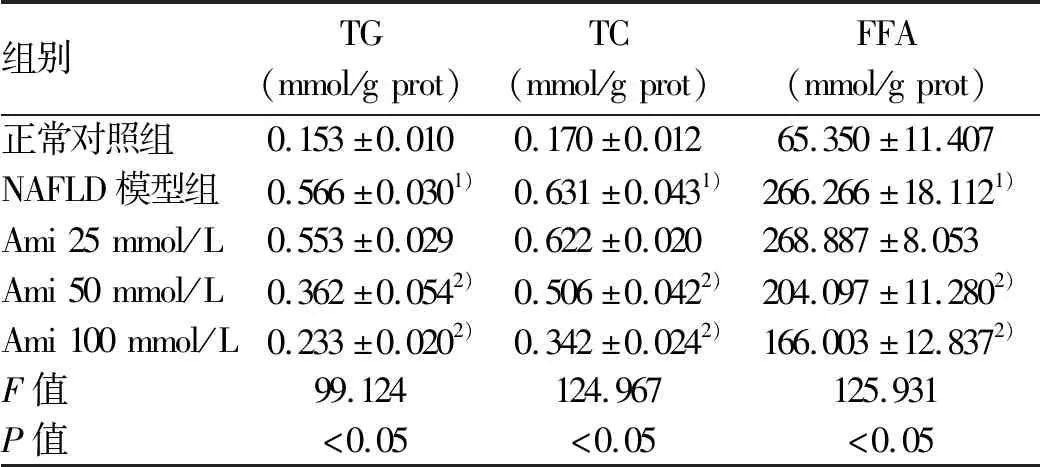
表4 各組HepG2細胞內TG、TC、FFA水平比較
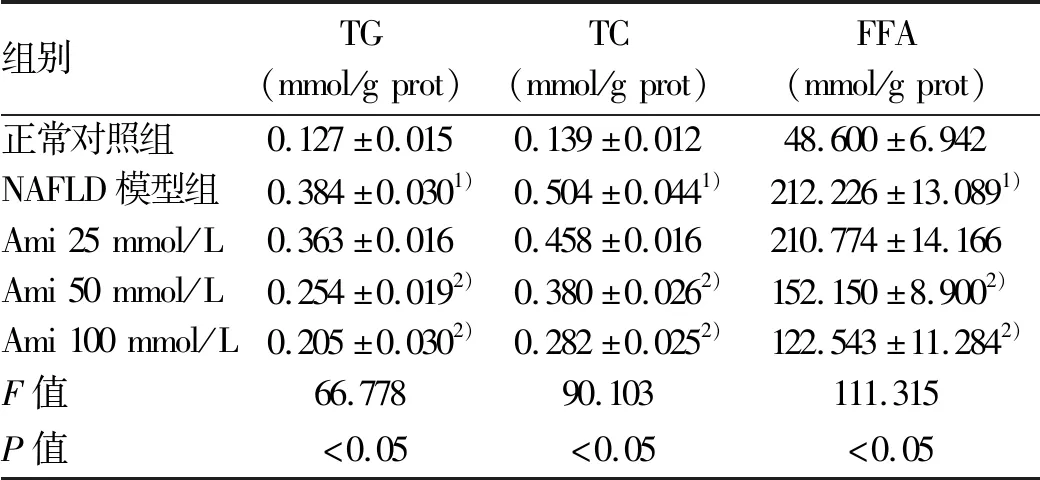
表5 各組L02細胞內TG、TC、FFA水平比較
2.3 TNFα及Ami對ASM/CE通路的影響 為了驗證TNFα對ASM的激活作用以及Ami對ASM的抑制作用,對ASM的蛋白及mRNA表達進行檢測。與正常對照組比較,NAFLD模型組ASM的蛋白及mRNA表達量明顯升高(P<0.05);與NAFLD模型組相比,Ami組明顯降低了ASM蛋白及mRNA表達,而TNFα明顯增加了細胞中ASM的蛋白及mRNA表達(P值均<0.05);與TNFα組比較,Ami+TNFα組ASM的蛋白及mRNA表達量降低明顯(P值均<0.05)(圖3,表6)。ELISA檢測細胞內總CE、ASM的水平,與正常對照組比較,NAFLD模型組OD值明顯升高(P值均<0.05);與NAFLD模型組相比,Ami組OD值明顯降低,TNFα組OD值明顯升高(P值均<0.05);與TNFα組比較,Ami+TNFα組OD值降低明顯(P值均<0.05)(表7),提示Ami可抑制TNFα所致的ASM及CE的表達改變。

圖3 各組細胞ASM蛋白的表達水平
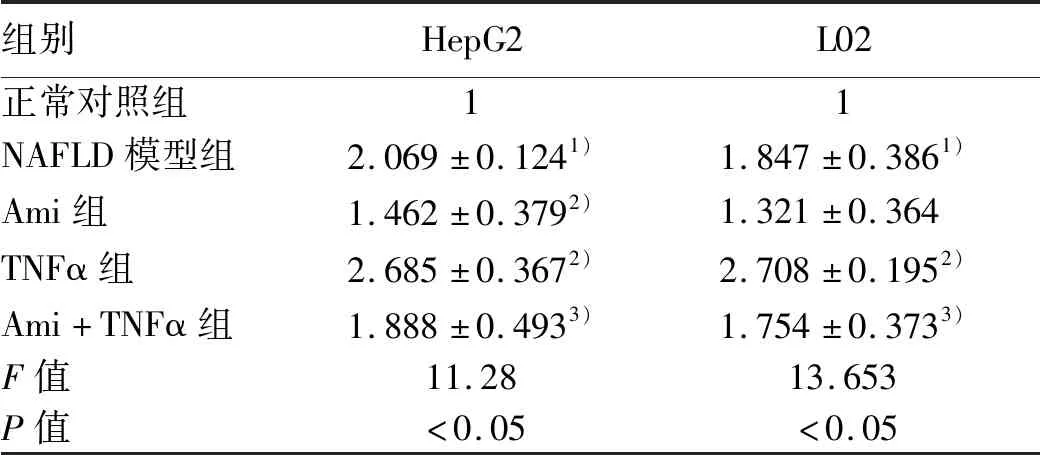
表6 各組細胞ASM的mRNA相對表達量
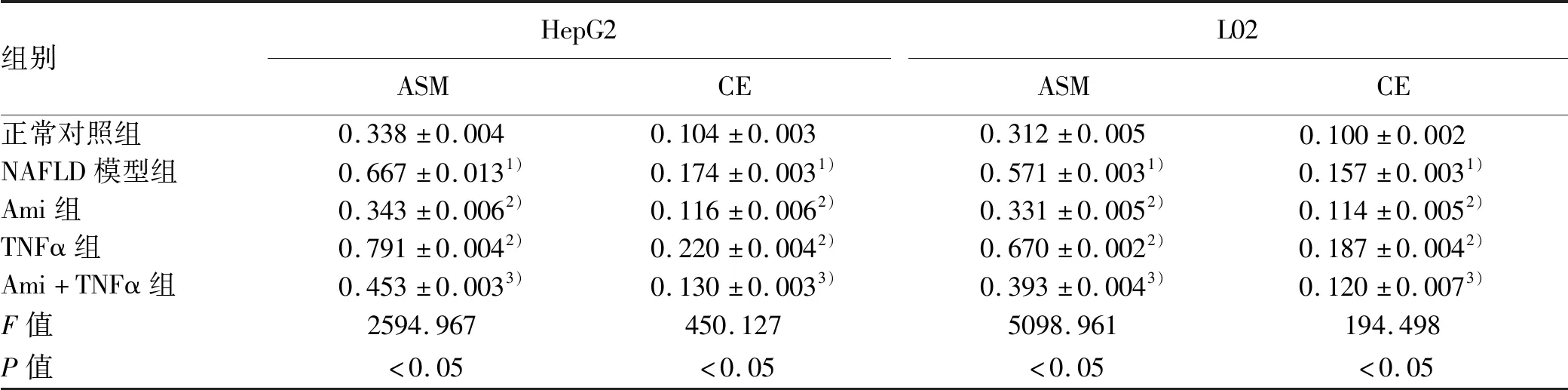
表7 各組細胞的ELISA檢測結果(OD值)
2.4 ASM/CE通路對生化代謝的影響 在明確Ami及TNFα對ASM/CE通路的作用后,進一步研究抑制或激活該通路對生化代謝的影響。與正常對照組比較,NAFLD模型組細胞內TG、TC、FFA及細胞上清中ALT、AST水平明顯上升(P值均<0.05);與NAFLD模型組比較,Ami組TG、TC、FFA、ALT、AST水平明顯下降(P值均<0.05),TNFα組中兩細胞系的TG、FFA、ALT、AST水平均上升;與TNFα組比較,Ami+TNFα組TG、TC、FFA、ALT、AST水平明顯下降(P值均<0.05)(表8、9)。
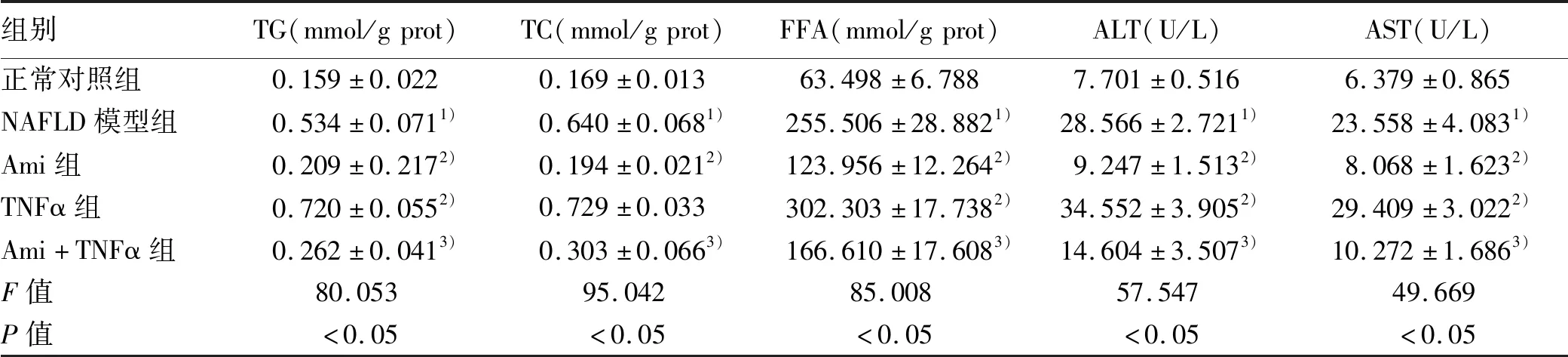
表8 各組HepG2細胞的生化指標比較
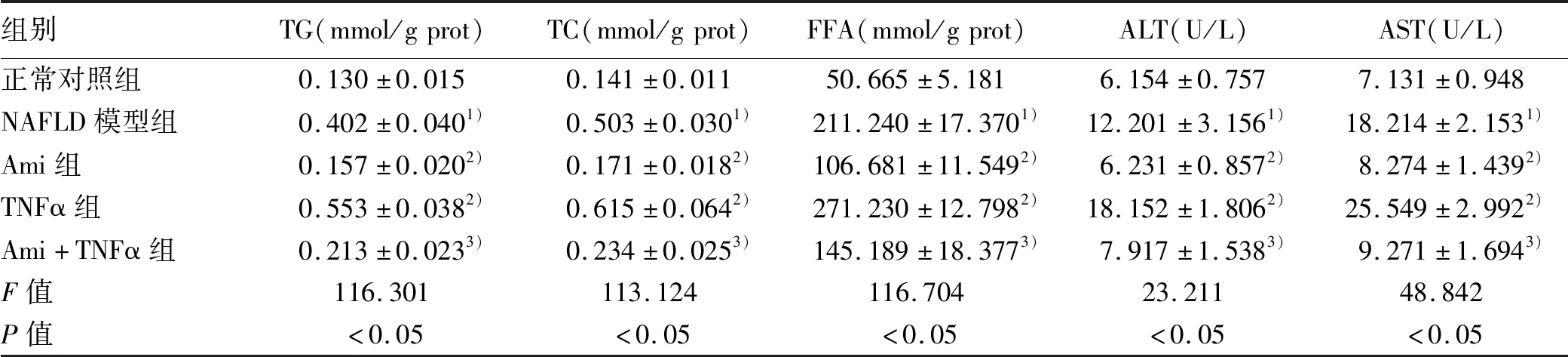
表9 各組L02細胞的生化指標比較
3 討論
近年研究發現CE及ASM在NAFLD的發病機制中發揮重要作用。CE屬于鞘脂類脂質家族,是構成生物膜的重要組分,也是鞘磷脂信號通路的第二信使,可引起脂毒性,介導IR、炎癥反應、ERS等多種發病機制,調節細胞凋亡、分化、增殖、自噬等多種細胞應答[4-5],且CE被脂毒性學說的首位提出者Unger[6]描述為脂毒性事件中“最重要的有害途徑”。有研究[7]表明,血漿CE水平與青少年肝脂肪變性密切相關,且C14∶0 CE可能成為青少年非肥胖型肝脂肪變性的預測指標。合并IR的非酒精性脂肪性肝炎(NASH)患者中CE合成顯著增加,促進肝脂肪變、氧化應激與炎癥反應[8-9]。CE還參與了NAFLD大鼠模型肝細胞內的脂質沉積過程[10]。ASM是調控CE合成、分泌的關鍵酶,也是CE合成最快、最直接的途徑。酒精性肝炎和NASH的動物模型中ASM明顯激活,可調節ERS、自噬和溶酶體膜透化作用,進而引起IR、脂肪變性、纖維化、脂毒性[11-12],促進肝病的進展,而ASM抑制劑丙米嗪可改善乙醇喂養小鼠的肝脂肪變性[13],提示ASM/CE通路在 NASH 中是一個調控多條通路的關鍵靶點[14]。
ASM可被炎性因子TNFα激活,被Ami抑制。NAFLD時TNFα水平升高,而由此激活的ASM又能增加肝細胞對TNFα的細胞毒性作用的敏感性[15],如此相互作用可加速肝病進展。Ami是ASM的功能性抑制劑,可干擾ASM與溶酶體膜的結合,導致ASM蛋白降解失活[16],進一步抑制CE的生成及后續的毒性生物學效應。Ami可保護ASM+/+小鼠免于高脂飲食引起的肝臟脂肪變、炎癥、ERS以及早期NASH和纖維化[12];明顯減輕LDLR-/-小鼠肝脂肪變性、炎癥及IR[17]。
關于Ami對NAFLD的影響及ASM/CE通路在 NAFLD發病機制中的探索,目前國際上僅有動物實驗的研究,尚未見細胞實驗的報道。本研究選擇人肝癌細胞HepG2和正常人肝細胞L02兩種細胞系,用FFA誘導建立了NAFLD細胞模型,發現NAFLD模型組細胞ASM的蛋白、mRNA表達量與CE含量較正常對照組明顯升高,表明NAFLD中存在ASM/CE通路的異常活化。而TNFα組細胞中ASM的蛋白、mRNA表達與CE含量較NAFLD模型組明顯升高,表明TNFα誘導的細胞中CE的增加主要源于ASM的激活,驗證了TNFα對ASM/CE通路的激活作用。Ami可顯著降低細胞模型中的脂滴含量,提示Ami可改善NAFLD肝細胞內脂質沉積。對NAFLD細胞模型進行Ami干預后,細胞內脂質含量及酶學水平均明顯下降,細胞ASM的蛋白、mRNA表達量與CE含量也明顯降低;采用TNFα激活ASM/CE通路,同時加以Ami干預,細胞內脂質含量、酶學水平,以及ASM的蛋白、mRNA表達量與CE含量較TNFα組也呈現明顯下降。這表明ASM/CE通路促進脂質積聚、導致脂肪變,Ami可通過抑制ASM/CE通路改善NAFLD肝細胞的脂質沉積及肝功能生化指標,與前述已有的動物實驗研究結果一致。
據了解,本研究系國內外首次關于Ami對脂質代謝影響的體外研究。研究表明在NAFLD病理過程中存在ASM/CE調控脂質代謝關鍵通路的激活,Ami作為ASM的抑制劑可通過調控ASM/CE通路改善NAFLD肝細胞的脂質沉積,提示ASM/CE通路可以作為 NAFLD的潛在治療靶點,Ami作為靶向治療藥物的可行性,以及ASM、CE作為NAFLD診斷預測標志物的可能性,然而以上結論還需完善NAFLD模型體內實驗進一步驗證。同時,CE下游代謝產物或信號分子的確切變化規律,以及它們在 NAFLD發生、發展中的生物學作用特征也有待進一步深入研究。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突,特此聲明。
作者貢獻聲明:劉勤負責課題設計與實驗實施,資料收集整理,數據分析,撰寫論文;張強參與實驗實施,資料收集整理;李蓉負責實驗質量控制及論文修改;吳方雄、閆蓉、王佳負責文獻收集與整理;牛春燕進行課題設計,審核論文,并對論文負責。

