Skp2通過調控Snaill水平對上皮性卵巢癌細胞EMT的作用研究
徐小麗,李 青,陳 彬
安徽省安慶市立醫院婦產科,安徽安慶 246001
卵巢癌致病機制復雜,在疾病早期難以診斷,超過70%的卵巢癌患者在晚期(Ⅲ或Ⅳ期)被發現,同時,卵巢癌細胞通常對化學治療藥物具有抗性,導致患者整體生存率急劇下降[1-2]。卵巢癌是上皮性腫瘤,具有高度轉移性,與其他腫瘤細胞不同,由于沒有解剖屏障,卵巢癌細胞可以直接擴散到腹膜腔,而不通過血液擴散[3]。在卵巢癌的發生和發展過程中,上皮間質轉化(EMT)是其中的關鍵過程[4]。E-鈣黏蛋白(E-cadherin)的表達抑制被認為是EMT過程中的一個基本事件,許多細胞因子如轉錄因子Snaill、鋅指E框結合同源框1/2(ZEB1/2)和樣轉錄因子8(KLF8)等可直接與E-cadherin啟動子區結合而抑制其轉錄[5-6]。Snaill在EMT的調控過程中起關鍵作用,包括E-cadherin的水平降低,以及波形蛋白(Vimentin蛋白)和纖連蛋白(Fibronectin)等生物標志物水平的升高。S期激酶相關蛋白2(Skp2)是近年發現的一種F-box蛋白,可以直接降解Snaill,在許多晚期癌癥(包括卵巢癌)中發現其低表達[7]。體外研究顯示,Skp2過表達可抑制腺癌或鱗狀細胞癌細胞系的遷移和侵襲[8]。同時,卵巢癌中Skp2的低表達與E-cadherin的丟失有關,表明發生了EMT[9]。然而,Skp2在EMT中的分子機制尚不清楚。因此,本研究探討Skp2通過調控Snaill水平在抑制上皮性卵巢癌細胞EMT方面的作用,以期為卵巢癌的治療提供新的策略。
1 材料與方法
1.1材料 分別收集15例上皮性卵巢癌組織和正常卵巢組織。所有研究對象均未接受放療或化療,切除后立即將標本放液氮中保存。所有標本均經病理學確診,所有研究對象對本研究均知情同意并簽署知情同意書,同時本研究獲得本院醫學倫理委員會批準。
1.2儀器與試劑 上皮性卵巢癌SKOV3細胞(中國科學院上海細胞研究所),胎牛血清和RPMI-1640培養基(美國Gibco公司),脂質體Lipofectamine2000(美國Invitrogen公司),Skp2干擾表達載體(5′-CCGGGATAGTGTCATGCTAAAGAATCTCGAG ATTCTTTAGCATGACACTATCTTTTTG-3′,廣州銳博公司設計與合成)和Skp2過表達載體(5′-CCGGGCCTAAGCTAAATCGAGAGAACTGAGT TCTCTCGATTTAGCTTAGGCTTTTTG-3′,廣州銳博公司設計與合成),Lipofectamine2000轉染試劑盒(美國Invitrogen公司),TRIzol(美國Invitrogen公司),RNA反轉錄試劑盒,實時熒光定量聚合酶鏈反應(RT-PCR)試劑盒(寶生物工程有限公司)。PCR引物序列由大連TaKaRa公司設計及合成:Skp2上游引物為5′-ATAAGCTTATGCACAGGAAGCA-CCCTCCAGG-3′,下游引物為5′-AAGAATTCTCATAGACAACGGGCTTTTGC-3′;Snaill上游引物為5′-TCCAGAGTTTACCTTCCAGCA-3′,下游引物為5′-CTTTCCCACTGTCCTCATCTG-3′;E-cadherin上游引物為5′-GCTGCTCTTGCTGTTTCTTCG-3′,下游引物為5′-CCGCCTCCTTCTTCATCATAG-3′;Vimentin上游引物為5′-AAGTTTGCTGACCTCTCTGAGGCT-3′,下游引物為5′-CTTCCATT TCACGCATCTGGCGTT-3′;U6上游引物為5′-CTCGCTTCGGCAGCACA-3′,下游引物為5′-AACGCTTCACGAATTTGCGT-3′。RIPA裂解液(上海生工生物工程有限公司),Skp2、Snaill、E-cadherin、Vimentin、β-actin鼠抗和辣根過氧化物酶(HRP)標記山羊抗鼠IgG二抗(美國Santa Cruz公司),電化學發光(ECL)試劑盒(美國GE公司),二氧化碳細胞培養箱(美國Ther-mo Revco公司),24孔Transwell小室(美國Corning科技有限公司),NanoDrop2000c型蛋白核酸檢測儀(美國Thermo公司),實時熒光定量PCR儀和BIO-RAD垂直電泳儀(美國BIO-RAD公司),凝膠成像儀(美國UVP公司)。
1.3方法
1.3.1細胞分組及轉染 將實驗對象分為陰性對照組(只加脂質體)、Skp2干擾表達組(加Skp2干擾表達載體和脂質體)、Skp2過表達組(加Skp2過表達載體和脂質體)。將含10%胎牛血清的RPMI-1640培養基在37 ℃、5%CO2環境中培養SKOV3細胞,選取對數生長期的細胞進行實驗。對SKOV3細胞進行離心后接種于6孔板中,待細胞生長后更換為無血清培養液(RPMI-1640),分別用Lipofectamine法將脂質體、Skp2干擾表達載體和Skp2過表達載體轉染到SKOV3細胞中,轉染6 h后更換為含血清培養液(RPMI-1640)繼續培養48 h收獲細胞,進行相關檢測。
1.3.2RT-PCR法檢測組織中Skp2、Snaill mRNA,以及細胞中Skp2、Snaill、E-cadherin和Vimentin mRNA的表達 陰性對照組、Skp2干擾表達組和Skp2過表達組細胞轉染成功后以5×104/孔接種于6孔板內(3毫升/孔),繼續培養48 h收獲細胞,使用TRIzol提取總RNA,測定mRNA的水平和純度,根據RNA反轉錄試劑盒說明書將提取的總RNA反轉錄為cDNA,根據RT-PCR試劑盒說明書,制備20 μL反應體系。在RT-PCR儀中進行擴增,反應條件為預變性95 ℃ 30 s、變性95 ℃ 5 s、60 ℃ 44 s、40個循環,61 ℃時采集熒光,用RT-PCR儀進行檢測并對其表達量進行分析。以U6作為內參,采用2-ΔΔCt法計算Skp2、Snaill、E-cadherin和Vimentin mRNA的相對表達量(正常卵巢組織和卵巢癌組織標本只進行Skp2和Snaill mRNA的檢測)。每組試驗重復3次。
1.3.3Transwell法檢測細胞體外侵襲、遷移能力 各組細胞轉染成功后以5×105/mL接種在24孔Transwell小室中(200微升/孔),下室加入含10%胎牛血清的RPMI-1640培養液,繼續培養48 h,取出小室,用無菌棉簽擦拭去除上室內的細胞,用4%甲醛固定10 min,用0.1%結晶紫染液染色30 min,沖洗干凈后于倒置顯微鏡下觀察細胞并拍照。計數染成紫色的穿膜細胞(代表細胞侵襲和遷移能力)。每組試驗重復3次。
1.3.4免疫印跡(western blot)法檢測Skp2、Snaill、E-cadherin和Vimentin蛋白表達 各組細胞轉染成功后以5×104/孔接種于6孔板內(3毫升/孔),繼續培養48 h收獲細胞,加入RIPA裂解液,冰浴2 h。離心取上清液進行蛋白定量。調整蛋白水平,沸水進行變性。進行電泳(每孔上樣量為20 μg),將膜與Skp2(1∶200)、Snaill(1∶500)、E-cadherin(1∶400)、Vimentin(1∶500)和β-actin(1∶1 000)抗體進行孵育,4 ℃過夜,將IgG二抗(1∶5 000)在室溫下孵育30 min。進行顯色,采集圖像,通過Image LabTM軟件(Bio-Rad)獲取信號并估計強度,以β-actin作為內對照。每組試驗重復3次。
2 結 果
2.1正常卵巢組織和卵巢癌組織中Skp2和Snaill mRNA的表達情況 Skp2 mRNA在卵巢癌組織中的表達水平明顯低于正常卵巢組織、Snaill mRNA在卵巢癌組織中的表達水平明顯高于正常卵巢組織,差異均有統計學意義(P<0.05)。見表1。
表1 正常卵巢組織和卵巢癌組織中Skp2和 Snaill mRNA的表達情況
2.23組細胞中Skp2、Snaill、E-cadherin和Vimentin mRNA表達情況 與陰性對照組相比,Skp2干擾表達組細胞中Skp2和E-cadherin mRNA表達水平降低,Snaill和Vimentin mRNA表達水平升高,差異均有統計學意義(P<0.05);與Skp2干擾表達組相比,Skp2過表達組細胞中Skp2和E-cadherin mRNA表達水平升高,Snaill和Vimentin mRNA表達水平降低,差異均有統計學意義(P<0.05)。見表2。
2.33組細胞侵襲、遷移能力 與陰性對照組相比,Skp2干擾表達組侵襲細胞數和遷移細胞數增加,差異有統計學意義(P<0.05);與Skp2干擾表達組相比,Skp2過表達組侵襲細胞數和遷移細胞數降低,差異有統計學意義(P<0.05)。見圖1~2、表3。
表2 3組細胞中Skp2、Snaill、E-cadherin和Vimentin mRNA表達情況
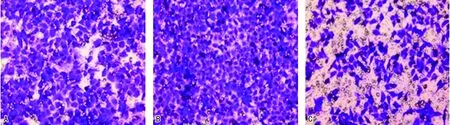
注:A為陰性對照組;B為Skp2干擾表達組;C為Skp2過表達組。
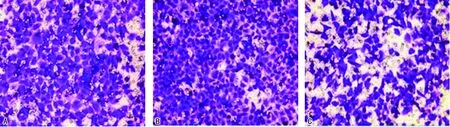
注:A為陰性對照組;B為Skp2干擾表達組;C為Skp2過表達組。
表3 3組細胞侵襲、遷移能力
2.43組細胞中Skp2、Snaill、E-cadherin和Vimentin蛋白表達情況 與陰性對照組相比,Skp2干擾表達組細胞中Skp2和E-cadherin蛋白表達水平降低,Snaill和Vimentin蛋白表達水平升高,差異有統計學意義(P<0.05);與Skp2干擾表達組相比,Skp2過表達組細胞中Skp2和E-cadherin蛋白表達水平升高,Snaill和Vimentin蛋白表達水平降低,差異有統計學意義(P<0.05)。見表4、圖3。
表4 3組細胞中Skp2、Snaill、E-cadherin和Vimentin蛋白表達情況

圖3 western blot法結果
3 討 論
上皮性卵巢癌的高致死率很大程度上是由于高侵襲性和易于局部及遠端轉移造成的,其中EMT起著實質性的作用。在腫瘤進展過程中,卵巢癌細胞EMT表現為上皮細胞特異性標志物如E-cadherin、閉鎖蛋白1(ZO-1)等表達下調,而間充質細胞特異性標志物如Vimentin蛋白、N-鈣黏蛋白(N-cadherin)等表達增加為特征,這意味著EMT是卵巢癌進展的先決條件[10]。E-cadherin表達下調是EMT的特征性改變,主要受轉錄因子Snaill的調控,是癌細胞侵襲的前提條件。Snaill可以與E-cadherin啟動子中的E-BOX結合,抑制其轉錄[11]。因此,調控EMT相關因子可能為卵巢癌的治療提供新的線索。
Skp2是一種E3泛素連接酶[12],調控多種腫瘤抑制因子水平,包括p27和叉頭狀轉錄因子O1(FOXO1)[12]。Skp2低表達在包括卵巢癌在內的多種人類癌癥中經常被觀察到,然而,Skp2與EMT的相關性尚不清楚[13]。本研究探討了Skp2通過調控Snaill水平在抑制上皮性卵巢癌細胞EMT方面的作用。結果表明,Skp2在卵巢癌組織中表達明顯降低,且在其卵巢癌中水平升高則會抑制Snaill的表達,從而抑制卵巢癌細胞的侵襲性。同時,有研究顯示,Skp2對Snaill表達有抑制作用,而Snaill對Skp2表達無明顯影響[14],表明Snaill是Skp2的下游因子。Snaill被認為是EMT中的轉錄因子。為了進一步支持上述結果,筆者進一步探討了Skp2在SKOV3細胞侵襲、遷移中的作用,結果表明,Skp2抑制了SKOV3細胞的侵襲和遷移。
有研究者提出了一個有關EMT的全面監管網絡,以強調Skp2的關鍵作用[14]。然而尚不清楚EMT過程中Skp2發揮作用的確切機制,在某些情況下,Skp2低表達與E-cadherin低表達相關[15]。有研究報道,Skp2主要充當肝癌細胞中與EMT相關的抑制因子,并與基質金屬蛋白酶結合抑制其侵襲性,但這些因子與EMT之間的關系尚未確定[16]。此外,磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信號通路的激活導致E-cadherin表達下調和間充質標志物表達的上調。糖原合成酶激酶3β(GSK-3β)通過磷酸化的機制下調Snaill來抑制EMT,而PI3K/AKT通過GSK-3β失活,穩定Snaill來促進EMT[17-18]。本研究觀察到促進Skp2表達可以使Snaill蛋白水平降低,抑制卵巢癌細胞EMT,而抑制Skp2表達則作用相反。上述結果對于在EMT中建立Skp2的功能網絡非常有意義,但本研究沒有對Skp2相關機制進行研究,說服力較欠缺。
綜上所述,Skp2在上皮性卵巢癌組織中低表達,它在卵巢癌細胞遷移、侵襲和EMT的調控中起重要作用。通過基因干預技術促進Skp2的表達可以降低SKOV3細胞中Snaill表達,抑制EMT,而抑制Skp2表達則作用相反。

