抗菌肽的抗菌機制及其在醫藥中的應用前景
賈艷麗 仇燕

摘 要:隨著抗生素副作用的日益凸顯,以及其被批準數量的逐年下降,研發功能相似且不易產生耐藥性的其他活性物質迫在眉睫。抗菌肽具有廣譜抗菌性、熱穩定性,作用機理獨特,既能起到體內抗病菌感染、促進癌細胞凋亡的作用,還可作為抗病毒化療劑和醫療器械的抗菌材料。系統綜述了抗菌肽的抗菌機制,及其在醫藥領域抑制抗耐藥菌的產生、抗癌以及抗病毒感染的作用,闡明了抗菌肽存在的穩定性、溶血性及毒性等問題,并對其發展前景進行了展望。指出今后可在以下方面對抗菌肽展開深入研究:1)結合體內抑菌機制進行研究,推動抗菌肽的開發應用;2)通過替換、修飾氨基酸殘基,合成雜合肽,優化抗菌肽結構,提高其活性,降低毒副作用并預防耐藥性的產生;3)利用抗菌肽傳遞系統或抗菌肽與綠色天然提取物聯合作用,提高抗菌活性和生物利用度。
關鍵詞:多肽與蛋白質生物化學;抗菌肽;抗菌機制;醫藥應用;抗生素
中圖分類號:Q71;R978.1?文獻標識碼:A
文章編號:1008-1542(2021)01-0067-08
抗生素在疾病的預防和治療、農業和畜牧業產品質量提升、食品及醫藥安全等方面發揮了積極作用,但傳統抗生素的廣泛應用,產生的機體過敏反應、耐藥及多重耐藥性(multi-drug resistance,MDR)菌株等問題,造成了抗生素的低效性。近年來,抗生素的副作用日益凸顯,并且批準數量呈逐年下降的趨勢,因此研發功能相似且不易產生耐藥性的其他活性物質迫在眉睫。抗菌肽(antimicrobial peptides,AMPs)作為抗生素的一個“新家族”,具有低耐藥、低致敏、低毒性等優點,將抗菌肽與抗生素聯合作用可顯著降低抗生素耐藥性的產生,成為國內外動物和人類醫學、營養學、飼料(食品)學和免疫學等研究領域開發的熱點。
抗菌肽又稱抗菌生物肽或肽抗菌素,是機體先天性免疫系統的主要成分之一,可對感染進行及時有效的非特異性防御[1]。最初認為細胞膜是抗菌肽作用于病原體唯一的靶點,近年來,細胞壁和胞內組分被證明也是抗菌肽作用的重要靶點。與傳統抗生素相比,“新型抗生素”(抗菌肽)具有廣譜抗菌性、熱穩定性且作用機理獨特等特征,在抗真菌、免疫調節、抑殺癌細胞、抗病毒和抗寄生蟲等方面有顯著作用[2]。因此,抗菌肽的抗菌機制和多種生物活性,使其有望成為解決耐藥菌、癌癥及病毒感染等問題的理想物質,在醫藥領域具有很大的開發應用前景。
1?抗菌肽簡介
抗菌肽多為陽離子型,帶+2—+9個凈電荷,分子質量一般小于10 kD。其N端富含Arg,Lys等親水性氨基酸,C端富含Ala,Val等疏水性氨基酸,形成兩親性分子結構。抗菌肽作為宿主防御肽,幾乎存在于所有生物體內。目前,從哺乳動物、兩棲動物、海洋動物、昆蟲、植物和微生物等生物體內已發現3 000多種抗菌肽,其中約76.11%來源于動物[3-6](見表1)。
2?抗菌肽的抗菌機制
抗菌肽與抗生素的抗菌機制存在差異,前者主要為肽的吸引、附著、插入與定向[18]。早前有報道帶正電荷的抗菌肽結合細胞膜中帶負電荷的磷脂是唯一的殺菌機制,最近越來越多研究表明抗菌肽結合細胞壁或胞內組分的非膜靶點可直接殺死病原體[19]。此外,抗菌肽還可參與體內免疫調節,間接發揮抑菌作用[7]。
2.1?膜靶向機制
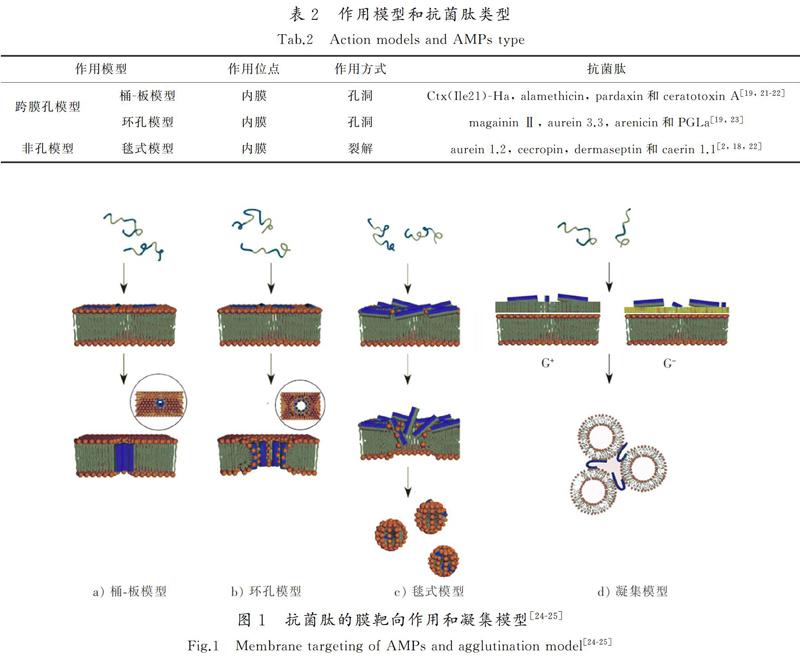
抗菌肽與細胞膜的靜電結合是對抗入侵病原體的首要和關鍵步驟之一。隨著肽分子的增多,結合細胞膜的靜電吸引和滲透作用加強,之后肽分子在膜表面自由橫向擴散和預組裝。抗菌肽插入細胞膜后,肽的疏水面結合非極性脂酰鏈區域,而親水面則保持與極性脂質頭和水相接觸,形成孔洞或裂解細胞膜[18]。抗菌肽破壞細胞膜的方式有2種作用模型:跨膜孔模型和非孔模型,前者在膜上形成“桶-板”型或“環孔”型孔洞破壞細胞膜,后者在膜表面形成“地毯”裂解脂質雙分子層[20](見表2)。抗菌肽的靶向作用和凝集模型見圖1。
1)桶-板模型(barrel-stave model)?兩親性肽分子(α-螺旋或β-折疊)以單體結合膜表面,達到一定閾值濃度形成多聚體,垂直插入膜疏水核心[2],肽鏈的疏水面與脂質雙分子層非極性脂酰鏈作用,親水面形成孔隙內側且長度應與脂質雙分子層厚度相同,形成短暫的“桶-板”型孔洞(見圖1 a))。
2)環孔模型(toroidal pore model)?抗菌肽在細胞膜表面形成α-螺旋垂直插入脂質雙分子層,導致雙分子層內小葉間的彎曲形成瞬態孔隙。肽鏈嵌在親水和疏水界面,與脂質雙分子層頭部排列在孔內側(始終相互作用)(見圖1b))。相關研究表明,以胞內成分為靶點的抗菌肽,可能通過“環孔”型孔洞進入胞內,短暫孔隙破壞膜的屏障作用,造成跨膜電位損失[2]。
3)毯式模型(carpet model)?短鏈肽分子平行排列于膜表面,肽鏈的積累引起雙層膜兩小葉間的張力,當抗菌肽超過閾值濃度,以表面活性劑的方式向內裂解細胞膜,解體的細胞膜形成脂微膠粒[26-27](見圖1 c))。毯式模型與環孔模型相似,肽作用過程中始終與脂質頭保持接觸,但不需要插入膜疏水核心,也無需形成穿膜孔洞。
除以上3種常見模型,SINHA等[28]提出的凝集模型(見圖1 d)),是一種與膜成孔方式截然不同的作用模型。凝集模型(agglutination model)是陽離子肽與革蘭氏陰性菌外膜脂多糖或革蘭氏陽性菌細胞壁肽聚糖結合形成的膠束復合物,誘導細菌細胞凝集且肽分子不滲透細胞膜,凝集細胞易被吞噬,防止有毒物質的釋放。dermcidin(DCD)和cathelicidin(LL-37)與膜結合是比上述作用方式更為復雜的2種抗菌肽。ZETH等[29]的模擬實驗表明,DCD在溶液中組裝成一個六聚體預通道復合物后再與膜整合,并非之前認為通過簡單的桶-板模型發揮作用。XHINDOLI等[27]認為LL-37通過環孔模型與膜結合發揮作用,而ZETH等[29]認為LL-37在細胞膜上形成纖維狀的超分子結構(低聚物,纖維樣結構可能是一個中間狀態),進一步組裝成結構未知的跨膜孔隙,與之前報道的環孔模型存在偏差。
在過去的幾十年里,人們利用模型膜系統對抗菌肽與膜相互作用進行了廣泛研究,并在此基礎上建立了幾種肽-膜相互作用模型。由于細菌膜的復雜性,抗菌肽與整個細菌膜的作用機制可能會有所不同。BOIX-LEMONCHE等[30]利用diSC3(5)和PI熒光染料結合的快速熒光微板試驗,研究gramicidin D 和melittin分別對金黃色葡萄球菌(Staphylococcu saureus)和表皮葡萄球菌(Staphylococcus epidermidis)膜的影響。結果顯示:gramicidin D形成離子通道且只導致diSC3(5) 快速增加,隨著肽濃度的下降,結合動力學變慢,證實2種菌均因膜的去極化而死亡;melittin可形成短暫孔隙,在亞抑菌濃度下只有PI熒光強度增加,在殺菌濃度下diSC3(5)和PI 2種熒光強度同時增加,表明膜滲透是抑菌過程中的一個關鍵環節。
總之,抗菌肽的膜靶向抗菌機制可通過多種作用模型進行描述,且不同抗菌肽會以不同的作用模型產生殺菌作用。目前僅通過簡單的人工膜系統描述其殺菌機制,并不能清楚地反映抗菌肽在體內等復雜環境條件下的活性及抑菌狀況,因此需要通過大量的體內試驗確定其抑菌機制,進一步推動抗菌肽的開發和應用。
2.2?非膜靶向機制
2.2.1?抑制或破壞細胞壁形成
抗菌肽通過抑制脂質Ⅱ,Ⅲ及Ⅳ(細胞壁合成的前體分子)的合成直接抑制細胞壁的形成,還可以引發細胞釋放自溶酶,裂解肽聚糖從而破壞細胞壁,抗菌肽nisin, subtilin, gallidermin和bacitracin等抑制細胞壁的合成[31]。蛋白質組學和Western blot分析顯示,合成六肽MP196, gramicidin S和bac8c(富含Arg, Try富含陽離子的短肽)作用于細菌后,造成呼吸作用和細胞壁生物合成所必需的外周膜蛋白離域化,限制細胞能量,破壞細胞壁的完整性[32]。
2.2.2?影響胞內大分子作用
在不造成膜損傷情況下,抗菌肽轉至胞內結合胞內大量的陰離子分子或細胞器,影響胞內核酸、蛋白質的合成與功能、酶的活性及產生氧化應激反應,導致細胞死亡。
1)影響核酸、蛋白的合成與功能?兩棲動物抗菌肽buforin Ⅱ以胞內成分為靶點穿透細胞膜,高度依賴與H2A組蛋白N端區域的互補性與DNA和RNA結合,其功能被抑制,導致細胞快速死亡[33]。HE等[34]研究發現抗菌肽TO17進入胞內穿透金黃色葡萄球菌細胞質,誘導基因組DNA和總RNA降解。bac與細菌的內膜靶蛋白轉運體SbmA結合后,通過細菌內化作用進入胞內,抑制70S核糖體的蛋白合成,并與分子伴侶DnaK相互作用,抑制伴侶蛋白的折疊[35]。MARDIROSSIAN等[36]發現富含Pro的抗菌肽tur1A,tur1B與bac7的抑菌機制相似,通過結合核糖體抑制蛋白合成。
2)抑制酶活性及能量代謝?BRAFFMAN等[37]報道了microcin J2和capistruin結合革蘭氏陰性菌胞內RNA聚合酶,抑制RNA聚合酶活性并影響細菌轉錄。兩棲動物α-螺旋抗菌肽aurein,citropin 1.1和dermaseptin影響大腸桿菌(Escherichia coli)細胞膜上ATP酶的活性。抗菌肽gramicidin S可誘導參與外周細胞分裂調節因子MinD、脂質Ⅱ生物合成蛋白MurG和細胞色素c離域化,用其處理枯草芽孢桿菌(Bacillus subtilis)后,會造成細胞膜中磷脂合成酶PlsX,MurG和細胞色素c(無ATP合酶)等完全脫落,ATP合成受阻影響能量代謝[38-39]。
3)破壞細胞器?富含His的抗菌肽進入真菌胞內與線粒體相互作用,造成ATP外流,阻礙線粒體的呼吸和磷脂大分子的氧化,最終導致線粒體膜和質膜的損傷,觸發核苷酸的外流,最終導致細菌死亡[40]。
4)產生氧化應激反應?WANG等[41]研究了美拉德反應衍生肽的水解產物對大腸桿菌的影響,結果表明,在短肽HGM-Hp1和HGM-Hp2誘導作用下,胞外和胞內H2O2的量顯著增加,且胞內H2O2量的積累可能是肽觸發ROS途徑,導致氧化應激產生抑菌作用,首次報道了美拉德反應衍生肽的水解產物可能通過誘導胞內產生H2O2發揮抗菌作用。
抗菌肽的膜靶向和非膜靶向等多靶點作用模式是細菌不易對其產生耐藥性的主要原因,兩者可以聯合發揮作用。KO等[42]認為天然多肽pleurocidin在生理鹽濃度下對耐藥金黃色葡萄球菌仍有抑菌活性,通過去極化實驗、碘化丙鈉攝取實驗和DNA結合實驗表明,pleurocidin破壞細胞膜的完整性進入胞內與DNA結合從而殺死細菌,結晶紫染色和顯微鏡觀察可知,低濃度pleurocidin對生物膜具有抑制和清除作用。arenicin-3是一種新型抗菌肽,能夠與革蘭氏陰性菌的外膜和細胞膜結合并破壞其完整性,轉移至胞內抑制蛋白質合成,arenicin家族對多種耐多藥革蘭氏陰性菌和革蘭氏陽性菌均有殺菌作用,具有很大的臨床應用潛力[2]。因此,細胞膜不再是抗菌肽作用于病原體唯一的靶點,抗菌肽還作用于細胞壁和胞內核酸、蛋白、酶以及細胞器等抑制胞內關鍵過程,導致病原體代謝受阻從而造成細菌死亡。針對抗菌肽胞內靶點機制的研究,可預防病原體對其產生耐藥性。
2.3?參與免疫調節機制
抗菌肽不僅可以直接殺死細菌,還以間接作用方式通過參與不同的免疫調節效應發揮抗菌活性,誘導細胞因子分泌并招募巨噬細胞、誘導合成促炎因子、減少內毒素引起的炎癥反應以及調節適應性免疫等能夠增強機體的抗感染能力[7,40]。
綜上所述,抗菌肽靜電結合細胞膜后形成“桶-板型”、“環孔型”孔洞或“毯式”裂解細胞膜等導致其滲透性增強,細胞內容物溢出,最終導致病原體死亡;抗菌肽靶向細胞壁、結合胞內生物大分子物質或細胞器,影響細胞的呼吸、滲透調節、肽聚糖和脂質合成、ATP生成等,造成必需的離子和代謝物溢出。此外,抗菌肽還可通過參與體內免疫調節作用間接發揮抗菌活性。總之,抗菌肽有多種作用機制且作用靶點豐富,致使病原菌難以產生耐藥性,大大降低了使用風險,有望成為替代抗生素的新一代抗菌藥物。
3?抗菌肽在醫藥領域的應用
近年來,抗菌肽的多種生物活性逐漸得到確認,其抗細菌、抗真菌、免疫調節、抗癌細胞、抗病毒和抗寄生蟲等作用在醫藥領域具有廣泛的應用前景。
3.1?抗菌作用
抗菌肽的廣譜抗菌性,不僅針對革蘭氏陽性菌和革蘭氏陰性菌,還抑制真菌分生孢子和菌絲的生長。合成肽brilacidin可作為靜脈注射制劑,治療革蘭氏陽性菌引起的皮膚感染(NCT02052388)以及用于頭頸癌患者放射性口腔黏膜炎的口腔沖洗(NCT02324335),目前已分別完成Ⅱ期臨床試驗,Cellceutix公司和FDA(Food and Drug Administration)均批準將brilacidin推進到Ⅲ期臨床試驗[2]。抗菌肽rBPI 21對革蘭氏陰性菌表現出極強的殺菌活性,正在進行Ⅲ期臨床試驗用于治療腦膜炎[43]。arenicin-3(專利號WO2011070032 A1)正被開發用于治療由革蘭氏陰性菌引起的獲得性肺炎和尿路感染[2]。Novexatin NP21和HXP124應用于指甲真菌感染,已分別完成Ⅱb和Ⅱa期臨床試驗[3]。FDA和EMEA(European Agency for the Evaluation of Medicinal Products)已批準將抗真菌感染的抗菌肽caspofungin,anidulafungin和micafungin等用于治療全身性念珠菌血癥和念珠菌病[44]。RIORDAN等[45]報道了一種將人類防御肽附著于醫院器械鋼鐵表面的優良抗菌材料,可用于醫療保健領域,預防感染傳播。
3.2?免疫調節作用
作為天然免疫的重要介質,抗菌肽是先天免疫和適應性免疫的橋梁,在免疫反應的不同階段具有多種功能。抗菌肽在治療慢性炎癥中發揮作用,促進輔助性T細胞增殖和T細胞趨化因子的產生,增加體內抗體IgG的水平,促進巨噬細胞的凋亡,激活淋巴細胞清除受感染的細胞。抗菌肽參與急性感染相關的宿主防御,誘導細菌裂解,促進巨噬細胞前期的吞噬作用并防止擴散感染,刺激成纖維細胞和上皮細胞有絲分裂,促進成纖維細胞的生長,加速傷口愈合[7,40]。宿主防御肽LL-37用于治療慢性傷口感染(如小腿潰瘍),已開始臨床探索[26]。MANKO-PRYHODA等[46]報道了采用抗菌肽治療感染十二指腸賈第蟲(Giardia duodenalis)和腸道致病性大腸埃希菌(Escherichia coli EPEC)的小鼠,研究表明,體內的鼠防御素-3和三葉肽因子-3表達水平提高,減輕了小鼠疾病的嚴重程度。
3.3?抗癌作用
癌細胞膜中少量磷脂酰絲氨酸外化、陰離子糖蛋白(黏蛋白、蛋白聚糖)在癌細胞中過表達、外膜總負電荷增多、膽固醇含量降低和微絨毛增加,導致陽離子抗菌肽能夠與其特異性結合[25]。抗菌肽還可以干擾癌細胞的能量代謝,抑制細胞增殖,誘導細胞凋亡和周期阻滯[47]。研究發現,抗菌肽對肺癌、乳腺癌、前列腺癌、胰腺癌、黑色素瘤、膀胱癌、卵巢癌和白血病等均有作用。LEWIES等[47]發現抗菌肽通過負向影響能量代謝,降低黑素瘤細胞的侵襲、增殖和轉移(糖酵解和線粒體呼吸),增加活性氧的產生,引起細胞凋亡。非洲爪蟾皮膚分泌的抗菌肽magainin,用其開發的抗菌肽藥品MAI278已接近完成Ⅲ期臨床試驗,可把宿主防御肽變成一種新型的抗菌治療藥物,用于治療腫瘤細胞和病毒感染[48],抗菌肽temporins(專利號WO2014003537 A1)可用于治療癌癥[10]。
3.4?其他作用
抗菌肽能結合病毒包膜、抑制基因表達、阻止病毒增殖以及擾亂病毒的組裝程序等發揮抗病毒活性[3]。抗菌肽對艾滋病毒HIV、單純胞疹病毒HSV、乙肝病毒HBV、丙肝病毒HCV和乙型腦炎病毒JEV等多種病毒均有抑制作用[7]。epinecidin-1是對抗乙型腦炎病毒JEV的滅活疫苗,還是對抗神經壞死病毒的化療劑[43]。temporins具有較強的抗耐藥利什曼原蟲活性的作用,能有效殺死細胞內的寄生蟲而不對宿主巨噬細胞產生毒性,這些小分子肽是一類具有開發治療潛力的新型抗寄生蟲藥物。
目前抗菌肽因穩定性、溶血性及毒性等問題,主要用于局部皮膚,且多處于臨床試驗階段。2種抗菌肽的結合或抗菌肽序列結構的修飾,可改善抗菌肽毒性及溶血性問題。抗菌肽組裝體作為功能藥物載體,在傳遞藥物和生物活性分子時能夠減少臨床醫療過程中病菌感染[49]。此外,傳遞系統(聚合物凝膠、各種無機納米材料、自組裝體系)作為抗菌肽和其他生物大分子藥物的載體,可應對各種環境刺激(離子強度、pH值、溫度等),提高其生物活性、生物利用度和靶向特異性,克服溶血性并降低細胞毒性等,已成為藥物循環中的重要環節[50]。NORDSTRM等[51]研究了納米凝膠和抗菌肽結合的影響因素,將可降解陰離子樹突狀納米凝膠(DNG)作為LL-37和DPK-060的載體。肽和DNGs肽均引起膜的不穩定,兩者抗菌活性相當,當DNGs肽濃度為100 μmol/L(高濃度)時,顯示出對紅細胞的低毒性作用。
4?結?語
抗菌肽作為一種小分子新型“抗生素”,其多種抗菌機制比傳統的抗生素具有顯著優勢。近年來,針對抗菌肽的結構、活性以及作用機制方面的研究不斷深入,在作用過程中如何發揮抗菌肽的活性并應用于醫藥臨床尚存在以下問題。
1)膜作用模型與抗菌肽體外靶向結合研究不能完全清楚地反映抗菌肽在體內復雜環境條件下的活性與抑菌狀況,需結合體內抑菌機制加以研究,推動抗菌肽的開發應用。
2)抗菌肽的安全性(毒性、溶血性)和穩定性(包括抗菌肽在體內半衰期、酶解穩定性、鹽敏感性)是醫藥領域開發應用面臨的挑戰。有報道表明,延長抗菌肽的暴露時間,可通過替換氨基酸殘基、修飾或雜合肽優化抗菌肽結構,提高其活性,降低毒副作用并預防耐藥性的產生。
3)傳遞系統作為抗菌肽的藥物循環載體,尚處于研發的早期階段,需進一步了解肽分子、載體材料和環境等在抗菌肽與傳遞載體結合過程中的各項指標,提高整體性能。利用抗菌肽的廣譜抗菌性與綠色天然提取物中的抗菌活性物質聯合作用,提高其抗菌活性和生物利用度,降低耐藥性、細胞毒性和溶血性已成為研究熱點。隨著現代分子生物學、生物信息學、蛋白質組學、基因組學、基因工程等學科的發展,抗菌肽的構效關系和作用機制將會得到逐漸闡明,也會進一步推動抗菌肽的廣泛應用。
參考文獻/References:
[1]?WANG Shuai, ZENG Xiangfang, YANG Qing, et al.Antimicrobial peptides as potential alternatives to antibiotics in food animal industry[J]. International Journal of Molecular Sciences, 2016, 17(5): 603-614.
[2]?CIUMAC D, GONG Haoning, HU Xuzhi, et al. Membrane targeting cationic antimicrobial peptides[J]. Journal of Colloid and Interface Science, 2019, 537: 163-185.
[3]?MOOKHERJEE N, ANDERSON M A, HAAGSMAN H P, et al.Antimicrobial host defence peptides: Functions and clinical potential[J]. Drug Discovery, 2020,19(5): 311-332.
[4]?許曉燕,夏嬙.昆蟲抗菌肽免疫調控作用及機制研究進展[J].醫學研究生學報,2020,33(7):771-776.
XU Xiaoyan, XIA Qiang. Progress in immunomodulatory effects and their mechanisms of insectantimicrobial peptides[J]. Journal of Medical Postgraduates, 2020, 33(7): 771-776.
[5]?TANG S S, PRODHAN Z H, BISWAS S K, et al. Antimicrobial peptides from different plant sources: Isolation, characterisation, and purification[J]. Phytochemistry, 2018, 154: 94-105.
[6]?SIVAKAVALLI J, JAMES A, PARK K, et al.Purification of WAP domain-containing antimicrobial peptides from green tiger shrimp Peaneaus semisulcatus[J].Microbial Pathogenesis, 2020,140: 103920.
[7]?MORAVEJ H,MORVAEJZ,YAZDANPARAST Z, et al.Antimicrobial peptides: features, action, and their resistance mechanisms in bacteria[J].Microbial Drug Resistance, 2018,24(6): 747-767.
[8]?JEONG J H, KIM M, KIM Y. NMR structural studies and mechanism of action of lactophoricin analogs as antimicrobial peptides[J].Biochimicaet BiophysicaActa(BBA)-Biomembranes,2020,1863(1):183469.
[9]?RAHEEM N, KUMAR P, LEE E, et al.Insights into the mechanism of action of two analogues of aurein 2.2[J].Biochimicaet Biophysica Acta (BBA)-Biomembranes,2020.doi:10.1016/j.bbamem.2020.183262.
[10]LADRAM A.Antimicrobial peptides from frog skin biodiversity and therapeutic promises[J].Frontiers in Bioscience,2016,21(7):1341-1371.
[11]陳選,陳旭,韓金志,等.海洋魚源抗菌肽的研究進展及其在食品安全中的應用前景[J/OL].食品科學.[2020-07-22]. https://kns.cnki.net/kcms/detail/11.2206.TS.20200722.1456.156.html.
CHEN Xuan, CHEN Xu, HAN Jinzhi, et al.Research Progress and Application Prospect of Antimicrobial Peptides From Marine Fish in Food Safety[J/OL]. Food Science.[2020-07-22].https://kns.cnki.net/kcms/detail/11.2206.TS.20200722.1456.156.html.
[12]LI Tingting,LIU Quanwei, WANG Dangfeng, et al.Characterization and antimicrobial mechanism of CF-14, a newantimicrobial peptide from the epidermal mucus of catfish[J]. Fish & Shellfish Immunology,2019,92: 881-888.
[13]AN Mingyu,GAO Jie, ZHAO Xiaofan, et al.A new subfamily of penaeidin with an additional serine-rich region from kuruma shrimp (Marsupenaeus japonicus) contributes to antimicrobial and phagocytic activities[J].Developmental & Comparative Immunology,2016, 59: 186-198.
[14]BANDEIRA P T,VEMAL J,MATOS G M, et al.A Type Ⅱ acrustin from the pink shrimp Farfantepenaeus paulensis(crusFpau) is constitutively synthesized and stored by specific granule-containing hemocyte subpopulations[J].Fish & Shellfish Immunology,2020,97:294-299.
[15]ZHANG Heqian, CHENG Wenzhi, ZHENG Libing, et al.Identification of a group D anti-lipopolysaccharide factor (ALF) from kuruma prawn (Marsupenaeus japonicus) with antibacterial activity against vibrio parahaemolyticus[J].Fish & Shellfish Immunology,2020, 102: 368-380.
[16]BRADY D,GRAPPUTO A,ROMOLI O, et al.Insect cecropins, antimicrobial peptides with potential therapeutic applications[J].International Journal of Molecular Sciences, 2019,20(23): 5862.
[17]楊雪.家蠅兩種新型抗菌肽基因muscin和domesticin的鑒定[D].保定:河北大學,2015.
YANG Xue. Identification of Two New Antibacterial Peptides, Muscinand Domesticn, in Musca Domestica[D]. Baoding: Hebei Univer-sity, 2015.
[18]SHAHMIRI M,ENCISO M,MECHLER A.Controls and constrains of the membrane disrupting action of aurein 1.2[J].Scientific Reports,2015,5:16378.
[19]PFALZGRAFF A,BRANDENBURG K,WEINDL G.Antimicrobial peptides and their therapeutic potential for bacterial skin infections and wounds[J].Frontiers in Pharmacology,2018,9:281.
[20]HOURI A J,MECHLER A.Mechanism of action of the antimicrobial peptide caerin 1.1[J].Chemistry Select, 2020, 5: 5895-5902.
[21]CESPEDES G F,LORENZN E N,VICENTE E F,et al.Mechanism of action and relationship between structure and biological activity of Ctx-Ha:A new ceratotoxin-like peptide from
Hypsiboas albopunctatus[J].Protein and Peptide Letters,2012,19(6):596-603.
[22]FALANGA A, LOMBARDI L, FRANCI G, et al. Marine antimicrobial peptides: Nature provides templates for the design of novel compounds against pathogenic bacteria[J]. International Journal of Molecular Sciences, 2016, 17(5): 785-797.
[23]HARTMANN M,BERDITSCH M,HAWECKER J,et al.Damage of the bacterial cell envelope by antimicrobial peptides gramicidin S and PGLa as revealed by transmission and scanning electron microscopy[J].Antimicrobial Agents and Chemotherapy,2010,54(8):3132-3142.
[24]TOKE O. Antimicrobial peptides: new candidates in the fight against bacterial infections[J]. Peptides Science, 2005, 80(6): 717-735.
[25]ROBERT , LEFVRE [AKT·], FILLION M, et al.Mimicking and understanding the agglutination effect of the antimicrobial peptide thanatinusing model phospholipid vesicles[J]. Biochemistry, 2015, 54(25): 3932-3941.
[26]BAXTER A A, LAY F T, POON I K H, et al. Tumor cell membrane-targeting cationic antimicrobial peptides: novelinsights into mechanisms of action and therapeutic prospects[J]. Cellular and Molecular Life Sciences, 2017, 74(20): 3809-3825.
[27]XHINDOLI D,PACOR S,BENINCASA M,et al.The human cathelicidin LL-37:A pore-forming antibacterial peptide and host-cell modulator[J].Biochimica et BiophysicaActa,2016,1858(3):546-566.
[28]SINHA S,ZHENG L Z,MU Y G,et al.Structure and interactions of A host defense antimicrobial peptide thanatin in lipopolysaccharide micelles reveal mechanism of bacterial cell agglutination[J].Scientific Reports,2017,7(1):17795.
[29]ZETH K,SANCHO-VAELLO E.The human antimicrobial peptides dermcidin and LL-37 show novel distinct pathways in membrane interactions[J].Frontiers in Chemistry,2017,5:86.
[30]BOIX-LEMONCHE G, LKKA M, SKERLAVAJ B. A rapid fluorescence-based microplateassay to investigate the interaction of membrane active antimicrobial peptides with whole Gram-positive bacteria[J]. Antibiotics, 2020, 9(2): 92-107.
[31]OMARDIEN S,BRUL S,ZAAT S A J.Antimicrobial activity of cationic antimicrobial peptides against gram-positives:Current progress made in understanding the mode of action and the response of bacteria[J].Frontiers in Cell and Developmental Biology,2016,4:111.
[32]WENZEL M,CHIRIAC A I,OTTO A,et al.Small cationic antimicrobial peptides delocalize peripheral membrane proteins[J].Proceedings of the National Academy of Sciences of the United States of America,2014,111(14):E1409-E1418.
[33]BONDARYK M, STANISZEWSKA M, ZIELINSKA P, et al. Natural antimicrobial peptides as inspiration for design of a new generation antifungal compounds[J]. Journal of Fungi, 2017, 3(3): 46-81.
[34]HE S W,WANG G H,YUE B,et al.TO17:A teleost antimicrobial peptide that induces degradation of bacterial nucleic acids and inhibits bacterial infection in red drum,Sciaeno psocellatus[J].Fish & Shellfish Immunology,2018,72:639-645.
[35]CARDOSO M H, MENEGUETTI B T, COSTA B O, et al. Non-Lytic antibacterial peptides that translocate through bacterial membranes to act on intracellular targets[J]. International Journal of Molecular Sciences, 2019, 20(19): 4877-4899.
[36]MARDIROSSIAN M,PRBASKINE N,BENINCASA M,et al.The dolphin proline-rich antimicrobial peptide Tur1A inhibits protein synthesis by targeting the bacterial ribosome[J].Cell Chemical Biology,2018,25(5):530-539.
[37]BRAFFMAN N R, PISCOTTA F J, HAUVER J, et al.Structural mechanism of transcription inhibition by lasso peptides microcin J25 and capistruin[J]. Proceedings of the National Academy of Sciences, 2019,116(4): 1273-1278.
[38]BERDITSCH M, AFONIN S, REUSTER J, et al. Supreme activity of gramicidin S against resistant, persistent and biofilm cells of Staphylococci and Enterococci[J].Scientific Reports, 2019, 9(1): 1-15.
[39]BERDITSCH M,AFONIN S,STEINEKER A,et al.Fermentation and cost-effective 13C/15N labeling of the nonribosomal peptide gramicidin S for nuclear magnetic resonance structure analysis[J].Applied and Environmental Microbiology,2015,81(11):3593-3603.
[40]LEI Jun, SUN Lichun, HUANG Siyu,et al. The antimicrobial peptides and their potential clinical applications[J].American Journal of Translational Research, 2019, 11(7): 3919-3931.
[41]WANG Jiaxing,WEI Rongbian,SONG Ru.Novel antibacterial peptides isolated from the maillardreaction products of half-fin anchovy (Setipinna taty) hydrolysates/glucose and their mode of action in Escherichia coli[J]. Marine Drugs, 2019, 17(1): 47-64.
[42]KO S J,KANG N H,KIM M K,et al.Antibacterial and anti-biofilm activity,and mechanism of action of pleurocidin against drug resistant Staphylococcus aureus[J].Microbial Pathogenesis,2019,127:70-78.
[43]LAKSHMAIAH N J,CHEN J Y.Antimicrobial peptides:Possible anti-infective agents[J].Peptides,2015,72:88-94.
[44]RAUTENBACH M,TROSKIE A M,VOSLOO J A.Antifungal peptides:To be or not to be membrane active[J].Biochimie,2016,130:132-145.
[45]RIORDAN L, SMITH E F, MILLS S, et al.Directly bonding antimicrobial peptide mimics to steel and the real world applications of these materials[J]. Materials Science and Engineering, 2019, 102: 299-304.
[46]MANKO-PRYHODA A, ALLAIN T, MOTTA J P, et al.Giardia spp. promote the production of antimicrobial peptides and attenuate disease severity induced by attaching and effacing enteropathogens via the induction of the NLRP3 inflammasome[J]. International Journal for Parasitology,2020, 50(4): 263-275.
[47]LEWIES A,WENTZEL J F,MILLER H C,et al.The antimicrobial peptide nisin Z induces selective toxicity and apoptotic cell death in cultured melanoma cells[J].Biochimie,2018,144:28-40.
[48]燕曉翠,楊春蕾,姚大為,等.抗菌肽的國內外研究進展[J].天津農業科學,2017,23(5):35-41.
YAN Xiaocui,YANG Chunlei,YAO Dawei,et al.Research progress on domestic and abroad of antibacterial peptides[J].Tianjin Agricultural Sciences,2017,23(5):35-41.
[49]周欣宇,周春才.抗菌肽及類抗菌肽的設計、合成及應用[J].化學進展,2018,30(7):913-920.
ZHOU Xinyu, ZHOU Chuncai. Design, synthesis and applications of antimicrobial peptides and antimicrobial peptide-mimetic copolymers[J]. Progress in Chemistry, 2018, 30(7): 913-920.
[50]NORDSTRM R, NYSTRM L, ILYAS H, et al. Microgels as carriers of antimicrobial peptides:Effects of peptide PEGylation[J]. Colloids and Surfaces A, 2019, 565: 8-15.
[51]NORDSTRM R, ANDREN O C J, SINGH S, et al. Degradable dendritic nanogels as carriers for antimicrobial peptides[J]. Journal of Colloid and Interface Science, 2019, 554:592-602.

