IRF評估新型冠狀病毒肺炎患者死亡風險的價值
曹曉淬,張紅梅,孔 曼,毛小莉,黃麗鋒,盧忠心
華中科技大學同濟醫學院附屬武漢市中心醫院檢驗科,湖北武漢 430014
新型冠狀病毒肺炎(COVID-19)主要的傳播途徑是呼吸道傳播和飛沫傳播,病原體通過呼吸道侵入人體,作用于呼吸道黏膜上皮細胞和肺泡上皮細胞,引起肺部感染,并伴隨脾臟、淋巴結、骨髓組織等免疫器官的損傷。患者發病的常見癥狀有發燒、咳嗽、肌痛或疲勞,部分患者有頭痛、咯血和腹瀉等癥狀,約有50%肺部感染的患者會出現呼吸困難,甚至有1/3患者被送入ICU進行治療。輕型或普通型患者可很快在適當的醫療干預下恢復[1],但重型或危重型患者,尤其是合并有高血壓、糖尿病等基礎疾病的患者或老年人病死率較高[2-6],因其分型不同而病情差異較大,治療措施也不盡相同,因此早期評估COVID-19病情嚴重程度及預測患者發生死亡的風險顯得尤為重要。本研究收集108例COVID-19住院患者的臨床資料、全血細胞計數及網織紅細胞(Ret)5項參數的結果,以此來探討未成熟Ret比率(IRF)在評估COVID-19患者預后的臨床價值及變化,為評估COVID-19患者死亡風險提供依據。
1 資料與方法
1.1一般資料 選取本院2020年1月23日至3月31日收治的108例COVID-19住院患者為研究對象(病例組),其中男47例、女61例,年齡23~92歲、平均(62.42±14.80)歲。健康對照組57例均為體檢中心查體健康人員,男26例、女31例,年齡35~82歲、平均(61.40±9.43)歲。兩組研究對象性別比例、年齡比較,差異無統計學意義(P>0.05),具有可比性。所有COVID-19病例均根據《新型冠狀病毒肺炎診療方案(試行第七版)》[7]確診。COVID-19疑似病例同時具備以下病原學或血清學證據之一者可確診:(1)呼吸道標本或者血液標本實時熒光RT-PCR檢測新型冠狀病毒核酸陽性;(2)呼吸道標本或者血液標本病毒基因測序結果,與已知的新型冠狀病毒高度同源;(3)血清新型冠狀病毒特異性IgM抗體和IgG抗體陽性;血清新型冠狀病毒特異性IgG抗體由陰性轉為陽性或恢復期較急性期4倍及以上升高。臨床分型:根據《新型冠狀病毒肺炎診療方案(試行第七版)》[7]進行臨床分型。輕型:臨床癥狀輕微,影像學未見肺炎表現;普通型:具有發熱、呼吸道感染等癥狀,影像學可見肺炎表現;重型:符合下列任何1條,(1)呼吸窘迫,呼吸頻率≥30次/分鐘;(2)靜息狀態下,指氧飽和度≤93%;(3)動脈血氧分壓/吸氧濃度≤300 mm Hg。危重型:符合以下情況之一者,(1)出現呼吸衰竭,且需要機械通氣;(2)出現休克;(3)合并其他器官功能衰竭需進入ICU監護治療。
1.2方法 所有患者及對照組抽取EDTA-K2抗凝全血2 mL進行外周血全血細胞計數及Ret計數檢測。全血細胞計數及分類采用Mindray CAI8000自動血細胞分析儀及其配套的試劑進行檢測。各指標參考范圍如下。紅細胞計數(RBC):男(4.3~5.8)×1012/L;女(3.8~5.1)×1012/L。血紅蛋白(Hb):男130~175 g/L;女115~150 g/L。血細胞比容(HCT):男40%~50%;女35%~45%。平均紅細胞體積(MCV)82~100 fL。平均紅細胞血紅蛋白量(MCH)27~34 pg。平均紅細胞血紅蛋白濃度(MCHC)346~354 g/L。Ret絕對值計數(Ret#)0.02~0.20。Ret百分數(Ret%)0.3%~3.0%。高熒光強度網織紅細胞比率(HFR)0.0%~5.0%。中熒光強度網織紅細胞比率(MFR)0.0%~20.0%。低熒光強度網織紅細胞比率(LFR)80.0%~100.0%。IRF 0.0%~25.0%。
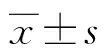
2 結 果
2.1病例組與健康對照組臨床資料、全血細胞計數及Ret的比較 與健康對照組相比,病例組患者MCV、Ret#、Ret%、HFR、MFR、IRF均顯著增高(P<0.05); RBC、Hb、HCT、MCHC、LFR均顯著降低(P<0.05);而MCH差異無統計學意義(P>0.05)。見表1。

表1 病例組與健康對照組臨床資料、全血細胞計數及Ret水平的比較
2.2不同臨床分型COVID-19患者各指標比較 根據相關標準,輕型/普通型組、重型組、危重型組分別有62、23、23例;Ret%、IFR、HFR、MFR水平在輕型/普通型組、重型組、危重型組中依次增高,而LFR水平在輕型/普通型組、重型組、危重型組依次降低,差異有統計學意義(P<0.05),見表2。

表2 輕型/普通型、重型、危重型組間各指標比較[%,M(P25,P75)]
2.3COVID-19患者生存組和死亡組的Ret各參數結果比較 按照臨床結局的不同,將COVID-19患者分為生存組和死亡組,兩組Ret#差異無統計學意義(P>0.05);而死亡組的Ret%、HFR、MFR、IFR均明顯高于生存組,LFR明顯低于生存組,差異有統計學意義(P<0.05)。見表3。

表3 死亡組、生存組間Ret#、Ret%、HFR、MFR、LFR、IRF結果比較[M(P25,P75)]
2.4IRF對COVID-19的診斷效能分析 ROC曲線分析結果顯示,IRF診斷COVID-19生存情況的曲線下面積(AUC)為0.774(95%CI:0.66~0.89),Cut-off值為7.90%時,預測的靈敏度為80.0%,特異度為73.6%。
3 討 論
Ret是介于晚幼紅細胞和成熟紅細胞之間的尚未完全成熟的紅細胞,是反映骨髓造血功能的重要指標之一[8],當被活體染色劑(如NMB)染色時,含能被染色的核酸(細胞內RNA)或與特定的核酸結合且被熒光劑染色時,顯示細胞內增高的熒光強度[9]。基于流式細胞術及熒光染色原理,將Ret分為HFR、MFR、LFR共3種類型,其中HFR、MFR稱為未成熟Ret,細胞質中殘存的RNA較多,而IRF已成為骨髓和造血干細胞移植及化療后骨髓再生的早期標志物[10-11]。本研究結果顯示,病例組的RBC、Hb、HCT、MCHC、LFR均低于健康對照組(P<0.05);MCV、Ret#、Ret%、HFR、MFR、IRF均高于健康對照組(P<0.05)。當外周血IRF增高時,間接反映骨髓紅系造血被抑制,出現貧血或貧血加重,從而導致RBC、Hb、HCT降低。與此同時,機體及時做出反應,使得紅系代償性增生,生成更多的未成熟Ret釋放到外周血,經歷24 h變為成熟的紅細胞,滿足機體需要[12]。而部分患者的Ret#和Ret%變化不明顯,僅IRF增高,并且HFR和MFR與其變化的趨勢相同,說明IRF的靈敏度比Ret#和Ret%更高,因此IRF反映了最新從骨髓釋放入外周血的紅細胞數量,是評價紅細胞生成活性的早期敏感指標,且不受機體某些狀態的干擾。
本研究分析發現,COVID-19死亡組的IRF明顯高于生存組,差異有統計學意義(P<0.05),ROC曲線分析結果顯示,IRF的AUC為0.774,Cut-off值為7.90%,此時預測COVID-19患者發生死亡結局的靈敏度為80.0%,特異度為73.6%,提示IRF水平升高可以作為一個獨立的預后因子預測COVID-19患者的死亡風險,對IRF>7.90%的患者,及時做出判斷和有效干預是改善臨床轉歸的關鍵。
COVID-19患者死亡時IRF升高的具體機制目前還不明確,但本研究發現,COVID-19死亡組患者Ret%、HFR、MFR明顯高于生存組,而LFR低于生存組,差異有統計學意義(P<0.05)。當機體感染病原體后,引起體液中迅速大量產生多種細胞因子,這些細胞因子是重要的信號,可以幫助調動免疫細胞,從而將病原體從體內清除出去;當過度刺激免疫系統時,機體過度反應,誘發“炎癥風暴”[13]。COVID-19患者出現“炎癥風暴”時,是感染者從輕癥向重癥和危重癥轉變的一個重要節點,同時也是重癥和危重癥患者死亡的一個原因,釋放的各種炎癥因子影響骨髓功能、鐵代謝及紅細胞生成障礙,使得體積大的新生Ret進入外周血循環中[14],提示死亡組患者HFR、MFR的增高導致了IRF水平的增高,IRF水平變化只與骨髓狀態有關,不受外周血紅細胞及Hb的影響,這進一步解釋了COVID-19患者死亡風險與IRF水平之間存在的關聯。部分肺部感染的患者會出現胸悶、呼吸困難等癥狀,當機體處于慢性缺氧時,機體的代償能力可使骨髓造血系統受到的刺激并不顯著,患者Ret和IRF升高并不明顯,但當感染等因素導致患者病情加重,缺氧程度加劇時,患者的組織及器官嚴重供氧不足,由此導致骨髓造血系統大量生成紅細胞,以提高血液供氧能力,骨髓造血明顯增強,故對外周血Ret進行測定,可以對患者組織缺氧的狀態及其發生、發展的趨勢進行評估,對診斷隱匿性缺氧提供臨床判斷依據[15]。生理情況下,體內促紅細胞生成素(EPO)水平維持恒定;當機體出現貧血或其他原因導致腎臟氧氣供應減少時,在缺氧誘導因子的刺激下,EPO分泌增加,刺激紅細胞增殖并分化成熟[16-17],治療過程中使用EPO類藥物也會引起外周血IRF水平的增高。
COVID-19的發生、發展是一個復雜的過程,涉及炎癥因子、組織缺氧、骨髓造血等多方面的影響。本研究為單中心的回顧性臨床研究,COVID-19患者入院時間不同、臨床治療不同及存在的其他基礎性疾病都可能造成Ret測定時間的不一致性,從而引起Ret的差異。因此,需要進行多中心、大樣本量的臨床研究來探討IRF水平增高的原因及機制,以便于臨床醫生評估COVID-19患者發生死亡的風險,從而降低COVID-19患者的病死率。