LncRNA MEG3表達(dá)量與脂多糖誘導(dǎo)支氣管上皮細(xì)胞增殖及凋亡和炎癥因子分泌的關(guān)系*
何秀 張碧清 劉春花
(1.郴州市第一人民醫(yī)院兒科,湖南 郴州 423000;2.郴州市第一人民醫(yī)院兒童醫(yī)院兒童呼吸科,湖南 郴州 423000)
支氣管哮喘屬于慢性氣道炎癥類疾病之一,支氣管上皮細(xì)胞損傷在支氣管哮喘發(fā)生過(guò)程中發(fā)揮重要作用[1-2]。既往研究顯示支氣管上皮細(xì)胞釋放出炎性因子可引發(fā)機(jī)體炎癥反應(yīng)從而造成損傷[3]。目前支氣管哮喘發(fā)病機(jī)制尚未闡明,因而從支氣管上皮細(xì)胞角度出發(fā)探究支氣管哮喘發(fā)病機(jī)制具有重要意義。長(zhǎng)鏈非編碼RNA母系表達(dá)基因3(Long non-coding RNA MEG3,LncRNA MEG3)表達(dá)水平降低可增強(qiáng)脂多糖(lipopolysacharide,LPS)誘導(dǎo)的肺細(xì)胞損傷[4]。但MEG3在支氣管哮喘發(fā)生過(guò)程中的調(diào)控機(jī)制尚未闡明。研究表明LPS作為一種促炎因子可用于炎癥性疾病的體外研究[5-7]。本研究分析LPS對(duì)支氣管上皮細(xì)胞增殖、凋亡及炎癥因子分泌的影響,探討干擾MEG3表達(dá)或MEG3過(guò)表達(dá)對(duì)LPS誘導(dǎo)的支氣管上皮細(xì)胞增殖、凋亡及炎癥因子分泌的影響,為支氣管哮喘發(fā)病機(jī)制奠定理論基礎(chǔ)。
1 材料與方法
1.1 材料與試劑 人支氣管上皮細(xì)胞16HBE購(gòu)自美國(guó)ATCC細(xì)胞庫(kù);杜氏改良培養(yǎng)基(DMEM)、胎牛血清均購(gòu)自美國(guó)HyClone公司;膜聯(lián)蛋白V(Annexin V)-異硫氰酸熒光素(FITC)/碘化丙啶(Propidium Iodide,PI)細(xì)胞凋亡試劑盒購(gòu)自美國(guó)BD公司;白細(xì)胞介素-8(interleukin-8,IL-8)與白細(xì)胞介素-1β(interleukin-1β,IL-1β)酶聯(lián)免疫吸附(ELISA)試劑盒購(gòu)自南京建成生物工程有限公司;脂多糖(LPS)與甲基噻唑基四唑(MTT)購(gòu)自美國(guó)Sigma公司;Lipofectamine2000、Triol試劑盒、反轉(zhuǎn)錄試劑盒與實(shí)時(shí)熒光定量檢測(cè)試劑盒均購(gòu)自美國(guó)Invitrogen公司;二喹啉甲酸(BCA)蛋白定量檢測(cè)試劑盒購(gòu)自湖南艾佳生物科技股份有限公司;十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)上樣緩沖液購(gòu)自福因德科技(武漢)有限公司;MEG3小干擾RNA(si-MEG3)、亂序無(wú)意義陰性序列(si-con)購(gòu)自廣州銳博生物科技有限公司;pcDNA3.1購(gòu)自上海柯雷生物科技有限公司;兔抗人活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved caspase-3)、活化的含半胱氨酸的天冬氨酸蛋白水解酶9(Cleaved caspase-9)、細(xì)胞周期蛋白1(CyclinD1)抗體購(gòu)自美國(guó)Cell Signaling Technology公司;辣根過(guò)氧化物酶(HRP)標(biāo)記的山羊抗兔IgG二抗購(gòu)自北京中杉金橋生物技術(shù)有限公司。
1.2 方法
1.2.1 LPS處理與實(shí)驗(yàn)分組 預(yù)先配置含有10%胎牛血清與100 U/mL青霉素與100 μg/mL鏈霉素的DMEM培養(yǎng)基,將支氣管上皮細(xì)胞16HBE置于培養(yǎng)基中進(jìn)行培養(yǎng),培養(yǎng)條件:37 ℃、體積分?jǐn)?shù)5%CO2培養(yǎng)箱,待單層細(xì)胞覆蓋率達(dá)到90%時(shí)進(jìn)行傳代培養(yǎng)。取對(duì)數(shù)生長(zhǎng)期支氣管上皮細(xì)胞,用50 μg/mL的LPS處理細(xì)胞24 h[8]作為L(zhǎng)PS組,正常培養(yǎng)的細(xì)胞作為NC組。分別將si-MEG3、si-con、pcDNA-MEG3、pcDNA轉(zhuǎn)染至支氣管上皮細(xì)胞48 h,隨后使用50 μg/mL的LPS處理細(xì)胞24 h,分別命名為L(zhǎng)PS+si-MEG3組、LPS+si-con組、LPS+pcDNA-MEG3組、LPS+pcDNA組,轉(zhuǎn)染過(guò)程參照Lipofectamine2000試劑說(shuō)明書進(jìn)行操作,收集細(xì)胞進(jìn)行后續(xù)研究。
1.2.2 ELISA檢測(cè)IL-8、IL-1β濃度 收集各組細(xì)胞培養(yǎng)上清液,依據(jù)ELISA檢測(cè)試劑盒檢測(cè)IL-8、IL-1β水平,嚴(yán)格按照試劑盒說(shuō)明書進(jìn)行操作。
1.2.3 MTT檢測(cè)細(xì)胞增殖率 取NC組、LPS組、LPS+si-con組、LPS+si-MEG3組、LPS+pcDNA組、LPS+pcDNA-MEG3組支氣管上皮細(xì)胞,0.25%胰蛋白酶消化,制備單細(xì)胞懸液,調(diào)整細(xì)胞密度至3×104個(gè)/mL,取100 μL細(xì)胞懸液接種于96孔板,各組設(shè)置3個(gè)復(fù)孔,培養(yǎng)48 h后每孔加入20 μL質(zhì)量濃度為5 mg/mL的MTT溶液,室溫孵育4 h,12000 r/min轉(zhuǎn)速離心5 min,棄上清,每孔加入150 μL二甲基亞砜(dimethylsulfoxide,DMSO),放入振蕩儀勻速振蕩10 min,應(yīng)用酶標(biāo)儀檢測(cè)波長(zhǎng)為490 nm處各孔吸光度值(OD),計(jì)算各組細(xì)胞增殖率[(實(shí)驗(yàn)組OD值-對(duì)照組OD值)/對(duì)照組OD值×100%],實(shí)驗(yàn)重復(fù)3次。
1.2.4 流式細(xì)胞術(shù)檢測(cè)細(xì)胞凋亡率 收集NC組、LPS組、LPS+si-con組、LPS+si-MEG3組、LPS+pcDNA組、LPS+pcDNA-MEG3組支氣管上皮細(xì)胞,0.25%胰蛋白酶消化,1000 r/min轉(zhuǎn)速離心6 min,棄上清,PBS清洗,加入500 μL結(jié)合緩沖液,加入5 μL Annexin V-FITC與5 μL PI,室溫避光孵育10 min,應(yīng)用流式細(xì)胞儀檢測(cè)細(xì)胞凋亡率。
1.2.5 實(shí)時(shí)熒光定量聚合酶鏈反應(yīng)(qRT-PCR)檢測(cè)細(xì)胞中MEG3的表達(dá)水平 收集各組支氣管上皮細(xì)胞,采用Trizol法提取細(xì)胞總RNA,應(yīng)用Nanodrop2000c超微量分光光度計(jì)測(cè)定RNA濃度,根據(jù)反轉(zhuǎn)錄試劑盒將RNA反轉(zhuǎn)錄合成cDNA。MEG3正向引物5′-GGGCTTCTGGAATGAGCA TG-3′,反向引物:5′-TCTATGCCAGATCCTGCCT G3′;β-actin正向引物5′-TGCTGTCCCTGTATGCC TCT-3′,反向引物:5′-TGATGTCACGCACGATT T-3′,引物由上海生工生物工程股份有限公司設(shè)計(jì)合成。qRT-PCR反應(yīng)體系:SYBR Premix Ex Taq Ⅱ(2×)10 μL,cDNA 2 μL,上下游引物各0.8 μL,ROX Reference Dye(50×)0.4 μL,RNase-Free ddH2O補(bǔ)足體系至20 μL;反應(yīng)條件:95℃ 2 min(循環(huán)1次),95℃ 30 s,60℃30 s,72℃ 30 s(循環(huán)40次),MEG3以β-actin為內(nèi)參,采用2-ΔΔCt法計(jì)算MEG3的相對(duì)表達(dá)量。
1.2.6 蛋白免疫印跡(Western blot)檢測(cè)Cleaved caspase-3、Cleaved caspase-9、CyclinD1蛋白表達(dá) 收集各組支氣管上皮細(xì)胞,加入RIPA裂解液,冰浴30 min,離心(4 ℃,1000 r/min,10 min),提取細(xì)胞總蛋白,采用BCA法測(cè)定蛋白濃度,取30 μg蛋白上樣量加入SDS上樣緩沖液,沸水中煮10 min。取蛋白樣品進(jìn)行SDS-PAGE反應(yīng),將電泳產(chǎn)物轉(zhuǎn)移至PVDF膜,5%脫脂奶粉封閉2 h,4 ℃條件下孵育一抗稀釋液(24 h),TBST洗滌,孵育二抗稀釋液,室溫孵育1 h,TBST洗滌,曝光,顯影,應(yīng)用ImageJ軟件分析各條帶灰度值。
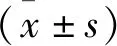
2 結(jié)果
2.1 LPS誘導(dǎo)支氣管上皮細(xì)胞炎癥反應(yīng)和抑制增殖的作用 與NC組相比,LPS組支氣管上皮細(xì)胞中炎癥因子IL-8、IL-1β水平均明顯升高(P<0.05),細(xì)胞增殖率顯著降低(P<0.05),CyclinD1蛋白相對(duì)表達(dá)量顯著降低(P<0.05),見(jiàn)圖1、表1。

圖1 Western blot檢測(cè)支氣管上皮細(xì)胞CyclinD1蛋白表達(dá)Figure 1 Western blot detection of CyclinD1 protein expression in bronchial epithelial cells
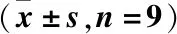
表1 LPS誘導(dǎo)支氣管上皮細(xì)胞炎癥因子IL-8和IL-1β分泌及抑制增殖的作用Table 1 Effects of LPS on the secretion of inflammatory factors IL-8 and IL-1β in bronchial epithelial cells and inhibition of proliferation
2.2 LPS誘導(dǎo)支氣管上皮細(xì)胞凋亡 相較于NC組,LPS組支氣管上皮細(xì)胞凋亡率顯著升高(P<0.05),Cleaved caspase-3、Cleaved caspase-9蛋白相對(duì)表達(dá)量顯著升高(P<0.05),見(jiàn)圖2、表2。

圖2 Western blot檢測(cè)支氣管上皮細(xì)胞Cleaved caspase-3和Cleaved caspase-9蛋白表達(dá)及流式細(xì)胞術(shù)檢測(cè)細(xì)胞凋亡率Figure 2 Western blot detection of Cleaved caspase-3 and Cleaved caspase-9 protein expression in bronchial epithelial cells and flow cytometry to detect the apoptosis rate
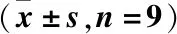
表2 LPS誘導(dǎo)支氣管上皮細(xì)胞凋亡及上調(diào)Cleaved caspase-3和Cleaved caspase-9蛋白Table 2 LPS-induced bronchial epithelial cell apoptosis and up-regulated Cleaved caspase-3 and Cleaved caspase-9 proteins
2.3 LPS抑制支氣管上皮細(xì)胞MEG3表達(dá) LPS組MEG3的表達(dá)水平(0.42±0.06)較NC組(0.97±0.05)顯著降低(P<0.05)。
2.4 干擾MEG3加重LPS誘導(dǎo)支氣管上皮細(xì)胞凋亡和抑制增殖的作用 與LPS+si-con組相比,LPS+si-MEG3組支氣管上皮細(xì)胞中MEG3的表達(dá)水平顯著降低(P<0.05),提示成功降低支氣管上皮細(xì)胞中MEG3的表達(dá);相比于LPS+si-con組,LPS+si-MEG3組支氣管上皮細(xì)胞中IL-8、IL-1β水平、細(xì)胞凋亡率、Cleaved caspase-3、Cleaved caspase-9蛋白相對(duì)表達(dá)量均顯著升高(P<0.05),細(xì)胞增殖率、CyclinD1蛋白相對(duì)表達(dá)量均顯著降低(P<0.05),見(jiàn)圖3、表3。

圖3 Western blot檢測(cè)支氣管上皮細(xì)胞CyclinD1、Cleaved caspase-3和Cleaved caspase-9蛋白表達(dá)及流式細(xì)胞術(shù)檢測(cè)細(xì)胞凋亡率Figure 3 Western blot detection of cyclinD1,cleaved caspase-3,and cleaved caspase-9 protein expression in bronchial epithelial cells and detection of apoptosis rate by flow cytometry
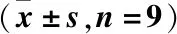
表3 沉默MEG3和LPS誘導(dǎo)對(duì)支氣管上皮細(xì)胞炎癥因子IL-8和IL-1β分泌、細(xì)胞增殖及細(xì)胞凋亡的作用Table 3 Effects of silent MEG3 and LPS induction on the secretion of inflammatory factors IL-8 and IL-1β,cell proliferation and apoptosis in bronchial epithelial cells
2.5 過(guò)表達(dá)MEG3部分逆轉(zhuǎn)LPS誘導(dǎo)支氣管上皮細(xì)胞凋亡和抑制增殖的作用 與LPS+pcDNA組相比,LPS+pcDNA-MEG3組支氣管上皮細(xì)胞中MEG3的表達(dá)水平、細(xì)胞增殖率、CyclinD1蛋白相對(duì)表達(dá)量均顯著升高(P<0.05),IL-8、IL-1β水平、細(xì)胞凋亡率、Cleaved caspase-3、Cleaved caspase-9蛋白相對(duì)表達(dá)量均顯著降低(P<0.05),見(jiàn)圖4、表4。
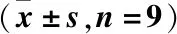
表4 過(guò)表達(dá)MEG3和LPS誘導(dǎo)對(duì)支氣管上皮細(xì)胞炎癥因子IL-8和IL-1β分泌、細(xì)胞增殖及細(xì)胞凋亡的作用Table 4 Effects of overexpression of MEG3 and LPS on the secretion of inflammatory factors IL-8 and IL-1β,cell proliferation and apoptosis in bronchial epithelial cells

圖4 Western blot檢測(cè)支氣管上皮細(xì)胞CyclinD1、Cleaved caspase-3和Cleaved caspase-9蛋白表達(dá)及流式細(xì)胞術(shù)檢測(cè)細(xì)胞凋亡率Figure 4 Western blot detection of cyclinD1,cleaved caspase-3,and cleaved caspase-9 protein expression in bronchial epithelial cells and flow cytometry to detect the apoptosis rate
3 討論
LncRNA在支氣管上皮細(xì)胞惡性轉(zhuǎn)化過(guò)程中發(fā)揮重要作用,但關(guān)于其具體作用機(jī)制尚未完全闡明[9-11]。研究表明LPS可誘導(dǎo)支氣管上皮細(xì)胞構(gòu)建炎癥模型[12-13]。因而本研究主要探尋新型LncRNA并分析其對(duì)LPS誘導(dǎo)的支氣管上皮細(xì)胞炎癥損傷的影響。
本研究結(jié)果顯示LPS處理后支氣管上皮細(xì)胞炎癥因子 IL-8、IL-1β生成量均顯著升高,與鄭輝等[14]報(bào)道相似,提示LPS誘導(dǎo)的支氣管上皮細(xì)胞炎癥損傷模型構(gòu)建成功,LPS誘導(dǎo)后支氣管上皮細(xì)胞增殖率顯著降低,細(xì)胞凋亡率顯著升高,提示LPS可通過(guò)抑制支氣管上皮細(xì)胞增殖及促進(jìn)細(xì)胞凋亡從而造成細(xì)胞損傷。研究表明CyclinD1表達(dá)量升高可促進(jìn)細(xì)胞周期由G1期進(jìn)入S期,促進(jìn)細(xì)胞增殖[15]。Cleaved caspase-3、Cleaved caspase-9表達(dá)量升高可誘導(dǎo)細(xì)胞凋亡[16]。本研究結(jié)果顯示LPS誘導(dǎo)的支氣管上皮細(xì)胞中Cleaved caspase-3、Cleaved caspase-9蛋白表達(dá)水平顯著升高,CyclinD1蛋白表達(dá)水平顯著降低,提示LPS對(duì)支氣管上皮細(xì)胞增殖及凋亡的作用機(jī)制可能與上調(diào)Cleaved caspase-3、Cleaved caspase-9表達(dá)及下調(diào)CyclinD1表達(dá)有關(guān)。
MEG3在骨性關(guān)節(jié)炎患者軟骨組織中呈低表達(dá)并可能通過(guò)調(diào)控血管生成從而參與骨性關(guān)節(jié)炎發(fā)生及發(fā)展過(guò)程[17]。研究表明MEG3在冠狀動(dòng)脈粥樣硬化中呈低表達(dá)并可能參與心血管疾病發(fā)生及發(fā)展過(guò)程[18]。相關(guān)報(bào)道指出MEG3在急性髓系白血病骨髓中表達(dá)下調(diào)并可能作為急性髓系白血病患者預(yù)后不良的重要標(biāo)志物[19]。但MEG3對(duì)LPS誘導(dǎo)的支氣管上皮細(xì)胞炎癥損傷的影響尚未可知。本研究結(jié)果顯示LPS誘導(dǎo)的支氣管上皮細(xì)胞中MEG3表達(dá)下調(diào),干擾MEG3表達(dá)后可明顯促進(jìn)LPS誘導(dǎo)的支氣管上皮細(xì)胞凋亡,抑制細(xì)胞增殖,增加IL-8、IL-1β生成量,促進(jìn)Cleaved caspase-3、Cleaved caspase-9蛋白表達(dá),抑制CyclinD1蛋白表達(dá),提示干擾MEG3表達(dá)可加重LPS誘導(dǎo)的支氣管上皮細(xì)胞損傷;MEG3過(guò)表達(dá)后可抑制LPS誘導(dǎo)的支氣管上皮細(xì)胞凋亡,促進(jìn)細(xì)胞增殖,降低IL-8、IL-1β生成量,Cleaved caspase-3、Cleaved caspase-9蛋白表達(dá)下調(diào),CyclinD1蛋白表達(dá)上調(diào),說(shuō)明MEG3過(guò)表達(dá)可逆轉(zhuǎn)LPS誘導(dǎo)支氣管上皮細(xì)胞凋亡及抑制增殖的作用。提示MEG3過(guò)表達(dá)可減輕LPS誘導(dǎo)的支氣管上皮細(xì)胞損傷。
4 結(jié)論
MEG3過(guò)表達(dá)可促進(jìn)LPS誘導(dǎo)支氣管上皮細(xì)胞增殖,抑制細(xì)胞凋亡,減輕炎癥反應(yīng)。
- 西部醫(yī)學(xué)的其它文章
- 衰弱綜合征與老年肺炎相關(guān)性及臨床干預(yù)策略*
- 我國(guó)臨床醫(yī)生對(duì)慢性阻塞性肺疾病認(rèn)知現(xiàn)狀與應(yīng)對(duì)策略*
- 2020年撰寫各期專家述評(píng)、指南與共識(shí)解讀的執(zhí)行編委及參與定稿會(huì)和審稿的專家名錄
- 《西部醫(yī)學(xué)》2020年版“中國(guó)科技核心期刊”收錄證書
- 墻式浮標(biāo)氧氣吸入器不同傾斜角度引起患者誤吸的相關(guān)性*
- 血清相關(guān)炎癥因子表達(dá)水平與老年膝關(guān)節(jié)骨性關(guān)節(jié)炎病情嚴(yán)重程度的相關(guān)性*

