櫛孔扇貝(Chlamys farreri)過氧化物酶體增殖物激活受體基因的鑒定與表達分析*
隋明益 楊祖晶 于海濤 彭 程 邢 強, 黃曉婷, ① 胡景杰, 包振民, ,
(1. 中國海洋大學海洋生物遺傳學與育種教育部重點實驗室 青島 266003; 2. 青島海洋科學與技術試點國家實驗室海洋漁業科學與食物產出過程功能實驗室 青島 266237; 3. 中國海洋大學三亞海洋研究院熱帶海洋生物種質資源開發與種業工程實驗室 三亞 572000)
過氧化物酶體(peroxisome, P)是單膜包裹的細胞器, 在真核生物細胞中普遍存在, 參與眾多代謝途徑如長鏈脂肪酸的β 氧化, 過氧化氫的解毒還有醚磷脂和膽汁酸的合成等(Honsho et al, 2016)。過氧化物酶體能夠在結構各異的化學物質作用下發生增殖, 形成過氧化物酶體增殖物(peroxisome proliferator, PP)。過氧化物酶體增殖物激活受體(peroxisome proliferator-activated receptors, PPARs)是一類配體激活的核轉錄因子家族, 屬于核激素受體超家族, 能夠被內源性脂肪酸或者外源性過氧化物酶體增殖物作為配體激活(Glass et al, 2006; 陳亮, 2011)。1990 年,PPARs 首先在嚙齒動物中發現(Tyagi et al, 2011)。脊椎動物的 PPARs 包含 3 種亞型: PPARα, PPARβ/δ 和PPARγ, 它們均包含五個功能域, 其中 N 端的 A、B結構域為激活功能域1(activation function 1, AF1), 不同亞型的A、B 區域在結構上高度可變, 并不保守, 它的激活并不依賴于配體的存在, 主要是通過磷酸化的作用來調節配體和受體之間的親和力用以調節PPARs 的活性; C 區域為高度保守的 DNA 結合域(DNA-binding domain, DBD), 由兩個鋅指結構折疊成球狀, 保守性較高, 通過與類視黃醇 X 受體(retinoid X receptor, RXR)組成異源二聚體, 然后與靶基因啟動子中的過氧化物酶體增殖物反應元件(PPAR response elements, PPREs)結合, 進而調節靶基因的轉錄; D 區域為鉸鏈區, 連接 DNA 結合區域和配體結合區域; E/F 區域位于 C 末端, 為配體結合區(ligand binding domain, LBD), 通過識別結合配體,在信號轉導過程中發揮重要作用, 該區域氨基酸序列的差異使各PPAR 亞型分別對不同配體產生親和力(Desvergne et al, 1999; Glass et al, 2006; 寧麗軍,2016; Bervejillo et al, 2019)。PPARs 的靶基因在脂肪代謝與能量平衡、細胞分化、炎癥反應中具有重要作用(Glass et al, 2006; Menendez-Gutierrez et al, 2012;Wang et al, 2019)。脊椎動物的 PPARα 和 PPARβ 能夠激活脂肪分解代謝相關的酶, 參與線粒體的 β-氧化反應, 而PPARγ 控制脂肪的積累并且能夠調節脂肪形成(Dreyer et al, 1992; 寧麗軍等, 2019; 趙亭亭等, 2020)。臨床研究表明, PPARs 在許多生理與病理過程中發揮關鍵作用, 特別是與葡萄糖和脂質代謝、炎癥反應相關的疾病(Glass et al, 2006)。另外, PPARs 活化后能夠改善許多中樞神經退行性疾病如阿爾茲海默癥、帕金森病、多發性硬化病、肌萎縮側索硬化癥以及中樞神經系統急慢性損傷的病理過程(施丹莉等, 2018)。
櫛孔扇貝(Chlamys farreri)主要分布于我國北部、韓國和日本沿海, 是我國傳統的經濟養殖貝類(Waller, 1992)。近年來隨著我國扇貝養殖規模的不斷擴大, 養殖密度過高、環境污染加劇等導致養殖個體生長緩慢、產品品質下降、病害加劇等問題, 對產業造成了嚴重的打擊(王運濤等, 1999; Xiao et al, 2005;李成林等, 2011; 楊彩霞等, 2013; 孫瑜等, 2014)。扇貝中含有較為豐富的脂肪酸, 尤其是高度不飽和脂肪酸含量豐富, 是決定扇貝產品品質的重要因素之一(Dong, 2001; 樓喬明等, 2012; Xu et al, 2015;Wright et al, 2018)。過氧化物酶體增殖物激活受體PPARs 家族在脊椎動物脂肪代謝中發揮重要的調節功能, 但扇貝中是否存在著與脊椎動物類似的PPARs調控通路仍未可知, 扇貝脂質代謝的調控機制仍鮮有研究。本研究利用生物信息學方法鑒定櫛孔扇貝PPARs 基因, 預測其編碼蛋白的結構與功能, 并探究其時空表達模式, 研究結果對于揭示貝類脂質代謝調控機理以及優良扇貝品種的培育提供參考。
1 材料與方法
1.1 研究材料
通過NCBI(National Center for Biotechnology Information)網站(https://www.ncbi.nlm.nih.gov/guide/proteins/) 查找并下載多物種PPARs蛋白序列, 獲得包括脊椎動物, 如人(Homo sapiens)、小鼠(Mus musculus)、原雞(Gallus gallus)、斑馬魚(Danio rerio)、爪蟾(Xenopus laevis), 和無脊椎動物, 如仿刺參(Apostichopus japonicus)、紫海膽(Strongylocentrotus purpuratus)、美洲牡蠣(Crassostrea virginica)等(表1)。
1.2 方法
1.2.1 櫛孔扇貝PPAR基因的鑒定 利用實驗室的SSH(Secure Shell Client)平臺, 將獲得的同源序列導入服務器, 命令為blastall-p blastp-i Z.txt-d CF.pep.fao hsp90zCF -e 1e-5 -v 40 -b 20 -a 5 -m 8初步篩選獲得備選的櫛孔扇貝PPARs基因蛋白序列。通過NCBI數據庫進行反向BLAST 比對(https://blast.ncbi.nlm.nih.gov/Blast.cgi), SMART(http://smart.embl.de/)和NCBI Conserved Domain (https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi?RID=HA6KDEF8015&mode=all)網站進行同源性和蛋白質結構域分析, 確定櫛孔扇貝的PPAR基因。
1.2.2 櫛孔扇貝PPAR基因與蛋白結構分析 利用生物信息學的方法分析櫛孔扇貝PPAR基因結構、預測蛋白質結構和功能, 具體包括: 利用基因組文庫的注釋信息獲得PPARs的基因結構。通過ProtParam程序(http://web.expasy.org/protparam/)獲得蛋白質分子量MW及等電點pI信息。通過Geneious4.8.4 (http://www.geneious.com/)預測蛋白質的二級結構。利用Protein Homology/analogY Recognition Engine V 2.0(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?) 程序預測蛋白質三級結構信息, 數據導入VMD1.9.3軟件構建三維結構圖。利用德泰生物信息學在線網站預測有無信號肽(http://www.detaibio.com/tools/signalpeptide.html)和跨膜結構域(http://www.detaibio.com/tools/transmembrane.html)。
1.2.3 PPARs家族序列比對與系統發生分析 多序列比對采用線上工具Clustal Omega (https://www.ebi.ac.uk/Tools/msa/clustalo/)。利用MEGA7.0軟件對PPARs蛋白序列基于相鄰連接法(Neighbor-Joining,NJ)構建系統發生樹, Bootstrap 值設置為1000。DBD和LBD序列比對圖使用GENEDOC軟件繪制。

表1 用于分析的其他物種PPARs 蛋白質GenBank 號Tab.1 The Accession numbers of PPARs in other species used in this study
1.2.4 櫛孔扇貝PPAR基因時空表達分析 利用實驗室已發表的櫛孔扇貝轉錄組數據(Li et al, 2017), 獲得在胚胎幼蟲發育時期包括受精卵, 2-8細胞, 囊胚期,原腸期, 擔輪幼蟲, D型幼蟲, 殼頂幼蟲前期、中期和后期, 眼點幼蟲和稚貝時期; 成體組織包括外套膜、眼、鰓絲、橫紋肌、平滑肌、足、肝胰腺、腎臟、血細胞和性腺的CfPPAR-like基因表達量, 表達水平由RPKM(Reads Per Kilobase per Million mapped read)表示, 利用GraphPad Prism v8.0.2.263軟件繪制柱狀圖。
2 結果
2.1 櫛孔扇貝中PPAR 基因鑒定與蛋白序列特征
從櫛孔扇貝基因組和轉錄組中鑒定出1個PPAR基因, 命名為CfPPAR-like, 表2統計CfPPAR-like基因的序列特征。CfPPAR-like基因全長1604 bp, 包含9個外顯子和8個內含子(圖1), 編碼486個氨基酸, 開放閱讀框長度為1572, 理論分子量MW為54305.3 Da,等電點pI為8.3。櫛孔扇貝PPAR蛋白質二級結構如圖2所示, 包含21個α螺旋, 29個β折疊, 33個卷曲和36個轉角。預測的蛋白質三級結構顯示(圖3), CfPPAR-like蛋白包含PPARs家族5個功能域, DBD功能域和LBD功能域分別位于兩個明顯不同的區域。利用德泰生物信息學在線工具預測結果顯示櫛孔扇貝PPAR蛋白不含跨膜區和信號肽, 屬于膜內蛋白。

表2 櫛孔扇貝PPAR 基因的序列特征Tab.2 Characteristics of the PPAR gene of Chlamys farreri

圖1 CfPPAR-like 基因結構Fig.1 Structure of gene CfPPAR-like
2.2 PPARs 家族蛋白質序列比對和系統發生
利用 Clustal Omega 對 CfPPAR-like 蛋白與在NCBI 數據庫中篩查到的其他物種的PPARs 蛋白序列進行多序列比對, DBD 區域和LBD 區域序列比對結果如圖4 所示, 可以看出, DBD 結構域非常保守, 種間氨基酸相似度范圍在49.40%—96.43%, 而LBD 結構域變異程度較大, 氨基酸相似度范圍在14.66%—96.04%。
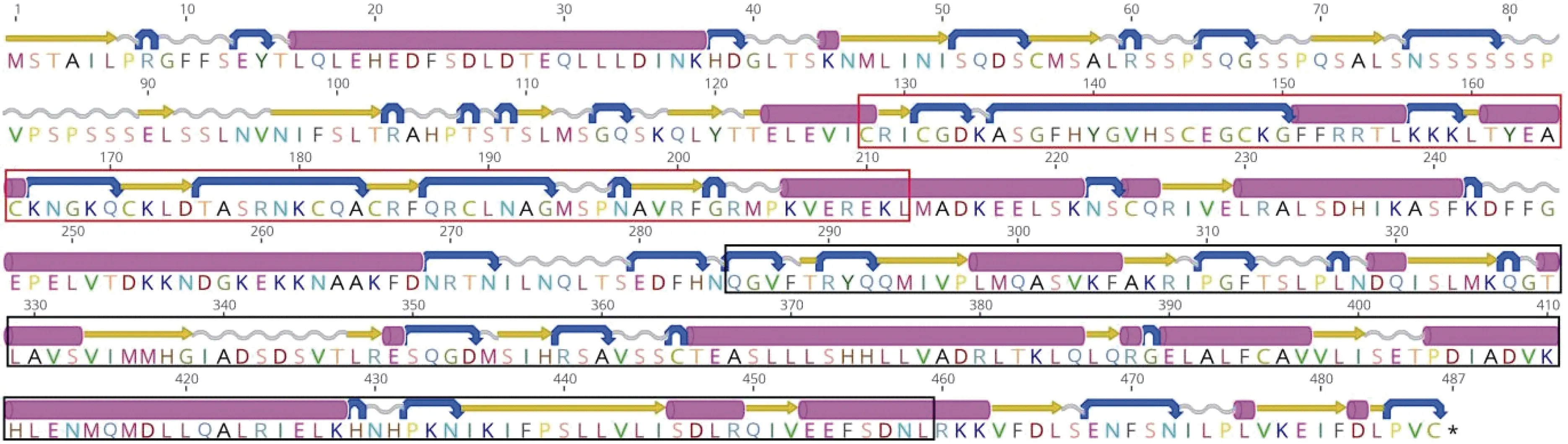
圖2 CfPPAR-like 蛋白二級結構Fig.2 The secondary structures of CfPPAR-like protein
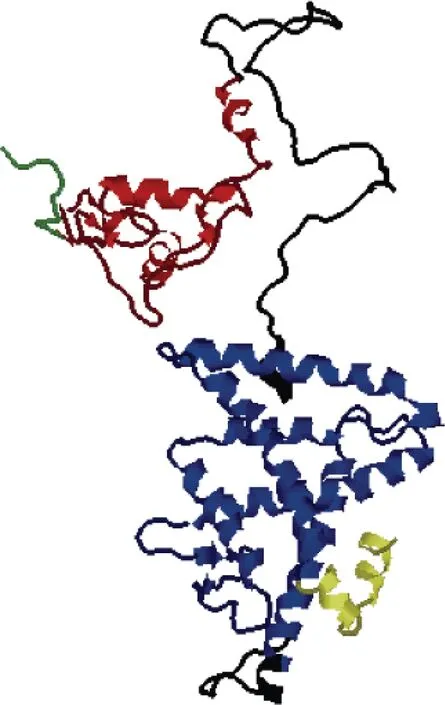
圖3 CfPPAR-like 蛋白質三級結構預測圖Fig.3 Prediction of the tertiary structure of CfPPAR-like protein
利用鄰近相位法(NJ 法)對CfPPAR-like 蛋白和其他物種PPARs 蛋白序列構建系統發生樹(圖5), PPARs家族成員主要聚為三個亞支, 脊椎動物的 PPARs 家族的三種亞型分別聚類后聚為單獨亞支, 三種亞型上, PPARα 和 PPARβ 兩種亞型同源性較高先聚在一起, 后與PPARγ 聚在一起。無脊椎動物中, 棘皮動物聚為一支, 軟體動物聚為一支, 果蠅與線蟲的 PPAR基因同源物E75B 和nhr-23 聚在進化樹的最外端。
2.3 櫛孔扇貝PPAR 基因的時空表達
CfPPAR-like 在櫛孔扇貝胚胎和幼蟲發育時期的表達主要經歷了三個階段(圖 6), 首先在受精卵至原腸期表達量先升高后下降, 在2-8 細胞期表達量達到最高水平, 此時期細胞分裂旺盛, 表明 CfPPAR-like參與扇貝胚胎發育早期的細胞分裂; 第二階段為原腸期至殼頂幼蟲時期, 在 D 型幼蟲表達量再次升高,暗示其可能在扇貝貝殼的形成過程中發揮作用; 最后一個階段包含眼點幼蟲和稚貝時期, CfPPAR-like在這兩個時期保持較高的表達水平, 表明 CfPPAR-like參與扇貝幼蟲附著變態發育為稚貝的這一重要過程。

圖5 基于櫛孔扇貝與其他物種PPARs 蛋白序列構建的系統發生樹Fig.5 The phylogenetic tree constructed based on the PPARs protein sequences of C.farreri and other species
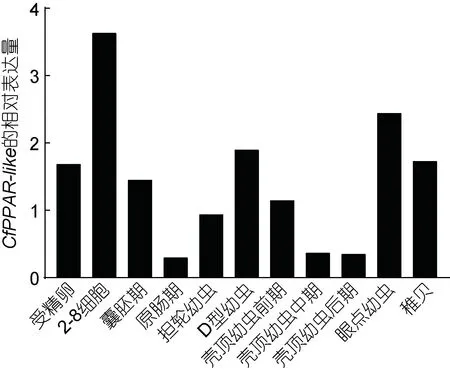
圖6 CfPPAR-like 在櫛孔扇貝各個發育時期中的表達量Fig.6 Expression levels of CfPPAR-like during developmental stages
CfPPAR-like 在櫛孔扇貝成體各組織中均有表達(圖 7)。腎臟組織中表達量最高, 其次是雄性性腺、消化腺和雌性性腺, 眼、鰓絲、外套膜、平滑肌和足中有少量表達, 橫紋肌和血細胞中微量表達。
3 討論
眾多研究都表明 PPARs 是調節機體脂質代謝的重要樞紐, 在調控畜禽機體肝臟脂質代謝、魚類脂肪酸 β-氧化等方面具有重要作用 (寧麗軍, 2016; 王朝陽等, 2018; 寧麗軍等, 2019)。目前, 對無脊椎動物
PPARs 的研究相對較少。扇貝作為我國的重要經濟貝類, 不飽和脂肪酸是干貝品質的重要因素, 探究
PPARs 對扇貝脂肪代謝的調控機制具有重要意義。本研究利用已發表的櫛孔扇貝基因組與轉錄組數據,
獲得櫛孔扇貝 CfPPAR-like 基因, 并分析其基因與蛋白結構信息, 同時分析了櫛孔扇貝 CfPPAR-like 基因在胚胎幼蟲各發育時期和成體各組織中的表達模式,
以期為貝類脂質代謝機制研究提供參考。
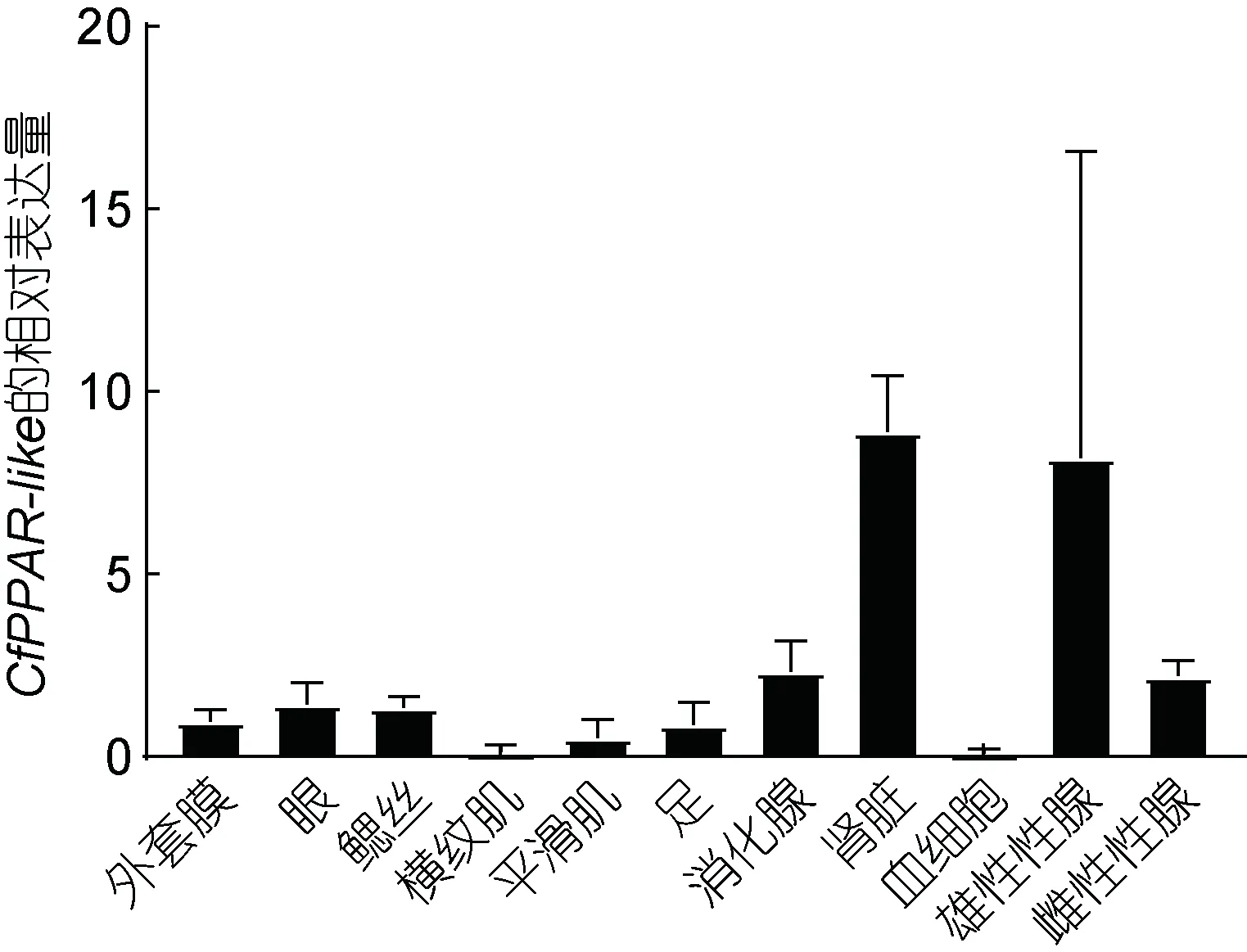
圖7 CfPPAR-like 在櫛孔扇貝不同組織中的表達量Fig.7 Expression levels of CfPPAR-like in different tissues
相比脊椎動物 PPARs 家族具有PPARα, PPARβ/δ和 PPARγ 三種亞型, 櫛孔扇貝基因組中僅鑒定出一個PPAR 基因。已有線蟲和果蠅核激素受體家族的研究指出, 線蟲和果蠅等蛻皮動物中并沒有PPAR 基因,僅存在PPAR 基因的同源物E75B 和nhr-23(Maglich et al, 2001; Hong et al, 2010)。通過對櫛孔扇貝和其他物種的PPAR 結構域DBD 和LBD 的蛋白多序列比對發現, 相較于LBD 的高變異性, 所有物種DBD 保守性較高。PPAR 結構域在脊椎動物與無脊椎動物之間差異較大, 如 DBD 的第 23-24、36、58-59、79、91-92和94-95 位上共10 個氨基酸位點在脊椎動物中完全保守, 而在無脊椎動物中存在變異, 而 LBD 序列中104-290 這段序列上脊椎動物之間的相似性更高, 在無脊椎動物中存在較高變異度。系統發生樹的結果表明三種脊椎動物的 PPARs 亞型分別聚類后再與無脊椎動物的PPAR 聚類, 而果蠅和線蟲的PPAR 同源物E75B 和nhr-23 位于進化樹的最外端, 支持PPAR 所屬的核激素受體超家族經歷兩次演化, 第一次是后生動物出現早期產生了核激素受體各種家族(如 PPAR、RAR 等), 第二次在脊椎動物進化早期產生了各種亞型(如 alpha, delta 和 gamma 等)(Escriva et al, 2000)。
從時空表達上看, CfPPAR-like 基因在胚胎幼蟲的發育時期主要分為三個階段, 在2-8 細胞期、D 型幼蟲、眼點幼蟲和稚貝均保持較高的表達水平, 這些時期均為扇貝幼蟲發育的關鍵時期, 暗示CfPPAR-like 在扇貝早期細胞分裂、貝殼形成、幼蟲附著變態等方面發揮重要作用。在牛、人和小鼠胚胎中均發現 PPARs 不同亞型的表達, 其中 PPARδ 和PPARγ 通過對脂質、碳水化合物和氨基酸代謝的影響,促進胚胎著床和胎盤發育,所產生的代謝物可作為胎兒能量代謝、細胞膜合成和信號分子的底物(Bogacka et al, 2015)。從組織表達上來看, CfPPAR-like 基因在所有扇貝組織中普遍表達, 在腎臟、性腺和消化腺中表達量較高, 表明 CfPPAR-like 同時在扇貝的脂肪代謝和生殖等過程中發揮重要功能。已有研究表明PPAR 基因的表達具有一定的物種特異性, 例如人、小鼠等哺乳動物的 PPARs 基因主要在脂肪細胞中高表達, 草魚、大黃魚PPARs 基因主要在肝臟中大量表達, 團頭魴 PPARα 基因主要在肌肉、肝臟中高表達,而虹鱒的PPARα 主要在脂肪組織中表達(Meng et al,2005; 孔路軍等, 2006; 周旋等, 2009; 陳亮, 2011;高俊等, 2016; 趙亭亭等, 2020), 這些高表達的PPARs 基因在動物脂類代謝和脂肪酸β 氧化等過程中具有重要作用。另外, 所有PPAR 亞型均在不同物種(嚙齒動物、綿羊、奶牛、豬、兔子、水牛和人類)的卵巢中表達, 主要發揮包括卵巢組織的重塑、類固醇的生成等功能, 其中 PPARγ 相較于其他類型作用研究 更 為 廣 泛 (Bogacka et al, 2015) 。 團 頭 魴(Megalobrama amblycephala)PPARα 在精巢和卵巢中都有表達, 而且在精巢中的表達量比卵巢更高, 暗示其參與了生殖細胞的成熟過程(Zhao et al, 2011)。
4 結論
本研究獲得了櫛孔扇貝 PPAR 基因 CfPPAR-like全長 ORF 序列, 進化分析和蛋白分析結果表明CfPPAR-like 包含保守結構域DBD 和LBD, 多序列比對結果表明DBD 保守性較高, 而LBD 具有較高的多樣性, 進化樹結果支持PPAR 所屬的核激素受體超家族在脊椎動物進化早期出現了各亞型這一假說。櫛孔扇貝 CfPPAR-like 主要在 2-8 細胞、D 型幼蟲、眼點幼蟲和稚貝時期高表達, 成體組織中性腺、消化腺和腎臟中表達量較高。研究結果對揭示PPAR 基因在貝類脂肪代謝中的調控機制以及優良扇貝品種的選育提供參考。

