運用希浦傳導系統解剖指導傳導束起搏定位
蔣麗夢 蘇藍 黃偉劍
2000年Deshmukh等[1]首次報告了永久性希氏束起搏,2017年黃偉劍等[2]首次提出了左束支起搏的概念,不同部位的精確起搏對術者提出更高的要求:需要熟知房室結區、希氏束和左束支解剖分布特點及其變異。本文從既往研究中總結、分析希浦傳導系統的解剖特點以及與傳導系統病變發生的關系,以期更好地指導希浦傳導系統起搏,提高手術成功率,減少手術相關并發癥。
1 房室結區
人房室結位于由冠狀竇、Todaro肌腱和三尖瓣圍成的Koch三角內[3],長5~7 mm、寬2~5 mm,是心臟激動從心房傳導到心室的正常路徑。房室結呈一側稍平的雙凸透鏡狀結構,位于中央纖維體的右側,冠狀竇口的前上方,房間隔右側的心內膜下,界限清楚,向前延伸形成希氏束,向后形成結后延伸部[4]。見圖1。房室結的血供主要來源于右冠狀動脈。
2 希氏束
既往文獻報道,希氏束平均長1.8 cm,平均直徑3~5 mm,由穿透部分和分支部分組成。穿透部分由房室結延續而來,穿過中央纖維體,到達室間隔頂部,長約20 mm,呈線性結構,毗鄰室間隔膜部、中央纖維體、二尖瓣環、三尖瓣隔瓣[5-6]。分支部分位于室間隔的頂部,長5~10 mm,呈細長線形結構,在左側間隔表面向下和稍向前走行一段距離后發出左右束支。Massing等[7]發現大多數人的希氏束走行在左側室間隔,即“左側型”;僅少數為穿行于右側室間隔室上嵴的“右側型”,這可能影響到延續的左束支近端在室間隔的分布。
Kawashima等[4]報道了105例人體解剖結果,根據希氏束在右側室間隔內膜下的深度,存在3種解剖分型:Ⅰ、Ⅱ、Ⅲ型。Ⅰ型(46.7%):希氏束位于室間隔膜部,與房室結大小相近,由一層薄的結締組織包裹,容易與周圍的心肌明確區分。Ⅱ型(32.3%):希氏束穿行于室間隔的肌部,遠離室間隔膜部的下緣,形態、邊界難以與周圍心肌區分。Ⅲ型(21.0%):該型為裸露的希氏束,走行于室間隔膜部。因這一類型希氏束直接位于心內膜下,位置比較表淺,所以其結構可以被更清楚地識別。Ⅱ型的希氏束走行深入心內膜下,可以解釋部分患者不容易標測到希氏束電位的原因。
關于希氏束內的傳導纖維縱向排列理論,早在1976年由Massing等[7]提出,即左右束支在希氏束主干中提前分化,并且彼此分隔,即縱向分離學說[8-9]。Sharma等[10]使用光學和電子顯微鏡進行的觀察發現,希氏束大部分由最終進入左束支的細胞組成,這些細胞被膠原纖維縱向分割,可以減少甚至阻止橫向激動的擴散;同時,具有特殊細胞間連接的分隔組織可以促進快速縱向傳導:這些發現提示了左右束支在希氏束層面的縱向分離。在1例希氏束起搏聯合房室結消融的病例中也證實了解剖分離的電生理現象(圖2),由于左右束支在希氏束內的解剖分離,消融前起搏奪獲左側傳導系統,左束支逆行激動右束支近端,右束支再順行傳導,因此起搏QRS呈正常形態;而消融阻斷電極近端逆傳后,改變不同輸出電壓時起搏形態始終呈右束支傳導阻滯圖形。
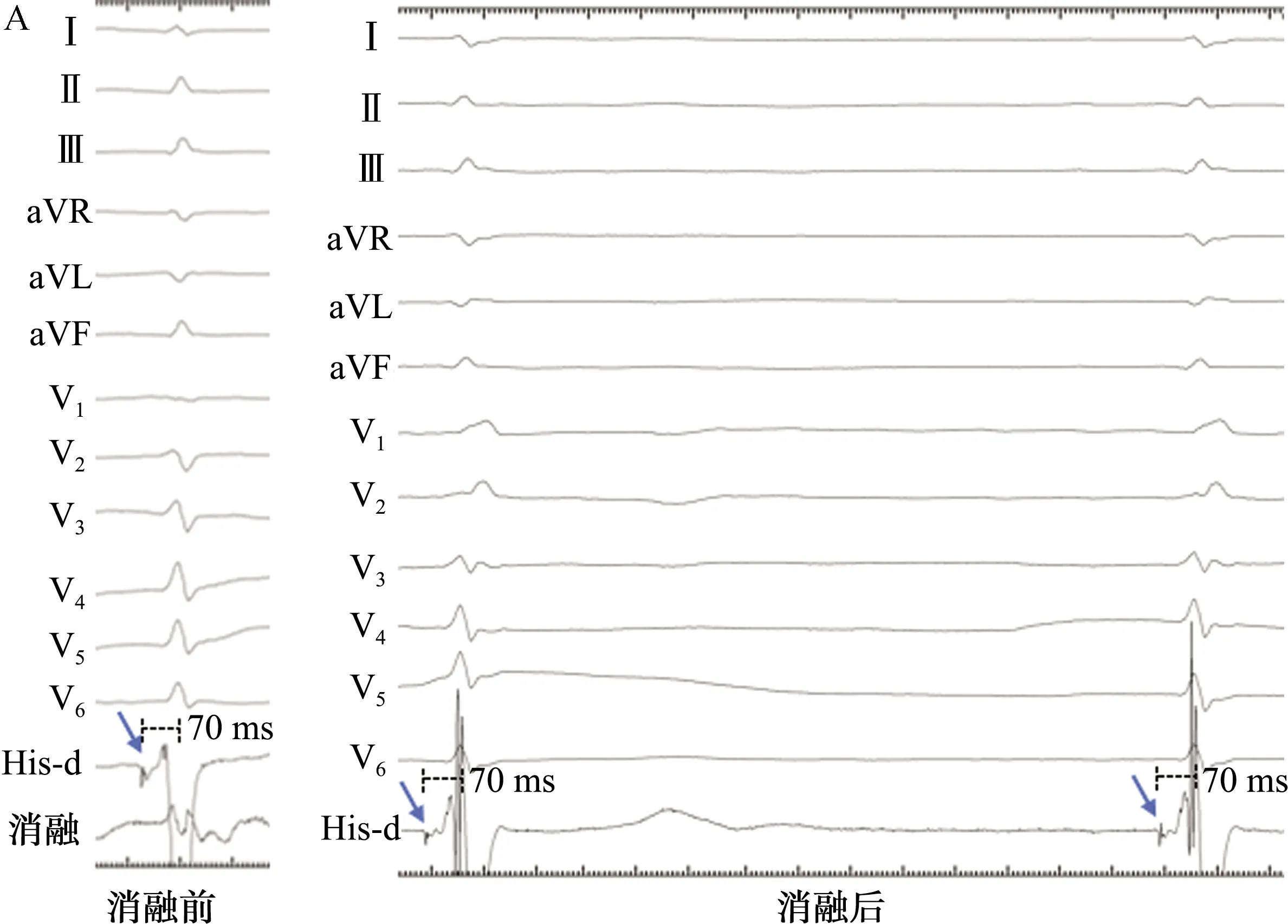
His-d: 希氏束遠端電極; AVN:房室結; HB: 希氏束;RBB:右束支;LAF: 左前分支;LPF:左后分支。
3 左束支近端
左束支起源于冠狀動脈竇部之間的希氏束分叉部。它的主干及分支的近端穿室間隔肌部,在室間隔膜部頂端以下約15 mm處開始出現在心內膜下,呈帶狀結構,并在心內膜下向下和稍向前延伸,經過很短的距離后發出一個細長的前束和一個較寬的后束,分別指向前乳頭肌和后乳頭肌[11]。
左束支最大的解剖特點是變異性大。既往研究認為左束支在起始段狹窄逐漸變寬[11],在Mas-sing等[7]的研究中,左束支近端直徑粗細不一,從小于1 mm到14 mm不等,長度在26~45 mm。左束支起始段大都是狹窄的,即使在一些“左側希氏束”的心臟中,左束支起始部分的寬度也只有2~3 mm。心內膜下心肌和膠原纖維覆蓋部分近端左束支,當左束支沿著室間隔從基底部向心尖部走行時,左束支及其分支開始逐漸變寬,覆蓋左束支的心肌和膠原纖維逐漸減少,即隨著左束支沿室間隔越向遠端延伸,左束支在心內膜的位置就越表淺。
左束支分支的數量、位置、大小及走行個體差異較大,并且不可預測,通常可見二分叉型、三分叉型及網狀分布型,以網狀分布型最多見。有的左束支有幾個左前分支,每個分支分別起源于左束支主干;而有的只有一個左前分支,再由這個左前分支分出其他亞分支;一些左束支,其主干發出后可長達20 mm或更長而沒有繼續分支。各分支遠端由纖維連接在整個左心室腔內,形成復雜的心內膜下浦肯野纖維網。這較好地解釋了為什么左束支的一個分支發生阻滯時不會影響整個QRS波群的寬度[6]。
4 解剖與傳導阻滯的關系
房室結毗鄰二尖瓣前瓣、三尖瓣隔瓣、冠狀竇等結構,希氏束與左束支近端毗鄰室間隔膜部、中央纖維體、二尖瓣環、三尖瓣隔瓣,容易受到這些部位病變(如瓣膜的鈣化等)的影響而發生傳導阻滯[12]。研究發現主動脈瓣狹窄患者的傳導阻滯發生率為26%~90%,與主動脈瓣是否鈣化及鈣化的程度密切相關[13-14]。Dhingra等[15]也發現了類似的結果,在主動脈瓣狹窄患者中出現房室傳導阻滯和室內傳導阻滯的患者都伴隨不同程度的主動脈瓣鈣化。
對于起始部分比較窄的左束支,其鄰近結構的一些微小病變就可以引起左束支的完全性傳導阻滯。對于呈網狀分布的左束支,在微小損傷時則可以通過廣泛的纖維連接進行電活動的傳遞,因而相對不容易發生完全性傳導阻滯[16]。左束支從希氏束發出位置的變異也與傳導阻滯相關[12]——發出分支的位置越早,其近端就越易受到瓣環等毗鄰結構病變的影響而發生完全性左束支傳導阻滯。Massing等[7]觀察到在右側希氏束的人群中,其左束支的起源往往比較窄,加之左束支由右向左穿過室間隔,走行距離比較長,因此容易發生左束支傳導阻滯。
5 希浦傳導系統起搏的電生理標測意義
5.1 指導起搏電極的精確定位
在希浦傳導系統起搏術中,清晰了解希氏束的解剖位置可幫助術者快速縮小定位范圍,只有將傳導束電位標測和起搏標測結合起來,才能實現精確定位。標測記錄到希氏束或左、右束支電位,往往意味著起搏電極接近傳導束所在區域,起搏狀態下結合體表心電圖和腔內圖QRS形態的改變來判斷是否成功奪獲相應傳導束,并通過測試閾值等參數判斷電極位置是否滿意。偏房側的希氏束電極通常定位于三尖瓣瓣環的房側,電極頭端未跨越瓣環。房側希氏束起搏容易出現感知異常(包括交叉和遠場感知)、奪獲心室內膜的閾值偏高等缺陷。理論上偏室側的希氏束起搏更有解剖優勢,可以獲得更理想的起搏參數,包括良好的心室感知和備份心室起搏閾值。
5.2 記錄左束支電位
并不是所有患者都能夠記錄到傳導束電位,如在完全性左束支傳導阻滯患者中,左束支區域通常不能標測到左束支電位,可通過希氏束起搏恢復左束支傳導、出現窄QRS或右束支傳導阻滯形態的逸搏時記錄到左束支電位(圖3)。
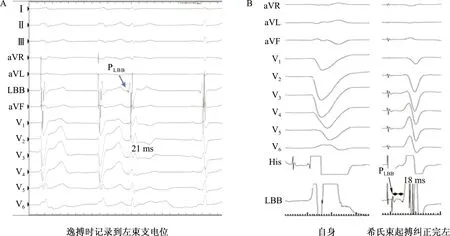
A:左束支傳導阻滯時,常規方法不能記錄到提前于V波的左束支電位,逸搏時可以記錄到左束支電位;B:在完全性左束支傳導阻滯時,通過希氏束起搏可以糾正完全性左束支傳導阻滯,此時腔內圖上記錄到位于V波前的左束支電位,PV間期為18 ms;PLBB:左束支電位。
5.3 明確傳導阻滯的發生部位
希氏束電位標測可以明確傳導束阻滯位置,指導起搏電極跨越傳導阻滯位點放置以保證遠期安全性(圖3)。對于存在房室傳導阻滯的患者,希氏束電極腔內圖可記錄希氏束電位、遠場心房波(A波)和心室波(V波);AH間期延長或A波后希氏束電位脫落提示阻滯部位在房室結;而HV間期延長或希氏束到心室的傳導脫落提示阻滯部位在房室結以下,部分病例可見希氏束電位分裂成兩個部分,提示阻滯發生在希氏束內。見圖4。
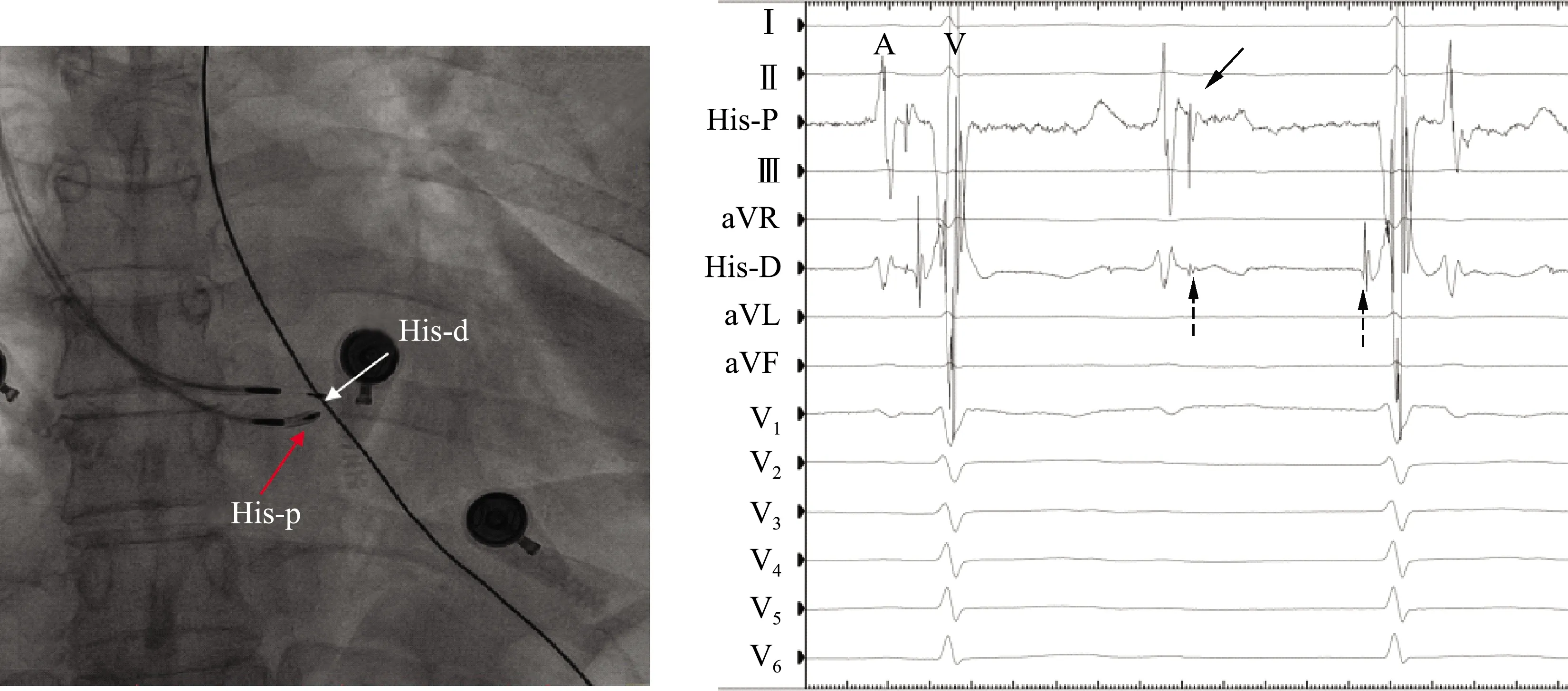
A:兩根3830導線電極分別放置在希氏束近端和遠端,圖中標記為His-p和His-d;B:希氏束電極的腔內圖可見遠場的心房波(A波)和心室波(V波);在His-d上記錄到希氏束電位分裂,證實阻滯部位在希氏束內,HV間期正常并以1 ∶1傳導,證實遠端電極跨越了傳導阻滯部位。(實箭頭指示希氏束電位,虛箭頭指示希氏束電位分裂為近、遠端兩個電位)
6 傳導束解剖在希浦傳導系統起搏中的價值
6.1 選擇性和非選擇性希氏束起搏
有學者研究了選擇性希氏束起搏(selective His-bundle pacing, S-HBP)和非選擇性希氏束起搏(nonselective HBP,NS-HBP)與希氏束解剖結構的關系[8,17-18]。Ⅲ型“裸”希氏束直接走行于心內膜下,位置表淺,容易實現S-HBP。Ⅱ型希氏束穿行于室間隔的肌部,周圍有較多的膠原纖維覆蓋,形態、邊界與周圍心肌難以區分,起搏奪獲希氏束的同時可能激動鄰近的心肌而實現NS-HBP。此外,能否實現S-HBP也與電極位置有關。房側希氏束起搏可能需要較高的閾值才能實現奪獲,并且容易發生交叉和遠場感知。
6.2 右束支損傷
右束支由希氏束發出,呈直徑1~2 mm的細長結構,在右室間隔面心內膜下向心尖部走行,直至到達右心室前外側乳頭肌。在Massing等[7]研究的32個心臟中,右束支在室間隔中始終是一個狹窄無分支的結構。由于右束支具有這種解剖特點,因此在左束支起搏過程中,右束支近端容易受損[19]。
6.3 室間隔穿孔
室間隔穿孔是左束支起搏較常見的術中并發癥,由于導線是通過穿間隔途徑放置在室間隔左室面,且左束支走行于室間隔左室面心內膜下較淺的位置,因此如何避免術中及術后室間隔穿孔、減少電極重置是術者需要關注的問題。既往的研究發現,隨著左束支發出后沿著室間隔越向心尖部走行,其在室間隔左室面心內膜下的位置就越淺表[7,16,20]。在左束支起搏過程中,如果起搏位點在左束支遠端,為實現傳導束奪獲,需將起搏電極更靠近內膜下,那么發生室間隔穿孔的概率就可能升高,因此從安全性角度建議選擇左束支近端起搏。
6.4 室間隔動脈的損傷
左束支起搏術中冠脈損傷目前僅有極少數個案報道,但仍是需要關注的問題。室間隔穿支動脈是供應室間隔深部的動脈[21],起搏電極在穿室間隔的過程中,理論上有損傷室間隔穿支血管的風險。室間隔除主要由室間前動脈供血外,室間隔下動脈、斜動脈、旋動脈,甚至左冠狀動脈主干均可發出間隔穿支到室間隔深部,術中難以避免因電極損傷微小動脈分支導致的間隔血腫,建議在術中減少間隔擰入次數并密切觀察術中胸痛癥狀。
一些特殊基礎疾病,如肥厚型心肌病、外科手術醫源性損傷、室缺等先天性心臟病關系到希氏束及左束支起搏能否成功,術前須充分評估。
7 總結
希浦傳導系統解剖存在個體差異性,不同患者傳導系統基礎病變和起搏的適應證各不相同。在生理性起搏的過程中,通過深入掌握解剖結構、靈活運用電生理標測指導植入,可以提高手術的成功率并減少并發癥的發生。

