濕法解毒技術對鉻渣污染土壤的修復效果研究
周斌*,石燕,邵煜錕,楊流,劉子琳,葛一陳
(永清環保股份有限公司,長沙 410330)
自20 世紀50 年代起,我國陸續建設了70 余家重鉻酸鈉化工企業,由于當時生產工藝落后,生產每噸鉻鹽產品要排放2.5 t 甚至3t 高毒性鉻渣,鉻渣的無序堆存以及不正確處置造成鉻鹽生產場地土壤受到嚴重污染[1]。鉻渣中Cr(Ⅵ) 的存在形式主要有易溶的四水鉻酸鈉,稍溶的鉻酸鈣,微溶的鉻鋁酸鈣、堿式鉻酸鐵、化學吸附的Cr(Ⅵ),難溶的硅酸二鈣-鉻酸鈣固溶體、鐵鋁酸鈣-鉻酸鈣固溶體[2]。以固溶體形式存在于硅酸二鈣、鐵鋁酸鈣晶格內的Cr(Ⅵ),需要強酸破壞晶格后才能溶出。因此,常規還原穩定化技術無法有效處理鉻渣混合污染土壤。
濕法解毒是將鉻渣磨細浸解,酸溶性和水溶性的Cr(Ⅵ)在還原劑的作用下被還原成Cr(Ⅲ)。我國早在20世紀60年代就開始了鉻渣綜合治理的研究工作,已形成的濕法解毒方法包括無鈣鉻渣濕法解毒和硫酸亞鐵濕法解毒等[3]。張淑玲等[4]利用硫酸亞鐵濕法解毒工藝處理河南新密鉻渣,規模化運行處理后的鉻渣可完全達到一般工業固廢填埋標準的控制要求。劉曦[5]用硫酸亞鐵解毒無鈣焙燒鉻渣經水選分離后的細渣,確定較佳工藝條件為加入理論量180%的FeSO4,不加酸,反應溫度50℃,處理時間2h,在此條件下解毒后的總Cr 和Cr(Ⅵ)浸出濃度均小于0.5mg/L。Wangxin 等[6]采用FeSO4和H2SO4處理鉻渣,養護400d后,Cr(Ⅵ)浸出濃度滿足《鉻渣污染治理環境保護技術規范(暫行)》(HJ/T 301—2007)的要求,即Cr(Ⅵ)浸出濃度<1.5mg/L,說明采用FeSO4-H2SO4濕法解毒鉻渣具有較好的穩定性。朱文會等[7]以我國某鉻鹽廠的鉻渣污染土壤為研究對象,探討了淋洗、穩定化、濕法解毒3 種異位修復工藝去除鉻渣污染土壤中總 Cr 和 Cr(Ⅵ)的效果,實驗結果表明,3 種異位修復工藝對鉻污染土壤中Cr(Ⅵ)的去除效果為:濕法解毒>穩定化>淋洗,濕法解毒工藝對土壤中Cr(Ⅵ)的去除率高達 83.26%~92.94%,研究還發現土壤粒徑越細,越有利于濕法解毒工藝對土壤中Cr(Ⅵ)的去除或還原[8]。
前期研究結果表明,濕法解毒工藝對鉻渣中Cr(Ⅵ)的還原和穩定效果較好,但將其應用于鉻渣污染土壤的研究相對較少。當前濕法解毒工藝產生的上清液需進入下端水處理系統處置,工藝較繁瑣。本文以鉻渣污染土壤為研究對象,探究濕法解毒技術對鉻渣污染土壤的修復效果及其影響因素。
1 材料與方法
1.1 供試土壤
供試土壤為甘肅某鉻鹽廠場地表層土壤(0~20cm),呈綠色,土壤經自然風干后,去除碎石和植物殘體,研磨過160 目篩,進行濕法解毒技術試驗研究。供試土壤污染情況見表1。

表1 供試土壤污染情況
1.2 實驗試劑
研究所用的濃硫酸為質量分數為98%的優級純;FeSO4為含量大于99.5%的七水合硫酸亞鐵,是生產鈦白粉時的工業級副產品 (藍色晶體顆粒);氫氧化鈣為含量大于90%的分工業級產品(白色粉末)。指標分析測定所需試劑(氯化鎂、磷酸二氫鉀、磷酸氫二鉀、二苯并碳酰二肼、重鉻酸鉀等)均為優級純(國藥)。
1.3 實驗方法
1.3.1 硫酸亞鐵添加量的確定
FeSO4反應速率快、價格低廉,一直是鉻渣濕法解毒、鉻污染土壤異位穩定化的主要藥劑[7],因此本文選取FeSO4作為濕法解毒的還原劑。根據下式,將20gCr(Ⅵ)含量為16 641mg/kg 的試驗土壤中的Cr(Ⅵ)全部還原為Cr(Ⅲ),所需FeSO4的1 倍理論劑量約為5.4g,對應質量添加比為27%;所需FeSO4的1.5 倍理論劑量約為8g,對應質量添加比為40%。
Cr6++3Fe2+→Cr3++3Fe3+
1.3.2 濕法解毒技術的效果研究
濕法解毒:稱取20g 樣品,按照表2,用純水分別將0.54g 和0.8g 濃硫酸稀釋至60mL,分別加入待處理土壤樣品中,翻轉振蕩2h(轉速為30±2r/min),靜置30min,測定上清液pH 值,然后添加FeSO4,翻轉振蕩2h,靜置30min,測定上清液pH 值,每個處理設置3 組重復(T1~T6),結果以平均值體現。
沉淀工藝:在濕法解毒處理后的溶液體系中,選擇T2、T4 和T6 添加土壤質量比為0.8%的氫氧化鈣,翻轉振蕩2h 后,靜置30min,上清液置于真空抽濾機中抽濾,以上處理設置3 組平行。
測定T1~T6 處理上清液的pH 值、總Cr 和Cr(Ⅵ)濃度,過濾后固相土壤根據《固體廢物浸出毒性浸出方法水平振蕩法》(HJ 557—2009)制備浸出液,并測定其總Cr 和Cr(Ⅵ)濃度。此外,測定修復后土壤Cr(Ⅵ)含量。

表2 濕法解毒實驗設計表
1.3.3 硫酸亞鐵對濕法解毒修復效果的影響
稱取20g 樣品,用純水將0.54g 濃硫酸稀釋至60mL,分別加入待處理土壤樣品中,翻轉振蕩2h(轉速為30±2r/min),然后分別添加1 倍、1.2 倍、1.3 倍、1.4 倍和1.5 倍理論劑量的FeSO4,翻轉振蕩2h,添加0.8%的氫氧化鈣,翻轉振蕩2h 后,靜置30min,上清液置于真空抽濾機中抽濾,以上處理設置3 組平行。測定上清液總Cr 和Cr(Ⅵ)濃度,測定過濾后固相土壤總Cr 和Cr(Ⅵ)浸出濃度以及Cr(Ⅵ)含量。
1.4 測定與分析方法
土壤浸出方法參照《固體廢物浸出毒性浸出方法水平振蕩法》(HJ 557—2009),土壤pH 值采用電極法測定(PHS-3C),土水比例為1 ∶10;土壤重金屬采用HNO3-HF-HClO4消解后進入ICP-OES(Thermo iCAP 6300)進行總量濃度測試;采用美國USEPA Method 3060A 堿式消解法對土壤進行預處理,然后采用美國USEPA Method 7196A 分光光度法測試消解液中的Cr(Ⅵ),最終通過質量衡算的方法計算出土壤中的Cr(Ⅵ)濃度[9]。
1.5 數據處理方法
研究中的實驗數據均以平均值表示,利用Excel 2013 和Origin 8.0 軟件對實驗所得數據進行處理和制圖,采用SPSS 18.0 對數據進行相關性和顯著性分析。
2 結果與討論
2.1 濕法解毒技術不同階段上清液pH 值變化情況
從圖1 可以看出,酸化反應結束后,添加2.7%和4%的濃硫酸使上清液pH 值分別顯著降低至5.63~5.88(T1~T4 處理)和4.77~4.87(T5~T6處理),增加1.3%的濃硫酸可使反應溶液pH 值降低約0.9 個單位。王斌遠等[10]研究鉻渣的酸浸出特征時發現,將1kg 鉻渣(平均pH 值為12.7)調節至中性需要1.17L 的濃鹽酸(12mol/L)進行中和。Wangxin 等[6]采用FeSO4-H2SO4處理鉻渣發現,將1kg 鉻渣(平均pH 值為10.93)調節至中性需要添加10molH+,即需要0.28L 的濃硫酸(18mol/L)。本試驗添加質量比為2.7%的濃H2SO4即可將其pH 值調節至5.63~5.88,這可能是由于鉻渣中CaO 和MgO 的含量占比分別可達30.79%和18.45%[4]。還原反應結束后,將T3、T4與T1、T2 對比發現,增加0.5 倍理論劑量FeSO4可使反應溶液pH 值顯著降低0.32~0.41 個單位(P< 0.01)。土壤pH 值顯著降低的原因可能在于Fe2+水解過程中產生的H+會造成土壤酸化[11],而且此次使用的FeSO4為生產鈦白粉的副產品,殘留的硫酸也會降低土壤pH 值。王旌等[12]研究表明添加FeSO4可使Cr 污染土壤pH 值降低,且降幅隨添加比例的增加而增加。將T2、T4、T6 分別與T1、T3、T5 對比可知,添加0.8%的氫氧化鈣可使反應溶液pH 值增加至6.19~6.99,顯著增加3.13~3.34 個單位。
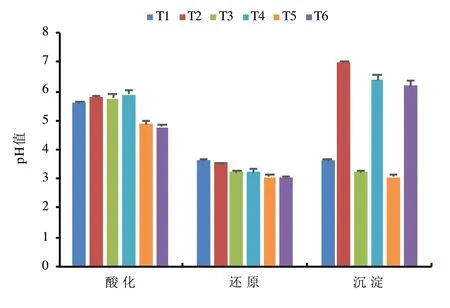
圖1 不同處理對上清液pH 值的影響
2.2 不同濕法解毒工藝條件對鉻渣污染土壤的修復效果
對比T3 和T5 可知,在未添加氫氧化鈣的情況下,增加H2SO4的量可使上清液中總Cr 濃度從337mg/L 顯著增至755mg/L(見圖2a),使土壤總Cr 浸出濃度顯著增加1.15 倍(P < 0.01),但土壤Cr(Ⅵ)含量無顯著變化(見圖2b)。當pH 值小于5 時,浸出液中Al 和Fe 的質量濃度隨著酸量的增加而迅速升高,同時,Cr(Ⅲ)和Cr(Ⅵ)也被迅速釋放出來,這說明賦存鉻的礦物相被溶解[10]。有研究表明[2],鉻渣中以固溶體形式存在于硅酸二鈣、鐵鋁酸鈣晶格內的Cr(Ⅵ),需要強酸破壞晶格后才能溶出,當硫酸調節終點pH 值為6.07 和5.12 時,對應的浸出率分別為94.6%和95.9%。Cr(Ⅵ)在較寬泛的pH 值范圍內都能穩定存在,只是在不同的pH 值和濃度下Cr(Ⅵ)的主要存在形態會存在差異,但不會影響Cr(Ⅵ)的價態[13]。
從圖2 可以看出,對比T1 和T3 可知,增加0.5倍理論劑量FeSO4可使上清液和浸出液Cr(Ⅵ)濃度均降低至0.02mg/L 以下,去除率和穩定化率約為100%,使土壤Cr(Ⅵ)含量從3917mg/kg 降低至68mg/kg,還原率約為98%(見圖2b)。鄒敏敏等[14]采用FeSO4處理電鍍廢水發現,當FeSO4的投加量為理論值的1.5 倍時,廢水中Cr(Ⅵ)的質量濃度達到國家排放標準(< 0.5mg/L)。張曉輝等[15]采用FeSO4處理Cr(Ⅵ)濃度為100mg/L 的廢水時發現,添加2 倍理論劑量的FeSO4對廢水中Cr(Ⅵ)的去除率約為100%。張輝等[16]研究發現,投加FeSO4能夠將土壤中活性大的可交換態和碳酸鹽態鉻轉化為穩定的有機態和殘渣態鉻。另有研究表明,FeSO4對高濃度Cr 污染土壤(2 116~2 365mg/kg)的還原率為80%~99.5%[17,18]。
對比T1 和T2 可知,添加Ca(OH)2可使上清液中Cr和Cr(Ⅵ)濃度分別降低89.9%和87.3%(見圖2a),使土壤浸出液中Cr 和Cr(Ⅵ)濃度分別降低81.0%和78.2%(見圖2b)。對比T3 和T4 以及T5 和T6 可知,添加Ca(OH)2可使浸出液中Cr 濃度從17.2mg/L 以上降低至0.03mg/L 以下,穩定化率大于99.8%,但對土壤Cr(Ⅵ)含量無顯著影響(見圖2c)。研究表明,在還原劑將溶液中Cr(Ⅵ)還原成Cr(Ⅲ)之后,投加氫氧化鈉或石灰等堿性物質,提高pH 值至6.5~8.0,可使Cr(Ⅲ)以Cr(OH)3沉淀形式去除[19]。此外,當pH>6.0 時,溶液中的Cr(Ⅵ)主要以CrO42-的形態存在[19],而此時鉻渣中的Fe 和Al 的氧化物、氫氧化物或羥基氧化物對以CrO42-形式存在的Cr(Ⅵ)有較強的吸附作用[6,10]。
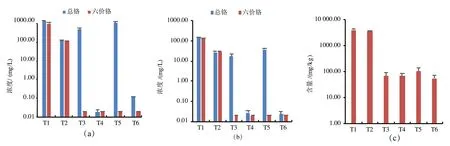
圖2 濕法解毒工藝對上清液(a)、浸出液(b)和土壤(c)中總Cr 或Cr(Ⅵ)含量的影響
綜上,濃硫酸可有效釋放土壤中的總Cr,濕法解毒過程中,FeSO4可將上清液和土壤中的Cr(Ⅵ)還原為Cr(Ⅲ),Ca(OH)2可同時顯著降低上清液和土壤浸出液中的總Cr 和Cr(Ⅵ)濃度。因此,采用濕法解毒技術能實現鉻渣污染土壤和上清液的同步修復。
2.3 硫酸亞鐵理論劑量倍數與六價鉻濃度的線性關系
隨著FeSO4理論劑量的增加,上清液和土壤浸出液中Cr(Ⅵ)濃度顯著降低,且與FeSO4理論劑量倍數呈線性相關,R2adj分別為0.9723 和0.9194(見圖3a、圖3b);土壤中Cr(Ⅵ)含量隨FeSO4理論劑量的增加而顯著降低,且呈線性相關關系,R2adj為0.9108(見圖3c)。張亭亭等[20]研究發現,隨著Fe(Ⅱ)/Cr(Ⅵ)摩爾比的增加,Cr(Ⅵ)的浸出濃度以及穩定土壤中Cr(Ⅵ)含量顯著降低,當摩爾比為3、5、10、20 時,Cr(Ⅵ)的浸出濃度分別約為5mg/L、2mg/L、0.4mg/L、0.05mg/L,Cr(Ⅵ)的含量分別約為130mg/kg、50mg/kg、25mg/kg、4mg/kg。試驗所用的FeSO4明顯高于理論劑量的原因可能在于土壤中含有的錳氧化物等物質將部分FeSO4氧化,這與Bartlett 等學者的研究結果一致[20]。綜上,通過構建FeSO4理論劑量與Cr(VI)濃度的線性關系,可為濕法解毒工程提供參考依據。
3 結語
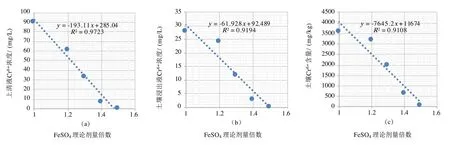
圖3 FeSO4 理論劑量倍數與上清液(a)、浸出液(b)和土壤(c)Cr(Ⅵ)含量的線性關系
土壤中Cr(Ⅵ)浸出濃度和含量隨著FeSO4用量的增加而顯著降低,通過構建FeSO4理論劑量與Cr(VI)濃度的線性關系,可為濕法解毒工程提供參考依據。添加Ca(OH)2可同時顯著降低上清液和浸出液中總Cr 和Cr(Ⅵ)的濃度,與濕法解毒有良好的協同作用。添加0.9%濃硫酸、40%硫酸亞鐵和0.8%Ca(OH)2可將上清液和土壤中Cr 和Cr(Ⅵ)的浸出濃度降低至0.02mg/L 以下,Cr(Ⅵ)含量降低至67mg/kg,說明濕法解毒和沉淀工藝協同作用可在實現鉻渣污染土壤穩定化修復的同時,解決濕法解毒上清液二次處理的問題。

