組織蛋白酶L生物學功能的研究進展
趙國春,裴志花,李曉涵
(1. 吉林農業大學,吉林 長春 130118;2. 動物生產及產品質量安全教育部重點實驗室,吉林 長春 130118)
組織蛋白酶(cathepsin)在1920年由Lanner首次發現,它廣泛存在于動物各種組織細胞內,在維持動物正常生命活動中扮演著重要角色。根據酶的催化機制,組織蛋白酶分為以下4大類:金屬蛋白酶、絲氨酸蛋白酶、天冬氨酸蛋白酶和半胱氨酸蛋白酶。除此之外,還有谷氨酸蛋白酶、蘇氨酸蛋白酶和一些尚未進行分類的蛋白酶。根據組織蛋白酶代表底物還可以分為L、B1、D、E、F、FG、GF、G、H、S等幾大類,如表1。
1973年,人們首次提出CTSL,Etsushiro等通過Sephadex或蔗糖梯度凝膠層析法分離純化豬腎中的2種不同的組織蛋白酶A,在純化過程中將組織蛋白酶A分為不同分子量大小的片段,分別命名為CTSL(分子量較大的組織蛋白酶A)和組織蛋白酶S(分子量較小的組織蛋白酶A)。在隨后十多年里,科學家又從大鼠肝臟、兔骨骼肌、人肝臟中分離純化出CTSL,并且證明人CTSL與大鼠和兔CTSL相似。近年來,隨著分子生物學的發展以及先進的分析儀器的出現,國內外學者對于CTSL的研究逐步深入,發現它與腫瘤、心肌病以及吸蟲病等密切相關,是近年來飽受關注的一類靶標蛋白酶。但是,我國對CTSL的相關生理特性研究相對較少。本文就CTSL的結構與功能、生物合成途徑、生物學效應以及在人體和畜牧生產中的應用進行綜述,為CTSL的深入研究提供理論依據。
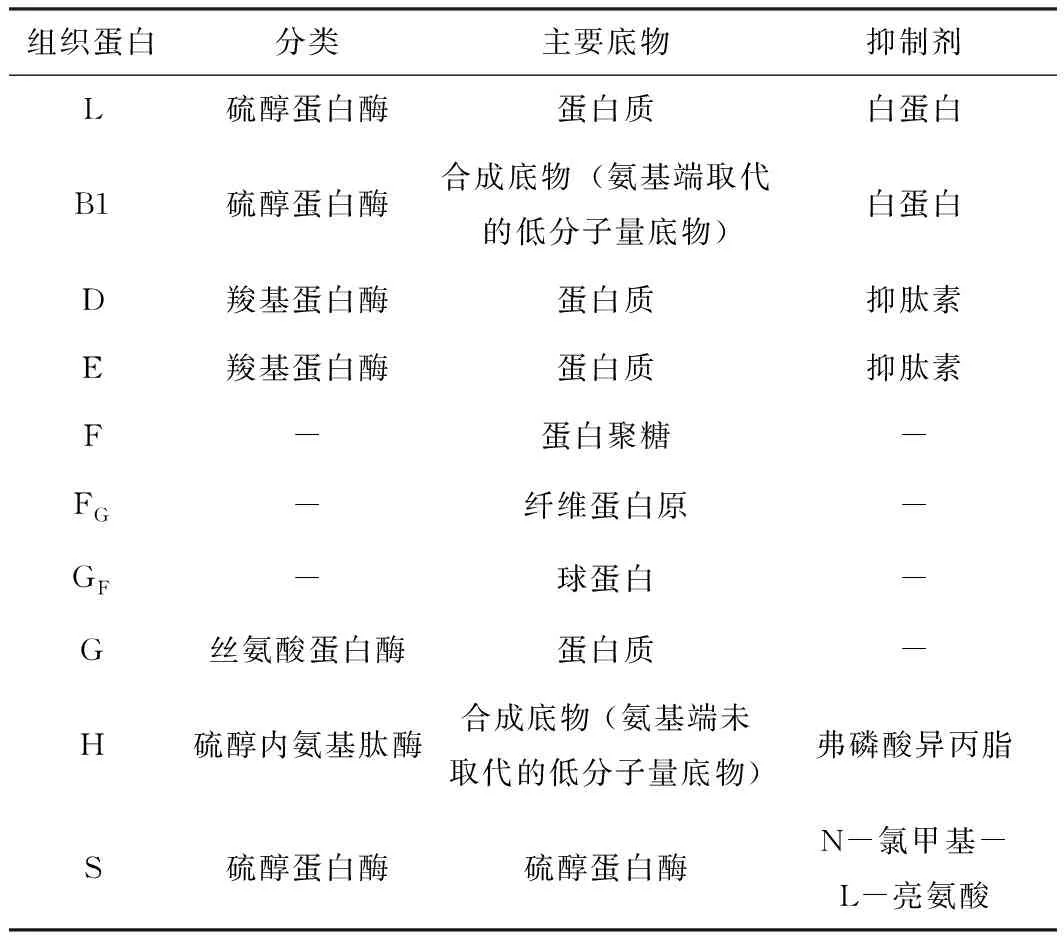
表1 根據代表底物對組織蛋白酶進行分類[1]
1 CTSL的結構
CTSL前體的起始由兩部分組成:N-末端球狀結構域和C-末端延伸結構。N-末端球狀結構域與成熟結構域的組氨酸(His140)至天冬氨酸(Asp155)的環相互作用,C-末端延伸結構位于活性位點裂隙中。CTSL結構與木瓜蛋白酶類具相似的折疊,在成熟CTSL的220個殘基中,183個Cα原子可與木瓜蛋白酶相應Cα原子重疊。CTSL的結構中包含2個域,左(L-)和右(R-),L結構域是α螺旋,而R結構域形成β桶狀折疊,這些結構域在“V”形活性位點裂口頂部分開,α螺旋保守殘基半胱氨酸25(Cys25)和β桶狀折疊的組氨酸163(His163)處于V形裂隙的中部,在該結構域中,Cys25殘基突變為絲氨酸以消除其活性,每個結構域,最終形成酶的催化位點[2]。CTSL的4個活性結合位點分別為S′、S1、S2、S3。CTSL的S′區域類似于木瓜蛋白酶的S′區域,呈現為淺凹陷狀而不為常見酶類的裂縫狀;S1亞基位點呈環狀,且由S3和S2′的部分環構成,并且在頂部由保守二元橋Cys22和Cys63所包圍;CTSL的S2亞基位點深且疏水,CTSL的S3亞基位點在裂隙左壁中間區域,該亞基位點中心有1個擴展的甘氨酸67(Gly67)和Gly68結構,被天冬酰胺66(Asn66)、谷氨酸63(Glu63)和亮氨酸69(Leu69)的側鏈以及Gly61的羰基氧包圍[3]。
不同物種的CTSL結構存在較大差異。Tsunemoto等[4]對于鯉魚的CTSL結構研究發現,鯉魚CTSL與虹鱒CTSL的一致性為82%,但是與哺乳動物CTSL的一致性卻只為62%~69%,哺乳動物的CTSL的P1加工位點為絲氨酸(親水性氨基酸),易被絲氨酸蛋白酶水解成雙鏈形式,而鯉魚的CTSL因在關鍵區域存在纈氨酸29~天冬氨酸295(Val29~Asp295),P1加工位點為Val,該差異導致魚類CTSL所以不太可能加工成兩鏈形式。哺乳動物CTSL的39 kDa前體最終通過溶酶體半胱氨酸蛋白酶快速轉化為23 kDa雙鏈形式[5]。相比之下,鯉魚CTSL保持單鏈形式,沒有加工成兩鏈形式。在加工位置上的氨基酸性質可能決定了哺乳動物與魚類CTSL的差異。
2 CSTL的生物合成及體內轉運
CTSL位于初級溶酶體,在細胞核和細胞外也有發現,CTSL從mRNA內下游AUG起始位點開始翻譯[6-7]。首先N末端的信號肽指導新生多肽鏈插入ER。在ER內,信號肽被切割,釋放出含有前體肽和成熟肽的酶原,CTSL蛋白質在前體肽的幫助下進行卷曲折疊,同時形成二硫鍵和高甘露糖聚糖的N-聯糖基化。在高爾基體內,酶原上甘露糖殘基被磷酸化形成6-磷酸甘露糖(mannose-6 -phosphate,m6p)其通過m6p受體將蛋白質靶向到溶酶體腔。經過晚期溶酶體腔的初始酸化后,CTSL被激活,這導致組織蛋白酶前體肽被切割和組織蛋白酶的活化程度加大。到達溶酶體后,經進一步處理,將蛋白水解加工成重鏈和輕鏈。甘露糖殘基未被磷酸化的CTSL將不會則不會進入溶酶體,而是作為酶原分泌。因組織蛋白酶的過表達極大地增加了該途徑中酶的比例,所以甘露糖殘基轉化為m6p的過程似乎是限速的[8]
3 CTSL的生物學效應
3.1 毛發發育中的作用
脫發是由于毛囊形態發生和周期的改變,毛囊管的擴張和叢毛形成紊亂造成的。對小鼠毛發的研究發現,CTSL在毛發發育中發揮著關鍵作用。Roth等[9]為研究CTSL在小鼠毛發中的作用,在胚胎干細胞中對該基因進行基因靶向敲除,敲除CTSL基因的小鼠出現周期性脫發和表皮增生、棘皮癥(acanthosis)和角化過度。小鼠突變表型主要特征為毛囊上皮細胞和基底表皮角質形成細胞的過度增殖。在對突變體無毛小鼠的CTSL基因研究中發現,小鼠的g149r基因突變導致了蛋白酶失活[10]。對人類毛囊和甲床進行免疫組織化學和免疫熒光試驗發現CTSL特異性地表達于毛球和甲床,CTSL能參與到人類毛囊和指甲的終末分化進程中[11]。因此CTSL被證明是表皮穩態、常規毛囊形態發生和循環所必需的第一種溶酶體蛋白酶。通過搜索人類孟德爾遺傳在線數據庫(OMIM)并未發現因相似原因而導致脫發的人類疾病,因此猜測CTSL在不同生物體內所執行的功能可能也會存在差異。
3.2 生理過程中的關鍵酶
近年來研究數據表明,新發現的分泌小泡中CTSL是一種用于產生活性腦啡肽(enkephalin)和其他神經遞質或激素,例如腦啡肽、促腎上腺皮質激素(ACTH)、α-促黑素細胞激素(α-MSH)、β-內啡肽的蛋白水解加工酶。Yasothornsrikul等[12]研究發現,在嗜鉻細胞顆粒中分泌囊泡中CTSL是負責將腦啡肽原轉化為活性腦啡肽半胱氨酸蛋白酶。腦啡肽生成時,CTSL需要將其定位于含有前體(PE)和蛋氨酸腦啡肽(ME)的分泌囊泡。在一元和二元激素原加工位點,CTSL通過對蛋白水解加工產生ME。同時還發現,敲除CTSL基因的小鼠腦中ME水平明顯低于對照組小鼠,而小鼠腦組織中ME前體的比例升高。這些發現提供了敲除CTSL基因小鼠中腦啡肽前體積累的證據,為CTSL在腦啡肽產生而發揮功能性作用提供支持。除此之外,CTSL能發生蛋白水解作用并且可以通過介導細胞內PGRN(編碼谷粒蛋白)蛋白水解,可調節PGRN及其顆粒蛋白片段的水平[13]。據Funkelstein等[14]的研究,CTSL能通過蛋白水解加工促黑素皮質素(POMC)前體而合成垂體激素ACTH,β-內啡肽和α-MSH。CTSL在垂體AtT-20細胞中的表達導致分泌途徑中ACTH和β-內啡肽的增加,經CTSL的特異性抑制劑CLIK-148處理的AtT-20細胞則會造成ACTH的產出減少和POMC的積累的結果。糖尿病腎病(diabetic nephropathy, DN)是糖尿病(diabetes mellitus, DM)的最重要的合并癥之一,是終末期腎病第二原因。CTSL可能通過參與激活影響DN發展的硫酸乙酰肝素糖苷內切酶活性的機制,促使該酶在腎小球基底膜大量表達,在內皮細胞和足細胞上特異性分解硫酸乙酰肝素,導致這兩細胞類型的硫酸乙酰肝素表達降低,導致足細胞損傷,最終產生DN蛋白尿[15-16]。以上研究均表明CTSL對ACTH、β-內啡肽,內切酶的產生與激活均具有重要作用。
3.3 腫瘤疾病標志物
溶酶體CTSL是多種腫瘤疾病中的標志物和潛在治療靶標的蛋白水解酶。根據Chauhan等[17]的研究表明,癌細胞通過分泌蛋白酶降解細胞外膜成分,從而促進腫瘤的侵襲和轉移。對3種鼠黑素瘤變體的觀察發現,癌細胞通過CTSL mRNA的持久翻譯來維持CTSL的高表達水平,而腫瘤細胞本身就是CTSL mRNA表達升高的來源[18]。Vasishta等[19]測定腫瘤相鄰的非惡性組織(A-NM)和遠離腫瘤的非惡性組織(D-NM)的勻漿中幾種蛋白酶樣肽酶的活性,發現腫瘤相鄰的A-NM中CTSL的活性顯著高于D-NM組織。與正常組織相比,在胃癌、結直腸癌、乳腺癌和甲狀腺癌中,也有CTSL酶活性增加的報道,這提示CTSL表達上調與疾病進展有密切關系[20]。同時研究發現CTSL參與卵巢癌細胞的增殖和侵襲,CTSL在卵巢癌(ovarian cancer,OC)中過度表達,CTSL的下調則能顯著抑制了人卵巢癌細胞(skov3)的增殖和侵襲能力,而CTSL在ov90細胞中的上調則會產生相反的效果。與OC細胞相比,在裸鼠體內CTSL沉默細胞發育成腫瘤的能力降低,而這些細胞的異種移植瘤生長明顯受到抑制[21]。大量文獻資料表明癌癥組織CTSL的表達水平顯著高于正常組織,其中腎和睪丸腫瘤表達的CTSL水平最高,多數乳腺癌表達的CTSL水平較高。CTSL的過表達與人類動脈粥硬化和主動脈瘤(aortic aneurysm,AA)的發生發展同樣有著密切聯系[22]。重組半胱氨酸蛋白酶抑制劑C具有較高的抗蛋白酶活性,主要通過抑制CTSL活性,達到抑制癌細胞的生長和侵襲的效果[23]。在主動脈瘤中,當不存在半胱氨酸蛋白酶抑制劑C時,CTSL的活性增強,促進了微血管形成、細胞凋亡、白細胞黏附及細胞增殖,從而導致AA病變面積的增大以及動脈管腔直徑增大。因此CTSL和半胱氨酸蛋白酶抑制劑C可能與AA存在相關關系[24]。以CTSL結構特點為治療腫瘤的突破點,中國科學家發現阿斯非芬酯及其類似物能與CTSL形成氫鍵,與其緊密結合,從而抑制癌細胞的增殖和遷徙[25]。總之,通過敲除卵巢癌細胞和乳腺癌細胞的CTSL基因來減少腫瘤細胞的增殖、遷移和侵襲,增強膠質瘤細胞對放射治療敏感性[26-27]的方法已逐步為我們所重視。除此之外,在以后的研究中,CTSL極有可能成為人類惡性腫瘤的診斷或預后標志物,這將對惡性腫瘤的提前診斷具有積極的意義。
3.4 維持心肌穩態中的作用
溶酶體CTSL作為心肌內的穩態蛋白酶,是心臟形態和功能的關鍵,對于維持心臟的正常運行發揮著重要的作用。心肌病(cardiomyopathy)是以進行性心肌重塑為特征的一組異質性心臟病,會導致心臟泵功能受損[28]。據研究發現,缺乏CTSL的心肌細胞含有多個大且明顯融合的溶酶體,用于儲存電子致密的異質材料,同時發現該小鼠心肌的中間質纖維化和多核化,這兩者也都是人心肌病的特征。缺乏CTSL的小鼠顯示出明顯的心室和心房擴大,且檢測到異常心律,如室上性心動過速、室性期外收縮等,超聲心動圖和心電圖檢查結果顯示小鼠左心室肥大,這很可代表著缺乏CTSL的小鼠對心臟損害的適應性反應[29]。在正常小鼠中,CTSL可通過阻斷AKT/GSK3β信號通路,延緩心力衰竭進展,改善心功能,抑制心肌肥厚、炎癥和纖維化,而CTSL缺乏則可導致小鼠心功能衰退及梗死后心肌重建,最終有可能發展為晚發性擴張型心肌病(DCM)[28,30]。在對擴張型心肌病研究中發現,DCM患者外周血單個核細胞中CTSL酶活性明顯高于健康對照組,CTSL的功能水平與心臟左室功能不全的嚴重程度有很強的相關性。這表明CTSL參與了擴張型心肌病的發病機制,CTSL可能成為評估擴張型心肌病嚴重程度的血基標志物[31]。同時小鼠CTSL的缺乏影響新生小鼠心肌細胞的內溶酶體系統。盡管這些囊泡缺乏溶酶體儲存材料并且他們的形態也有所改變,但這并不影響酸性細胞器的數量增加。酸性細胞區室缺陷將導致復雜生化和細胞反應以及細胞骨架蛋白和線粒體損傷[32]。CTSL和酸性細胞區室缺乏的,提出了如何改變細胞內信號傳導用以誘導肥大反應導致心臟擴張的問題[28]。同時,還有研究發現CTSL還能參與心臟信號轉導,減少了用于從受體發出信號的時間跨度和受體再循環的速率。這種信號的提前終止能降低細胞溶質激酶(如AKT)的活化狀態,因此降低了受攻擊的小鼠心肌的肥大反應[33]。在心臟重塑和修復中也扮演著重要的角色。主要位于溶酶體區室的CTSL,在中性pH條件下,其他蛋白酶(如基質金屬蛋白酶)可分泌和激活一部分酶原,其中活化的胞外CTSL也可處理ECM蛋白,如纖連蛋白、層粘連蛋白,這對于心臟重塑和修復極為重要[34]。
3.5 寄生蟲病防治方面作用
肝片吸蟲病(fasciolosis)是由肝片形吸蟲(Fasciolahepatica)寄生引起的人獸共患病,肝片吸蟲病在我國是危害最嚴重、覆蓋范圍最廣的反芻動物寄生蟲病之一,不但引起患病動物的生產能力降低,同時還會引起畜產品品質和產量的顯著下滑,對畜牧業造成巨大的經濟損失[35-36]。因此,如何防治吸蟲病成為一個亟待解決的問題。研究發現幼年肝吸蟲分泌的CTSL是可行的疫苗靶標[37]。它存在于吸蟲屬(Fasciolaspp.)的排泄和分泌物中,用重組肝CTSL1蛋白酶對弗西尼亞牛進行免疫接種,與對照組相比,吸蟲負荷減少48.2%[38]。同屬于半胱氨酸蛋白酶家族的CsCPL可能參與華支睪吸蟲寄主蛋白質的營養分解代謝,CsCPL可作為一種潛在的華支睪吸蟲疫苗抗原和藥物靶標,用來預防和治療華支睪吸蟲感染病[39]。同時據Sansri等[40]的研究發現,接種重組幼年特異性CTSL的小鼠可預防大片吸蟲(Cyciolagigantica)感染。在吸蟲防治中,有科學家另辟蹊徑,在免疫保護試驗中利用肝片吸蟲的亮氨酸氨基肽酶(leucine aminopeptidase)和CTSL1單獨作為抗原,試驗效果不盡相同。但Ortega-Vargas等[41]將肝片吸蟲FhLAP和FhCL1抗原序列組成嵌合蛋白(rFhLAP-CL1),對綿羊進行免疫,免疫綿羊的rFhLAP-CL1特異性IgG1和IgG2等水平迅速升高,明顯高于對照組,表明嵌合蛋白對肝片吸蟲感染具有中度保護作用。這提示我們rFhLAP-CL1有做為疫苗的巨大潛力。布魯氏錐蟲可引起一種流行于非洲的家畜血液性疾病——干拿病。該病嚴重影響家畜的生產生活,對養殖企業造成嚴重的經濟損失。半胱氨酸蛋白酶抑制劑的化學試驗證明,TbCATL對布魯氏錐蟲存活至關重要,溶酶體室中的TbCATL是決定半胱氨酸蛋白酶的大部分活性的關鍵酶。乙烯基砜化合物LU102選擇性地抑制了錐蟲中TbCATL的活性,從而達到殺死布魯氏菌的目的,TbCATL抑制劑可能成為未來錐蟲藥物開發新的方向[42]。
3.6 抗原遞呈方面的作用
多項研究表明,CTSL在動物抗原遞呈方面發揮重要作用。CTSL在皮質胸腺上皮細胞Ii(固定鏈)降解和CD4+T細胞選擇中發揮著關鍵作用。CTSL負責質胸腺上皮細胞(cortical thymic epithelial cell, CTEC)的特異性Ii降解后期,而主要組織相容性復合物(MHC)II類抗原表達的關鍵步驟便是胸腺Ii的降解。內質網中新合成的MHC類分子與恒定鏈(Ii)結合形成(αβIi)3九聚體,在恒定鏈胞漿端信號肽引導下,經高爾基體進入上述內吞系統,在那里胸腺Ii被CTSL快速降解,但II類相關的恒定鏈短肽(CLIP)仍結合在MHCII類分子肽結合槽內;在HLA-DM分子協助下,將CLIP降解,使抗原肽與MHC類分子結合形成抗原肽MHC I類分子復合物;后者轉運至細胞表面,供成熟的CD4+T細胞識別[43]。CTSL為我們通過靶向特異性溶酶體酶調控CD4+T細胞和干預自身免疫提供新思路。最近就有學者發現在仔豬感染肺炎支原體期間,通過CTSL參與抗原呈遞途徑來促進IgA的分泌,導致CD4+T細胞百分比和MHC II分子水平升高,增強豬肺炎支原體(Mycoplasmahyopneumoniae)黏膜免疫,進而為仔豬提供有效保護[44]。
4 總結與展望
自CTSL發現之日起,人們對其性質和結構進行了廣泛研究。隨著近年來科學技術水平的發展和多種檢測手段的更新,人們對于CTSL有了更加深入的認識,并將這些知識應用到臨床疾病治療和藥物開發中。在癌癥治療方面,有人利用CTSL的陽離子和親水性殘基可與氧化石墨烯吸附的特性[45],將氧化石墨烯做為該類酶的吸附劑,用于減緩癌癥擴散,轉移。還有人利用CTSL的抑制劑與該類酶結合,抑制酶的活性,來達到治療和抑制腫瘤目的。在農業方面,有人利用CTSL做為吸蟲疫苗抗原和藥物靶標,用于治療吸蟲病,為畜牧業挽回巨大經濟損失。總之,只有充分了解了CTSL的生理特性以及CTSL在不同動物機體、不同發育階段中發揮的作用,才能利用這些特性制定出有針對性的研究方案,更好地為人類和動物疾病的治療和預防做出貢獻。
雖然人們對CTSL的研究已取得了一定的進展,但這只是冰山的一角,CTSL研究仍有許多未知領域需要進一步探索。隨著今后研究手段的不斷提高,CTSL在癌癥治療、寄生蟲病防治和促進神經遞質合成等領域必將得到更加深入的發掘,CTSL研究擁有廣闊的前景。

