基于建模教學發展化學高階思維的教學研究
李金燕 楊劍 鐘奕玲 羅一帆 許旋
摘要:以“電解原理之放電順序的探究”為素材,從學生已學的惰性電極電解氯化銅溶液的分析模型進階到通過惰性電極電解氯化鈉溶液的探究,從離子放電順序的視角完善電解池認識模型,再通過創設“凈水器推銷商”的真實情境開展鐵鋁電極電解氯化鈉溶液的探究,進一步從電極材料的認識視角對電解原理認識模型進行修正。建模教學在建構化學知識的同時,促進學生的化學高階思維能力和素養的有效發展。
關鍵詞:建模教學;電解池放電順序;高階思維
文章編號:1008-0546(2021)10-0047-05中圖分類號:G632.41文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2021.10.011
《普通高中化學課程標準(2017年版)》提出的“模型認知”是化學學科的重要思想和方法[1],在教學中要引導學生構建思維模型,促進學生建模思維和建模能力的提升。霍倫(1996)[2]提出建模教學主要包括構建模型、評價模型、完善模型、應用模型,具體表現為先選擇已構建的模型來解決問題;在新的情境下對已有的模型進行評價進而修正模型。新課標提倡“素養為本”的教學理念,倡導真實問題情境的創設,開展以化學實驗為主的多種探究活動,重視教學內容的結構化設計,注重培養學科思維,其中培養學生解決陌生情境下不同復雜程度問題的能力,是“素養為本”化學課堂教學追求的重要目標。陌生情境下復雜問題的解決,需要學生具有較強的化學科學思維能力,尤其是高階思維能力,其中化學高階思維能力包括:概括關聯的能力、解釋說明能力、推斷預測的能力、設計驗證的能力及分析評價的能力等[3]。
一、內容分析
本節課主要選自人教版選修四第四章第三節《電解池》電解原理第二課時,“化學能與電能的相互轉化”是貫穿第四章的主線。在原電池的學習中,學生已經了解自發的氧化還原反應通過原電池將化學能轉化為電能,本節的核心概念是“對于非自發的氧化還原反應可以通過電解池實現由電能到化學能的轉化”,本節的基本概念:電解池的基本要素、明確電解池的工作原理(包括電子導體回路、溶液中的離子行為、電極材料與電極反應、電極上放電順序),電解池原理的內容結構圖如圖1。人教版教材的第一課時惰性電極電解CuCl2溶液承載著電解池的基本要素、溶液中的離子行為、電極反應等核心知識。本節課主要對電極上放電順序及電極材料這兩個基本概念從模型認知的視角進行建構,為下節課電解池的應用做知識鋪墊。

二、基于模型建構的教學
1.“電解原理放電順序”模型教學分析
通過回顧第一節課惰性電極電解氯化銅溶液歸納出電解池認識分析模型(溶液中存在哪些離子;通電時離子如何移動;產物、電極方程式),進階到惰性電極電解飽和食鹽產物的探究,從離子放電順序的視角完善已有的電解池分析模型,再應用已有的模型去分析凈水器推銷商“科學實驗”的真實情境時,學生發現已建立的分析模型不能適用,進而需要在原有的模型基礎上通過探究金屬活性電極電解飽和食鹽水,進而發展學生電解池的分析的視角。通過回顧已有的電解池分析模型發展學生的概括關聯、分析解釋的高階思維,在已有模型的基礎上通過實驗探究發展學生的推理預測、簡單設計的高階思維,將模型應用到真實情境中檢驗模型從而進行修正,發展學生的分析評價、系統探究的高階思維,具體框架如圖2。

3.教學重難點
從離子放電順序和活性電極的兩個視角發展電解池的分析模型。
4.突破教學重難點(教學策略)
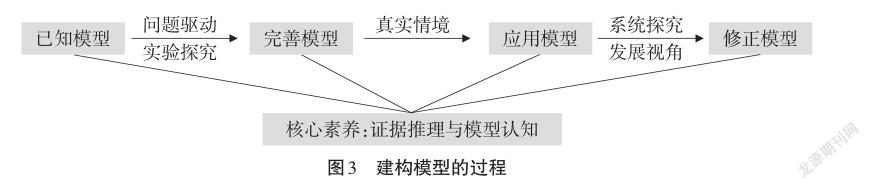
在已有的模型基礎上進行問題驅動和實驗探究從而完善模型,在真實情境中應用模型進行系統探究和發展視角來修正模型。模型建構過程如圖3所示。
三、教學過程
1.教學設計流程圖
本節課以“探究電解原理的放電順序”為主線,以“惰性電極電解氯化鈉溶液和鐵鋁電極電解氯化鈉”為情境開展教學活動,具體流程如圖4。
2.教學具體過程
環節一:回顧電解原理第一課時電解池分析認識模型
【回顧模型】第一節課我們通過惰性電極電解Cu? Cl2溶液的學習,從宏觀到微觀的視角歸納出了電解池反應的認知思維模型,請同學們進行回顧。
【學生回答】1.溶液有什么離子?2.通電后,離子如何移動?3.產物、電極反應
【提出問題】CuCl2溶液中除了Cl-、Cu2+其實還存在水電離的OH-、H+,通電時Cl-、OH-都向陽極移動,Cu2+、H+都向陰極移動,但是實驗中H+和OH-都沒有參與反應,那么如果利用上述實驗的電解池裝置來電解NaCl溶液,能否也得到金屬Na?
設計意圖:回顧第一課時電解CuCl2實驗課本已建立的模型是還沒考慮水中電離的OH-、H+,從已有的知識提出問題自然過渡到用惰性電極電解氯化鈉溶液的探究,促進學生認識思路結構化。發展學生的概括關聯能力。
環節二:通過惰性電極電解NaCl溶液,了解離子放電順序,完善模型
【教師演示】惰性電極電解NaCl溶液
【收集證據】兩個電極都產生了氣泡
【學習任務】請同學們對惰性電極電解NaCl溶液的氣體產物進行預測,并試著設置實驗方案證明你們的預測。
【理論分析】根據實驗結果思考以下問題:
1.NaCl溶液中存在哪些離子?
2.通電后,溶液中的離子如何移動?
3.結合證據,從得失電子、氧化還原反應的角度進行分析陰陽極可能的產物?
【學生討論】
1.溶液總共四種離子Cl-、Cu2+、OH-、H+
2.Cl-、OH-移向陽極失電子;H+、Na+移向陰極得電子
【實驗設計】對于陰極:基于有氣泡放出的證據,可推測是H+放電,氫氣的檢驗用點燃法和肥皂泡法;對于陽極:可能是Cl-失電子會變成氯氣或是OH-失電子后必有一種元素化合價升高,推測產生的氣體是氧氣,氯氣的檢驗可以用濕潤碘化鉀試紙;氧氣檢驗用帶火星木條。
【評價方案】引導學生對氫氣檢驗方法(點燃法和肥皂泡法)進行評價:危險并難于成功。
【教師引導】水電離的H+得電子變成氣體離開溶液體系,溶液體系會剩下大量的OH-,可通過間接檢驗OH-的存在(滴加酚酞)證明是氫離子放電變成氫氣。
【學生實驗】惰性電極電解NaCl溶液的產物檢驗(圖5)。


【收集證據】陰極附近區域變紅;陽極附近區域的濕潤碘化鉀試紙變藍。
【證據分析】陰極是H+得電子變成氫氣;陽極是Cl-失電子會變成氯氣。
設計意圖:引導學生從證據和氧化還原的理論兩個角度進行產物的預測,可以減少探究的盲目性。對學生收集的證據及時提出任務教學,學生經過前面的學習,對理論分析部分以及陽極產物的檢驗能合作完成,知道氯氣用濕潤淀粉-KI試紙檢驗,氧氣用帶火星木條;而對于檢驗H2的方法,需要進行引導。發展學生推理預測、設計驗證及分析解釋的高階思維能力,從而真正落實素養的發展。
【討論總結】根據實驗的結果,我們可以知道陰極:H+先于Na+放電;陽極:Cl-先于OH-放電,
【學習任務】你能解釋不同離子的放電順序為何不一樣嗎?
【理論分析】根據實驗結果思考以下問題:
1.離子移動有何目的?
2.陽離子和陰離子能否放電與什么因素有關?
【學生討論】離子移動的目的主要是得失電子,在陰極H+的得電子能力比Na+強,而得電子能力主要是反應氧化性的強弱;陽離子能否放電主要跟離子的氧化性有關;同理,陰離子能否放電主要跟離子的還原性有關。
【分析總結】離子放電順序
陽極:陰離子——失電子(有還原性)
還原性強的離子優先放電:Cl->OH->含氧酸根離子(SO2-4等)
陰極:陽離子——得電子(有氧化性),氧化性強的離子優先放電:Cu2+>H+>Na+
【歸納推理】
陰離子放電(失電子)順序:S2->I->Br->Cl->OH->SO2-4等
陽離子放電(得電子)順序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+
【完善模型】
在判斷惰性電極電解池的陰極、陽極產物時我們要思考離子的放電順序。
分析電解池反應的思維程序:
(1)溶液中存在哪些離子?
(2)通電時離子如何移動?
(3)離子放電順序
(4)產物、電極反應
【講解】經過探究學習,電解池裝置電解NaCl溶液,是沒辦法得到金屬Na。
設計意圖:由惰性電極電解CuCl2的認識模型,遷移到電解NaCl溶液,通過分析電解NaCl溶液產物,從離子放電順序的視角發展分析電解池的思維模型。由個別歸納推理出惰性電極的電解池一般的離子放電順序。由于學生對離子的氧化性和還原性的比較有一定的認識,對于推理放電順序的原因不是很難。發展學生的概括關聯和分析解釋的高階思維能力。
環節三:應用模型,推銷商的“科學實驗
【新聞視頻】成都周邊一些消費者反映,賣凈水器的推銷商用電解儀放入飲用水出現了所謂的先變綠后變黃等現象(圖6),并說這是“重金屬”等有害物質,這種檢測結果可信嗎?

【資料卡片】推銷商電解儀電極是鐵棒和鋁棒;自來水許多礦物質
【學生思考】觀看新聞,結合資料卡片對新聞進行思考
【提出問題】已有分析電解池的模型是分析惰性電極電解模型,而對于分析金屬活性電極的電解模型是否還適合呢?
【學習任務】采用控制變量法設置實驗:相同的電解質溶液而不同的電極材料(改用活性電極)進行實驗。
【思考和交流】從控制變量法的原理思考
設計意圖:貼切的真實情境,將知識關聯社會生活,感受學科化學的價值。引導學生根據實際需要提出探究課題,為了減少探究的盲目性,提供資料卡片并引導學生在提取原來的電解池分析模型時,發現原有的模型不適用,并引導學生確定探究任務“不同的電極材料電解相同的電解質”。
環節四:鐵鋁電極電解NaCl溶液,完善電解池認識分析模型,
【演示實驗】鐵鋁電極電解NaCl溶液
【收集證據】陰極Al棒附近產生了無色氣體;陽極Fe棒溶解且溶液周圍先變綠色再變黃色
【追問】請同學們從理論分析和事實證據對產物進行推測及設置實驗方案驗證
【學生討論】陽極Fe棒溶解且溶液周圍變綠色,推測可能是電極Fe失去電子變成Fe2+,再被空氣氧化成Fe3+,檢驗Fe3+可以用KSCN;陰極是產生無色氣體,可能是來自水電離的H+得電子變成H2,可用酚酞間接檢驗是否有OH-即可證明是否是氫離子放電。
【實驗驗證】鐵鋁電極電解NaCl溶液的產物檢驗
【收集證據】陰極附近區域變紅;陽極溶液變綠后再變黃,取陽極附近的溶液滴加KSCN溶液發現血紅色。
【證據分析】說明陽極的Fe棒先于溶液離子失去電子變成Fe2+,Fe2+被空氣氧化變成Fe3+。而Al棒連接在陰極,金屬一般不會得到電子。
【完善模型】在判斷電解池的陰極、陽極產物時我們先判斷陽極是惰性還是活性電極,再思考離子的放電順序。
【提出問題】現在你能識破推銷商的“騙局”了嗎?
【學生展示】小組進行鐵鋁電極電解自來水實驗并解釋說明原因。
設計意圖:前面已經學習了Fe的化合物性質以及從離子放電順序分析電解池原理,所以對于產物推斷以及驗證,學生能自主討論交流完成,從離子的放電順序和電極材料兩個角度完善了電解池原理的認識,建構電解池的一般認識思路。回應情境,感受化學知識的價值,發展學生推理預測、設計驗證及分析解釋的高階思維能力。
環節五:抗疫和“惰性電極電解氯化鈉溶液”
【視頻觀賞】惰性電極電解氯化鈉溶液可制備出抗疫的“一分子”——消毒液
【課后活動】寫份小論文,談談為什么惰性電極電解氯化鈉溶液可以制備消毒液?
設計意圖:診斷與發展學生學科核心素養中社會責任水平及將化學成果應用于生產、生活的意識。本節課以電解氯化鈉為主線,最后拓展惰性電極電解氯化鈉溶液可制備出抗疫的“一分子”——消毒液,響應2020年抗疫的口號。
四、結語
建模教學重視認識視角和認識思路的形成,根據已有知識、理論和經驗進行抽象、構建出初步模型,再經過驗證、修正等若干操作表征研究對象的模型,豐富他們對化學反應原理的認識角度,提高他們對反應原理的認識深度,從而建立具有學科特質的化學認識視角和化學認識思路,進而發展學生的化學學科思維方式,真正落實從化學知識進階到高階思維能力再到素養發展的目標。另外培養學生解決陌生情境下問題的能力,是素養教學的重要目標,而陌生情境下復雜問題的解決,需要學生具有高階思維能力。之所以基于建模教學可發展學生的化學高階思維能力,是因為解決復雜問題的過程既是創造性地應用科學模型的過程,也是建構模型的過程。
參考文獻
[1]中華人民共和國教育部.普通高中化學課程標準(2017年版)[S].北京:人民教育出版社,2018
[2]張晉,畢華林.模型建構與建模教學的理論分析[J].化學教育(中英文),2017,38(13):27-32
[3]鄭長龍,孫佳林.“素養為本”的化學課堂教學的設計與實施[J].課程·教材·教法,2018,38(4):71-78

