在自主建構中深度認識非金屬元素的研究思路
魏平 程潔鑾 呂明靜
摘要:以“位—構—性”思維模型為指引,充分發揮元素周期表的預測功能。基于鹵族元素的位置和結構特點,引導學生對鹵族元素的非金屬性和對應單質的氧化性進行推斷和預測,并設計實驗驗證,從而實現學生對鹵族元素性質的意義建構,充分發揮學生的主體性,發展并提升學生證據推理與模型認知素養。
關鍵詞:“位—構—性”模型;元素性質;意義建構
文章編號:1008-0546(2021)11-0044-03中圖分類號:G632.41文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2021.11.011
一、問題的提出
建構主義的學習要求學生通過高水平的思維活動來學習,通過問題解決進行學習。學生要不斷思考,對各種信息和觀念進行加工轉換,基于新、舊知識進行綜合和概括,解釋有關的現象,形成新的假設和推論,并對自己的想法進行反思性的推敲和檢驗[1]。但在教學實踐中,發現教師往往容易忽視舊知對新知建構的重要性,使學生無法以舊知為出發點,通過信息提取,嘗試推理分析,從而獲得新知,解決問題。
譬如,鹵族元素及其化合物的學習安排在元素周期表和堿金屬元素的內容之后,可以作為一個很好的案例來引導學生應用前面已經建立的“位—構—性”思維模型[1],這可使學生在加深對元素周期表認識的同時,發展其對模型的應用能力。反觀目前,大部分教學多采用觀察和歸納的教學方法來引導學生認識鹵族元素及其化合物的性質,將構建“位—構—性”思維模型作為教學的終點[2]。此教學忽略了該內容對發展學生的學科核心素養的價值,特別是證據推理和模型認知素養,教師無法引導學生思考學習這個模型有什么用以及如何應用,學生無法認識到模型的作用——預測功能,導致其在應用該模型預測其它陌生元素的性質時出現了障礙,只能通過機械記憶的方法來認識鹵族元素的性質,無法建立非金屬元素的研究思路,從而未能自主構建元素周期律。
二、教學設計
1.教學邏輯分析
本課時的教學內容主要是探究鹵族元素遞變性、相似性的規律。通過前面的學習,學生已經具備了元素周期表的相關知識并對堿金屬元素的性質進行了探究,初步建立了“位—構—性”思維模型,本節課的目標在于促進學生對原子結構與元素周期律第三層次知識的認識,重點引導學生巧妙運用“位—構—性”模型來預測和認識鹵族元素的性質,在體會元素周期表預測功能的同時,達到模型的應用水平,從而發展學生的證據推理與模型認知素養,為下一步自主構建元素周期律打下思維和方法的基礎。
在學習本節課之前,學生需要具備的已有認知基礎和認識角度,以及教師所需發揮的作用,具體見表1。
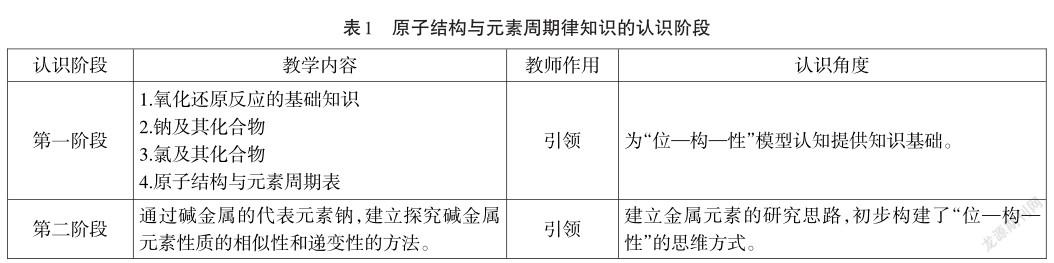

2.學情分析
本校學生已認識了堿金屬元素性質的相似性和遞變性,建立了金屬元素的研究思路,初步構建了“位-構-性”的思維方式,但體現到應用上,還存在一定的差距。本節內容從金屬元素到非金屬元素的遷移,既有元素失電子能力和得電子能力的差異,又有單質還原性和氧化性強弱比較的實驗方法的差異。通過本節課,引導學生應用“位—構—性”模型對非金屬元素的性質進行預測和分析,從而診斷和發展學生的證據推理和模型認知素養。
3.目標分析
(1)通過鹵族元素的原子結構的推導認識原子結構與元素在周期表中的位置關系,為“位—構—性”方法模型提供認識基礎。
(2)通過鹵族元素單質氧化性強弱預測及實驗驗證,發展學生的證據推理素養。
(3)通過鹵族元素的元素結構到物質性質的學習,充分應用“位-構-性”的方法模型,提升學生的模型認知素養。
4.教學流程(見表2)
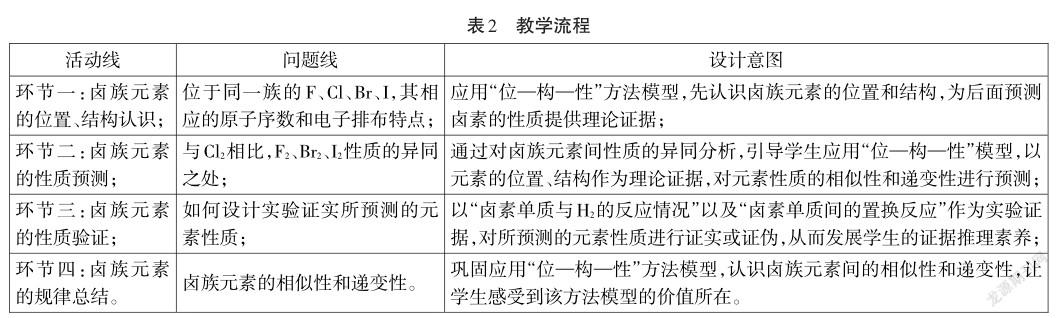
5.教學實錄
環節一:認識鹵族元素的結構、位置
【教師】如何推測Cl位于元素周期表的位置?
【學生】畫出Cl的原子結構示意圖,根據其電子層數和最外層電子數推斷出Cl在元素周期表中的位置為第三周期ⅡA族。
【教師】已知F、Cl、Br、I位于同一族,其相應的原子序數和電子排布是?
【學生】根據元素周期表中各周期的元素種類,推導出F、Br、I的原子序數,并根據核外電子的排布特點,畫出鹵族元素的原子結構示意圖。
環節二:了解鹵族元素單質的物理性質和化學性質的相似性
【教師】首先,我們來看鹵族元素構成的單質的圖片,發現物理性質會有一定的規律性,比如顏色逐漸加深,由淺黃綠色的氟氣變為紫黑色的碘單質,狀態由氣體變為固體,熔沸點都在逐漸增大。那么鹵族元素構成的單質化學性質有什么規律性嗎?Cl元素對應的單質Cl2具有什么性質呢?
【學生】能與水發生反應;能與堿發生反應;能與金屬單質(如Fe、Cu)發生反應;能與非金屬單質(如H2)發生反應。
【教師】那么Br2能發生哪些反應呢?
【學生】能與水發生反應;能與堿發生反應;能與金屬單質發生反應;能與非金屬單質發生反應。(大部分同學并不能通過同族元素性質相似來進行預測,只是零星的說出一些反應)
【教師】為何如此預測呢?預測的依據是什么?
【學生】Br與Cl位于同一族,最外層電子數一樣,性質相似。
環節三:鹵族元素單質化學性質的遞變性
【教師】同一族的元素性質具有相似性,那是否存在差異呢?
【學生】有,從上到下,元素對應的核外電子層數逐漸增大。
【教師】電子層數增大,相應的原子半徑有何變化呢?
【學生】變大。
【教師】這對元素的性質有何影響?
【學生】(進行討論后得出結論)原子半徑增大,原子核對外層電子的吸引力變小,得電子能力變弱。
【教師】鹵族元素從上往下,得電子能力越來越弱,那么鹵素的單質性質會發生怎樣的變化呢?比如氯氣能夠與氫氣發生反應,氯氣做氧化劑,氫氣做還原劑。其它鹵素單質都能夠與氫氣反應,都是做氧化劑,請大家討論,氟氣、氯氣、溴單質、碘單質與氫氣反應,哪種反應最容易,最劇烈?
【學生】(討論后)隨著原子核電荷數的增多,鹵素單質與H2的反應越來越難。
【教師】為什么反應越來越難?
【學生】鹵素原子要吸引電子,達到8電子的穩定結構,說明了隨著原子核電荷數的增多,鹵素原子半徑增大,核內質子對核外電子的吸引力減弱,鹵素單質的得電子能力越來越弱,所以與氫氣反應越來越難,氫化物的穩定性也越來越弱。(通過課本表格驗證)
【教師】隨著原子半徑的增大,鹵族元素的非金屬性從上往下逐漸減弱,對應單質的氧化性也是逐漸減弱,即氧化性:F2>Cl2>Br2>I2,那應如何設計實驗,證實Cl2的氧化性大于Br2呢?
【學生】氧化劑大于氧化產物,可選Cl2作氧化劑,以Br-作還原劑(如KBr),看是否能夠生成產物Br2。
【教師】演示實驗,向KBr溶液中滴加適量的氯水,充分振蕩。
【學生】觀察實驗現象。發現溶液變黃。
【教師】能否判斷生成了Br2嗎?
【學生】不能,因為氯水也呈黃綠色,有可能是加了氯水的原因。
【教師】提供資料卡片,即Br2的CCl4溶液呈橙色,I2的CCl4溶液呈紫紅色,CCl4為有機溶劑,不溶于水,密度比水大。
【學生】提議說,向混合溶液中,再滴加少量的CCl4,充分振蕩,若CCl4層呈現橙色,則證實有Br2生成。
【教師】依照學生的討論結果,繼續實驗操作,
【學生】觀察到CCl4層呈現橙色,說明有Br2生成,即氧化性:Cl2>Br2。
【教師】那如何設計實驗驗證氧化性:Br2>I2呢?
【學生】參考上述的實驗設計思路,在教師的引導下,取出試管中的Br2的CCl4溶液,并滴加適量的KI溶液,充分振蕩,觀察到下層溶液呈紫紅色,證實了有I2生成,由此證明:氧化性:F2>Cl2>Br2>I2
環節四:鹵族元素規律總結
【教師】由此,我們學習了非金屬元素的研究思路,最外層電子數決定了非金屬元素容易得電子,從而其單質一般具有氧化性;半徑的大小決定了非金屬元素得電子的能力,從而判斷其單質氧化性的強弱。請歸納鹵族元素的性質。
【學生】在鹵族元素中,最外層電子數都為7個,容易得1個電子達到穩定結構,從而鹵素單質都具有氧化性;隨著原子核電荷數的增多,鹵素原子半徑增大,核內質子對核外電子的吸引力減弱,鹵素單質的得電子能力越來越弱,所以其單質的氧化性:F2>Cl2>Br2>I2。
三、教學效果與反思
在以往的教學中沒有區分元素性質和元素構成物質的性質,導致學生對得失電子能力和氧化性還原性等概念容易產生混淆,影響了學生對“結構決定性質”的判斷,也無法形成研究非金屬元素的思路,只能死記硬背物質的化學性質。本節教學中注意引導學生區分鹵族元素的性質是得電子的能力,其構成單質的性質是氧化性,后期還要引導學生區分元素構成的化合物的性質,概念的層次區分明顯,從而有助于學生的理解和構建研究思路。
當今的建構主義者提出:沒有對事物的唯一正確的本質抽象表征,不能通過語言簡單地把經過形式化概括的知識傳遞給學生[1]。在教學中發現,即使是最外層電子數相同,對應單質的化學性質相似這個類比推測性質的認識思路,大部分學生也僅僅是了解,無法應用在陌生物質性質的預測上,比如學生在預測Br2所能發生的反應上,只能零星說出個別反應,并不能根據Cl2性質的相似性來預測出所有的反應,所以在課堂上需要創設問題情景,使學生不斷嘗試使用剛建立的方法和思路,進行試錯和思考,從而達到模型的應用水平,而不是簡單的記憶和理解。通過本節課基于“位-構-性”教學模型的設計,在本節課的結尾,大部分學生可以預測和推理出I2能夠與NaOH溶液反應,并且可以快速推測出反應的產物。
上一節課探究堿金屬元素性質的相似性和遞變性的方法是本節課的知識生長點,在此基礎上,利用非金屬元素與金屬元素在原子結構上的相似性,比如最外層電子數相同,原子半徑逐漸增大,來進行單質化學性質的預測,然后設計實驗來進行驗證,從而深化“位-構-性”方法模型,讓學生完整體驗了非金屬元素的研究思路,發展并提升了學生證據推理與模型認知的核心素養。
參考文獻
[1]張建偉,孫燕青.建構性學習[M].上海:上海教育出版社,2005:52
[2]莊乾敏,劉冰,張雪.基于化學史發展學生學科核心素養的教學——以“膠體”為例[J].化學教育(中英文),2019,40(13):28-32
[3]王峰,劉金翠.基于內容分析與教學設計的教材“二次開發”研究——以“元素周期律與元素周期表”為例[J].化學教育,2013,34(12):18-21

