長鏈非編碼RNA XLOC-013014在腎癌組織中的表達及對腎癌細胞惡性生物學行為的影響
潘 良,王宇雄,卞亭長,酈俊生,林文耀
(上海市徐匯區中心醫院泌尿外科,上海 200030;*通訊作者,E-mail:phmolon@163.com)
腎癌是最常見的腎原發性惡性腫瘤,進展較快、惡性程度較高、預后較差,嚴重威脅人類生命和健康[1]。腎癌的具體發病機制尚不清楚,研究腎癌發生發展的分子機制,尋找早期診斷標志物和治療靶點具有重要臨床意義。人類基因組中的大部分轉錄產物均為非編碼RNA,其中長度超過200個核苷酸的長鏈非編碼RNA(long-chain non-coding RNA,lnc-RNA)是非編碼RNA的重要組成部分[2]。近年來,研究表明lncRNA可參與多種疾病包括腫瘤的發生、發展,與腫瘤的惡性生物學行為如增殖、遷移、凋亡、分化等相關[3]。lncRNA在腎癌中的作用日益受到關注[4]。XLOC-013014作為lncRNA家族的重要成員,長度為494個核苷酸,屬于基因內lncRNA,其在腫瘤特別是腎癌中所起的作用及下游分子通路有待進一步闡明。本研究旨在觀察XLOC-013014在腎癌組織和細胞中的表達,并通過轉染XLOC-013014質粒至腎癌細胞,探究XLOC-013014對腎癌細胞增殖和遷移的影響及其作用機制。
1 材料和方法
1.1 材料
37例腎癌組織和癌旁組織來源于2016年11月至2018年10月上海市徐匯區中心醫院泌尿外科手術切除的標本,保存于液氮中。患者術前均未接受過放化療,標本均經兩位以上病理專家確認,37例腎癌組織均為腎透明細胞癌。本研究經本院倫理委員會批準,患者均簽署知情同意書。腎癌細胞株(CaKi-1、786-O、A498、ACHN)和正常腎小管上皮細胞(HK-2)購自武漢典型培養物保藏中心,細胞均采用含10%胎牛血清(FBS)的DMEM培養基培養,培養條件為37 ℃、5%CO2。DMEM培養基和胎牛血清(FBS)購自美國Gibco公司。逆轉錄試劑盒和熒光實時定量聚合酶鏈反應(qPCR)試劑盒購自美國Fermentas公司。含有XLOC-013014全長的質粒和對照質粒購自上海捷瑞生物科技有限公司。轉染試劑LipofectamineTM2000 Reagent購自美國Invitrogen公司。Cell Counting Kit-8(CCK-8)試劑盒購自福州邁新生物技術開發有限公司。辣根過氧化物酶偶聯的羊抗兔二抗購自武漢博士德生物工程有限公司。一抗β-微管蛋白(β-Tubulin)、Kruppel樣轉錄因子2(KLF2)、磷酸化蛋白激酶B(p-AKT)、磷酸化雷帕霉素靶蛋白(p-mTOR)、蛋白激酶B(AKT)、雷帕霉素靶蛋白(mTOR)購自美國BD公司。
1.2 檢測方法
1.2.1 細胞轉染 將A498細胞接種6孔板,隨機分為對照組和實驗組,分別轉染對照質粒和含有XLOC-013014全長的質粒。當細胞匯合度達到70%融合時,根據LipofectamineTM2000 Reagent說明書通過瞬時轉染技術將脂質體和轉染質粒稀釋,稀釋液混勻靜置15 min,分別滴加至6孔板。轉染24 h后更換為新鮮培養基。
1.2.2 生物信息學預測靶基因 采用LncBase Predicted v.2在線預測軟件預測XLOC-013014的靶miRNA,采用TargetScan Release 3.1在線預測軟件預測相應miRNA的靶基因。
1.2.3 qPCR檢測XLOC-013014、miR-342-3p和KLF2 mRNA的表達 采用Trizol試劑提取腎癌組織和細胞中總RNA,反轉錄為cDNA作為模板。以GAPDH或U6為內參,分別檢測XLOC-013014、miR-342-3p和KLF2 mRNA的表達。根據qPCR試劑盒說明進行操作,反應條件為:95 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共35個循環,特異性引物序列見表1。

表1 qPCR特異性引物序列
1.2.4 Western blotting檢測KLF2蛋白及PI3K/AKT信號通路蛋白表達 A498細胞轉染48 h后,PBS溶液反復洗滌細胞3次,細胞裂解液在冰上裂解提取細胞總蛋白,每組取60 μg總蛋白,通過SDS-PAGE電泳分離后,半干法轉印至硝酸纖維素膜。5%脫脂牛奶室溫下封閉1 h。5%脫脂牛奶稀釋一抗(p-AKT、KLF2、p-mTOR、AKT、mTOR)和山羊抗兔二抗,一抗按1∶1 000進行稀釋,4 ℃孵育過夜。山羊抗兔二抗按1∶5 000進行稀釋,室溫下孵育1 h,洗膜后采用化學發光法曝光顯影,比較各組蛋白表達量。
1.2.5 CCK-8法檢測細胞增殖 A498細胞轉染48 h后,胰酶消化并使用無血清培養基制備單細胞懸液,分別以每孔4×103個細胞密度接種于96孔板,連續培養并檢測5 d。在每天相同時間點,每孔分別加入20 μl CCK-8溶液,培養4 h后,采用酶標儀讀取每孔在490 nm處的吸光度值。以時間為橫坐標,以吸光度值為縱坐標,繪制細胞生長曲線。
1.2.6 Transwell實驗檢測細胞遷移 A498細胞轉染48 h后,胰酶消化并使用無血清培養基制備單細胞懸液,將細胞密度調整為3×105個/ml,取每組200 μl細胞懸液加入Transwell小室的上室中,下室加入含10%胎牛血清的培養基600 μl,培養箱培養24 h。取出小室,采用甲醇固定30 min,采用結晶紫溶液染色30 min,PBS溶液沖洗。待小室基底膜風干后,每組在倒置顯微鏡下選取4個視野拍照并計數,取平均值比較不同組A498細胞遷移能力。
1.3 統計學處理
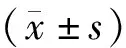
2 結果
2.1 腎癌組織和癌旁組織中XLOC-013014的表達
XLOC-013014在腎癌組織和癌旁組織中的相對表達分別為1.08±0.32和4.07±0.57,XLOC-013014在腎癌組織中的相對表達顯著少于癌旁組織,差異有統計學意義(P<0.01,見圖1)。

與癌旁組織相比,**P<0.01
2.2 腎癌細胞株中XLOC-013014的表達
XLOC-013014在腎癌細胞株(CaKi-1、786-O、A498、ACHN)和正常腎小管上皮細胞(HK-2)中的相對表達分別為0.80±0.02,0.34±0.03,0.11±0.01,0.62±0.04和1.00±0.05,XLOC-013014在腎癌細胞株中的相對表達均少于正常腎小管上皮細胞,差異有統計學意義(P<0.01),在A498細胞中的相對表達最低(P<0.01,見圖2)。

與HK-2相比,**P<0.01
2.3 生物信息學預測XLOC-013014的靶基因
采用LncBase Predicted v.2在線預測軟件預測XLOC-013014的靶基因是miR-342-3p,采用TargetScan Release 3.1在線預測軟件預測miR-342-3p的靶基因是KLF2(見圖3)。

圖3 生物信息學預測XLOC-013014的靶基因
2.4 兩組A498細胞中XLOC-013014、miR-342-3p和KLF2 mRNA的表達
對照組和實驗組A498細胞中XLOC-013014的相對表達分別為1.02±0.11和12.61±1.17,實驗組中XLOC-013014的相對表達顯著增加(P<0.01)。對照組和實驗組A498細胞中miR-342-3p的相對表達分別為1.00±0.04和0.24±0.06,實驗組中miR-342-3p的相對表達顯著減少(P<0.01)。對照組和實驗組A498細胞中KLF2 mRNA的相對表達分別為1.47±0.75和6.68±0.98,實驗組中KLF2 mRNA的相對表達顯著增加(P<0.01)。
2.5 KLF2和PI3K/AKT信號通路蛋白表達變化
對2.4中成功轉染XLOC-013014質粒的細胞系進行Western blotting檢測,細胞中KLF2蛋白表達升高,PI3K/AKT信號通路蛋白如p-AKT、p-mTOR表達降低,AKT、mTOR蛋白表達無明顯差異(見圖4)。

圖4 Western blotting檢測兩組細胞中KLF2蛋白及PI3K/AKT信號通路蛋白的表達
2.6 XLOC-013014對腎癌A498細胞增殖的影響
CCK-8法檢測兩組A498細胞的增殖能力,酶標儀檢測并繪制生長曲線。結果顯示,與對照組相比,實驗組A498細胞由第3天開始,細胞生長速度顯著減慢,差異有統計學意義(P<0.05,見圖5),提示XLOC-013014可以抑制A498細胞的增殖能力。

與對照組相比,*P<0.05
2.7 XLOC-013014對腎癌A498細胞遷移能力的影響
Transwell實驗檢測兩組A498細胞的遷移能力,對照組和實驗組A498細胞在24 h的穿膜細胞數分別為(153.60±20.34)個和(81.79±13.55)個,實驗組A498細胞遷移能力顯著少于對照組(P<0.05,見圖6),提示XLOC-013014可抑制A498細胞的遷移能力。

與對照組相比,*P<0.05
3 討論
長鏈非編碼RNA(long-chain non-coding RNA,lncRNA)由于不具有編碼蛋白的功能,起初被認為不具有生物學功能,只是基因組轉錄產生的“噪音”[5]。近年來的研究表明,lncRNA可在眾多層面如表觀遺傳水平、轉錄水平、轉錄后水平調控基因的表達,參與疾病包括腫瘤的發生、發展。lncRNA的異常表達與腫瘤的進展、轉移、防治、預后等密切聯系[6]。研究顯示,TP73-AS1[7]、ENSG00000241684[8]、FENDRR[9]、HOTTIP[10]等多條lncRNA在腎癌中異常表達,參與調控腎癌的惡性生物學行為,在腎癌發生發展中發揮至關重要的作用。XLOC-013014是真正意義的lncRNA,由于缺乏開放閱讀框,XLOC-013014無法作為編碼蛋白的模板,其在腎癌中的表達及其對腎癌細胞增殖、遷移的影響,目前尚無研究報道。本研究通過qPCR檢測腎癌組織和細胞中XLOC-013014的表達,發現XLOC-013014在腎癌組織和細胞中表達顯著降低,提示XLOC-013014可能成為一種新型的腎癌診斷標志物。在腎癌細胞系A498中,通過瞬時轉染技術轉入含有XLOC-013014全長的質粒,可顯著提高A498細胞中XLOC-013014的表達。
多項研究表明,LncRNA可通過“海綿樣”方式結合并下調多種miRNA的活性,進而調控miRNA靶基因的表達,介導腫瘤的表觀遺傳調控[5,11]。采用LncBase Predicted v.2在線預測軟件預測XLOC-013014的靶基因是miR-342-3p。通過高表達A498中XLOC-013014的表達,發現XLOC-013014表達增加后,miR-342-3p表達降低,XLOC-013014可能具有吸附并降低miR-342-3p表達的作用。采用TargetScan Release 3.1在線預測軟件預測miR-342-3p的靶基因是Kruppel樣轉錄因子2(KLF2)。KLF2基因定位于染色體10p13.1,由1 655個堿基組成[12]。KLF2蛋白作為KLF家族中重要的轉錄因子,由354個氨基酸組成,參與調控血管張力、血管形成、血管新生等重要過程,在維持血管穩態方面發揮重要[13,14]。近年來,KLF2在惡性腫瘤中的調控作用受到廣泛關注。KLF2在多種惡性腫瘤如胃癌、乳腺癌、結腸癌、肝癌中表達降低,發揮顯著的抗腫瘤作用[15-17]。本研究發現,miR-342-3p表達降低可顯著升高KLF2的表達,miR-342-3p可能對KLF2的表達發揮干擾作用。有研究表明,KLF2蛋白主要通過抑制PI3K/AKT信號通路的轉導,抑制腫瘤細胞的增殖和轉移[18]。A498細胞中KLF2蛋白表達升高后,PI3K/AKT信號通路蛋白如p-AKT、p-mTOR表達顯著降低,提示PI3K/AKT信號通路被阻滯。本研究進一步通過CCK-8法和Transwell實驗檢測表明,XLOC-013014表達增加后,A498細胞的增殖能力和遷移能力顯著降低,表明XLOC-013014可抑制A498細胞的體外增殖能力和遷移能力。
綜上所述,XLOC-013014在腎癌組織和細胞中呈低表達,XLOC-013014可通過“海綿樣”方式結合并抑制miR-342-3p的表達,從而間接促進KLF2基因的表達,阻滯PI3K/AKT信號通路的轉導,抑制腎癌細胞的增殖和遷移能力。XLOC-013014可能在腎癌發生、發展中發揮重要作用,具有成為腎癌潛在的新的分子靶標的價值。

