miRNA103在高磷誘導的血管平滑肌細胞鈣化中的作用
何 雷,徐金升,白亞玲,張慧然,周 薇,張勝雷,劉 蘭,張彤彤
(河北醫科大學第四醫院腎內科,石家莊 050011;*通訊作者,E-mail:xjs5766@126.com)
血管鈣化(vascular calcification,VC)與心血管疾病和慢性腎臟病患者的死亡率有關[1],且在慢性腎臟病患者全因死亡率中占第一位[2]。血管鈣化是一個復雜的過程,涉及不同的分子途徑,而血管平滑肌細胞(vascular smooth muscle cells,VSMCs)在血管鈣化的形成和發展中具有重要的作用[3,4]。研究顯示,VSMCs鈣化與成骨信號通路有關[5],此外,成骨信號通路和VC的主要特征是核心轉錄因子2(Runx2)的特異性上調[6]。研究發現,miRNAs通過參與VSMCs向成骨樣細胞的轉分化,進而參與血管鈣化[7]。miR-103是miR-15/107家族的一員,在人體組織中廣泛表達[8]。miRNAs數據庫基因預測分析miR-103參與血管鈣化的發生發展。且已有報道顯示,miR-103能夠抑制動脈粥樣硬化的進展[9]。我們推測miR-103在細胞轉分化中起一定作用,進而影響血管鈣化。為此,本研究以體外培養的大鼠VSMCs為研究對象,探討miR-103在高磷誘導的大鼠VSMCs鈣化發生過程中的作用及可能機制。
1 材料與方法
1.1 主要試劑
β-甘油磷酸購自Sigma公司;DMEM培養液及胎牛血清均購自Gibco公司;RNA提取及反轉錄試劑盒均購自Thermo Fisher公司;實時熒光定量PCR試劑購自廣州易錦公司;miR-103的類似物與抑制物購自銳博公司;茜素紅S染料購自Solarbio公司;堿性磷酸酶測定試劑盒購自南京建成生物公司;鈣含量測定試劑盒購自中生北控生物科技股份有限公司;堿Runx2抗體購自Abcam公司;GAPDH抗體購自Bioworld公司。
1.2 實驗模型的制備與分組
取4周齡、體質量約80-100 g的清潔級雄性健康SD大鼠(由河北醫科大學實驗動物中心提供,合格證編號:1305090)。體外分離大鼠胸主動脈,并將血管剪成1 mm×1 mm×1 mm大小的組織塊,采用組織貼壁法,將組織塊貼于瓶底,進行原代培養,傳代至第3-4代,將細胞分為正常組和高磷組(給予10 mmol/L β-甘油磷酸鹽,HP組),刺激4 d后,檢測VSMCs的鈣化情況、ALP活性,及miR-103和Runx2的表達情況。為進一步驗證miR-103對VSMCs的作用,分為6組:正常組,完全培養基;NC inhibitor組,轉染抑制物的對照NC inhibitor;miR-103 inhibitor組,轉染抑制物miR-103 inhibitor;高磷組(HP),高磷環境細胞未轉染;NC mimic+HP組,高磷環境轉染類似物的對照(NC mimic);miR-103 mimic+HP組,高磷環境轉染類似物miR-103 mimic。轉染后72 h,測定VSMCs的鈣化情況、ALP活性,及miR-103和Runx2的表達情況。
1.3 茜素紅鈣化染色
將12孔板內培養的第3代VSMCs給予干預后棄去上清,用95%乙醇室溫固定20-30 min,茜素紅染液(pH8.4,濃度為0.1%)染色1 h,倒置顯微鏡下觀察并記錄。結果判斷標準:橘紅色結節為鈣鹽沉積。
1.4 細胞鈣含量測定
12孔板內培養的VSMCs給予干預后棄去上清,加入1 mol/L的鹽酸37 ℃脫鈣過夜,取上清液,使用鄰甲酚酞絡合酮比色法測定鈣含量,細胞用0.1 mol/L氫氧化鈉溶液和0.1%十二烷基硫酸鈉溶解30 min,使用BCA法測定各組細胞蛋白質含量,結果用蛋白含量校準(mg/g蛋白)。
1.5 ALP活性測定
將培養的VSMCs棄上清,磷酸鹽緩沖溶液沖洗2次,加入1%聚乙二醇辛基苯基醚生理鹽水,置于4 ℃冷藏24 h后離心,取上清液,測定其活性,結果用蛋白質校準(U/g)。
1.6 實時熒光定量檢測Runx2表達
提取刺激后VSMCs的miRNA和mRNA,測定miRNA及Runx2的表達。miR-103及5s引物由銳博公司提供,5s為內參,反應條件:預變性95 ℃ 10 min;變性95 ℃ 10 s;退火60 ℃ 20 s;延伸72 ℃ 10 s。Runx2 mRNA PCR引物由Primer 5.0軟件設計,引物序列見表1。GAPDH為內參,反應條件:即預變性95 ℃ 10 min;變性95 ℃ 20 s;退火60 ℃ 30 s;延伸72 ℃ 20 s。記錄數據,實驗重復3次。
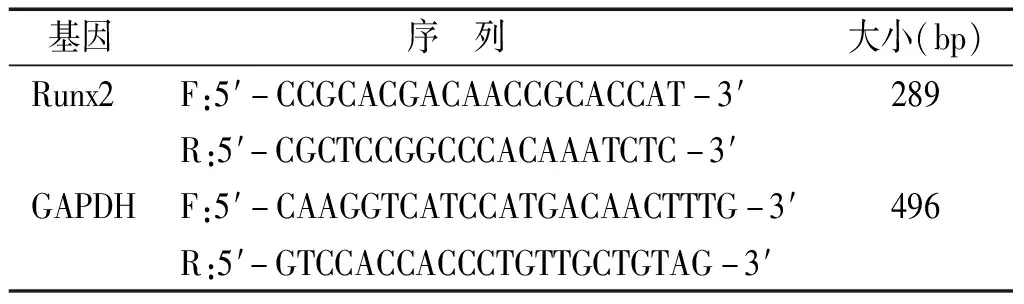
表1 引物序列
1.7 Western印跡法檢測VSMCs目的蛋白表達
提取各組細胞蛋白,測定Runx2蛋白的表達。取50 μg蛋白質加入10%的SDS-聚丙烯酰胺凝膠中,恒壓95 V電泳1.5 h,恒壓95 V轉膜1 h,牛奶封閉1 h,加入一抗稀釋液(Runx2 1∶500,GAPDH 1∶5 000),4 ℃孵育過夜。次日洗膜,放入二抗稀釋液(1∶5 000),室溫下孵育1 h,于蛋白成像儀上顯色。實驗重復3次。
1.8 統計學方法
2 結果
2.1 高磷可以引起VSMCs鈣化增加
2.1.1 VSMCs茜素紅染色及鈣含量測定 茜素紅染色顯示,高磷組較正常組的橘紅色鈣化結節顯著增多;鈣含量結果顯示,高磷組VSMCs的鈣含量顯著升高(P<0.05,見圖1)。
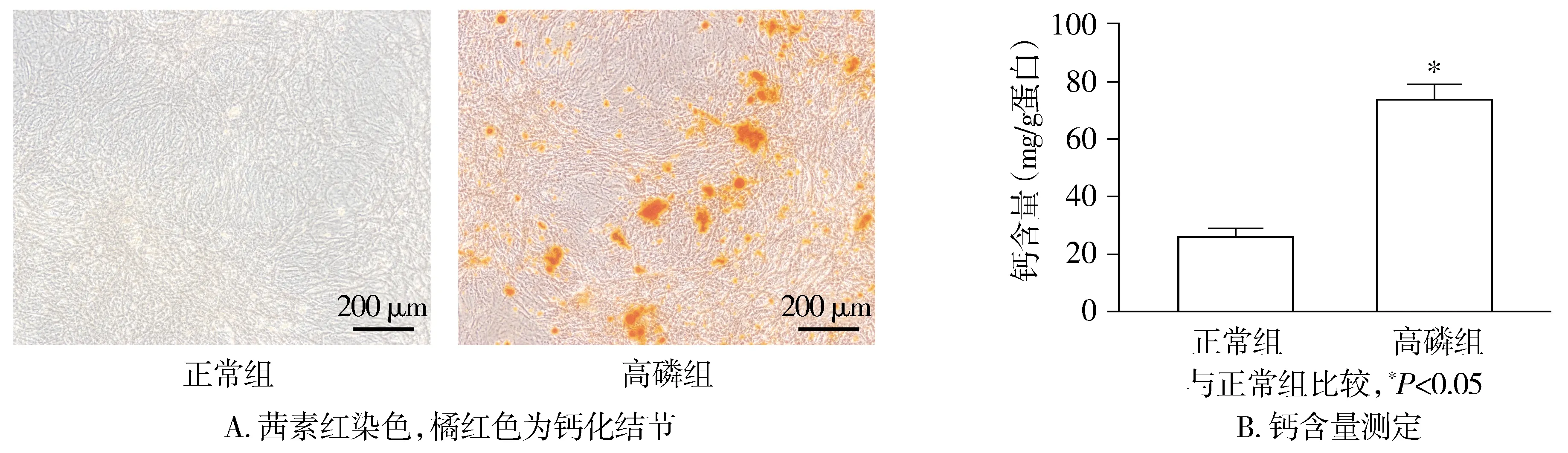
圖1 兩組VSMCs鈣化的表達情況
2.1.2 高磷引起大鼠VSMCs Runx2表達升高和ALP活性增加 實時熒光定量PCR和Western結果顯示,與正常組比較,給予β-GP干預后,高磷組Runx2 mRNA及蛋白表達均升高(P<0.05),ALP活性顯著增強(P<0.05,見圖2)。
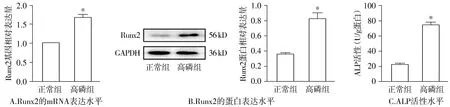
與正常組比較,*P<0.05
2.2 高磷引起大鼠VSMCs miR-103表達降低
實時熒光定量PCR結果顯示,與正常組比較,給予β-GP干預后,高磷組的miR-103的表達顯著下降(P<0.05,見圖3)。
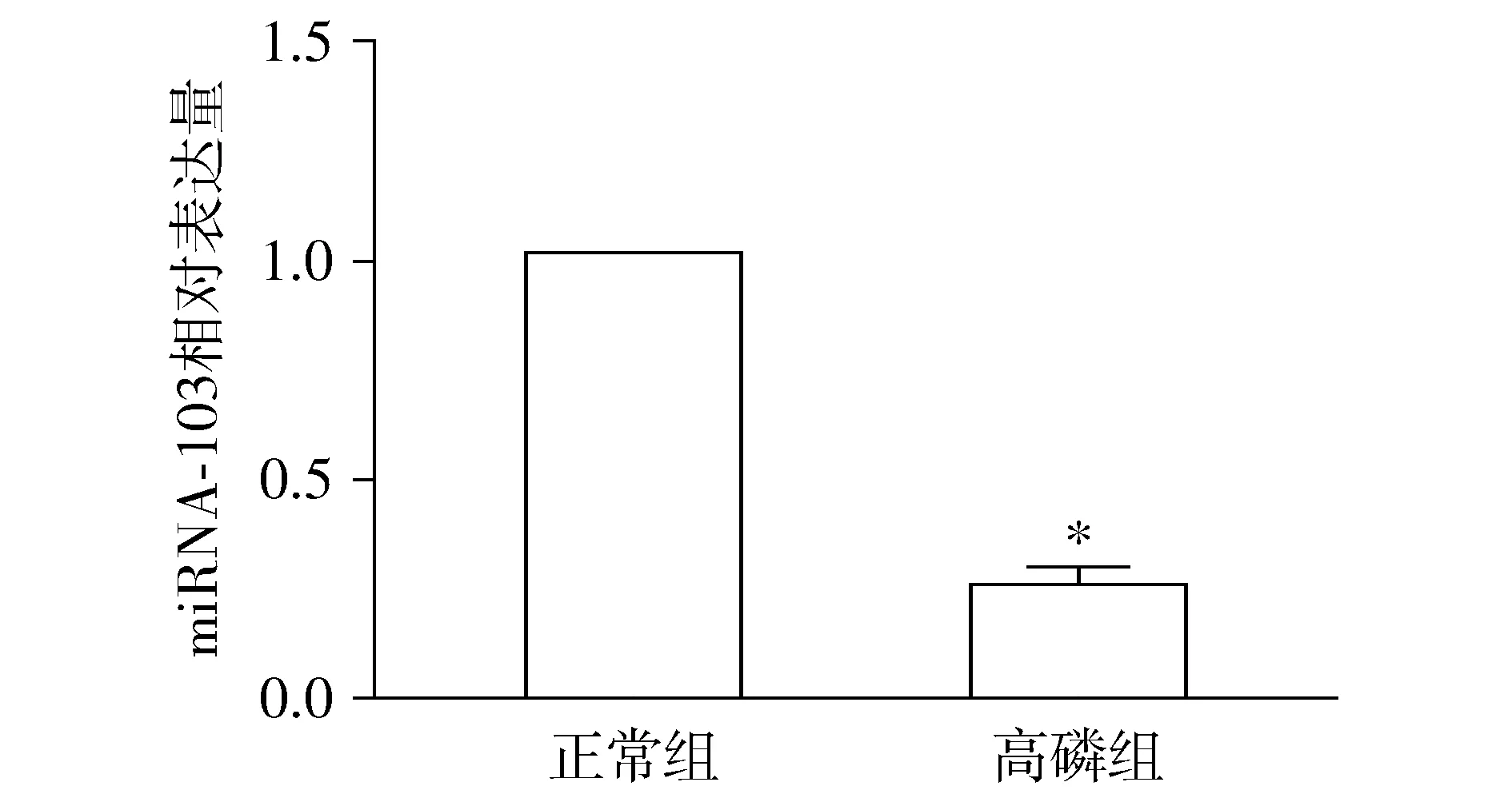
與正常組比較,*P<0.05
2.3 miR-103導致VSMCs鈣化降低
2.3.1 miR-103對VSMCs茜素紅染色及鈣含量測定的影響 茜素紅染色顯示,與NC inhibitor組比較,miR-103 inhibitor組橘紅色鈣化結節顯著增多,鈣離子含量顯著升高(P<0.05);與NC mimic+HP組相比,miR-103 mimic+HP組的橘紅色鈣結節顯著減少,鈣離子含量顯著降低(P<0.05,見圖4)。
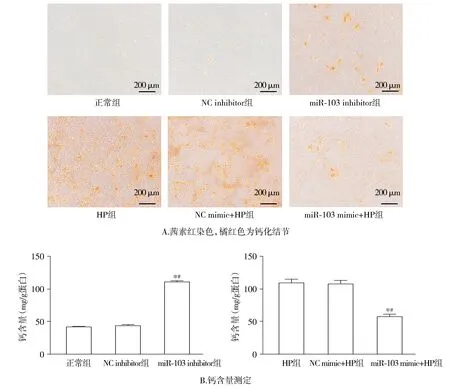
與正常組或高磷組比較,*P<0.05;與相應的NC組比較,#P<0.05
2.3.2 miR-103導致VSMCs Runx2表達降低和ALP活性降低 實時熒光定量PCR和Western印跡結果顯示,與NC inhibitor組比較,miR-103 inhibitor組的Runx2表達水平顯著升高(P<0.05);與NC mimic+HP組比較,miR-103 mimic+HP組的Runx2表達水平顯著降低(P<0.05,見圖5)。ALP活性測定結果顯示:與NC inhibitor組比較,miR-103 inhibitor組的ALP活性顯著升高(P<0.05);與NC mimic+HP組比較,miR-103 mimic+HP組的ALP活性顯著降低(P<0.05,見圖6)。
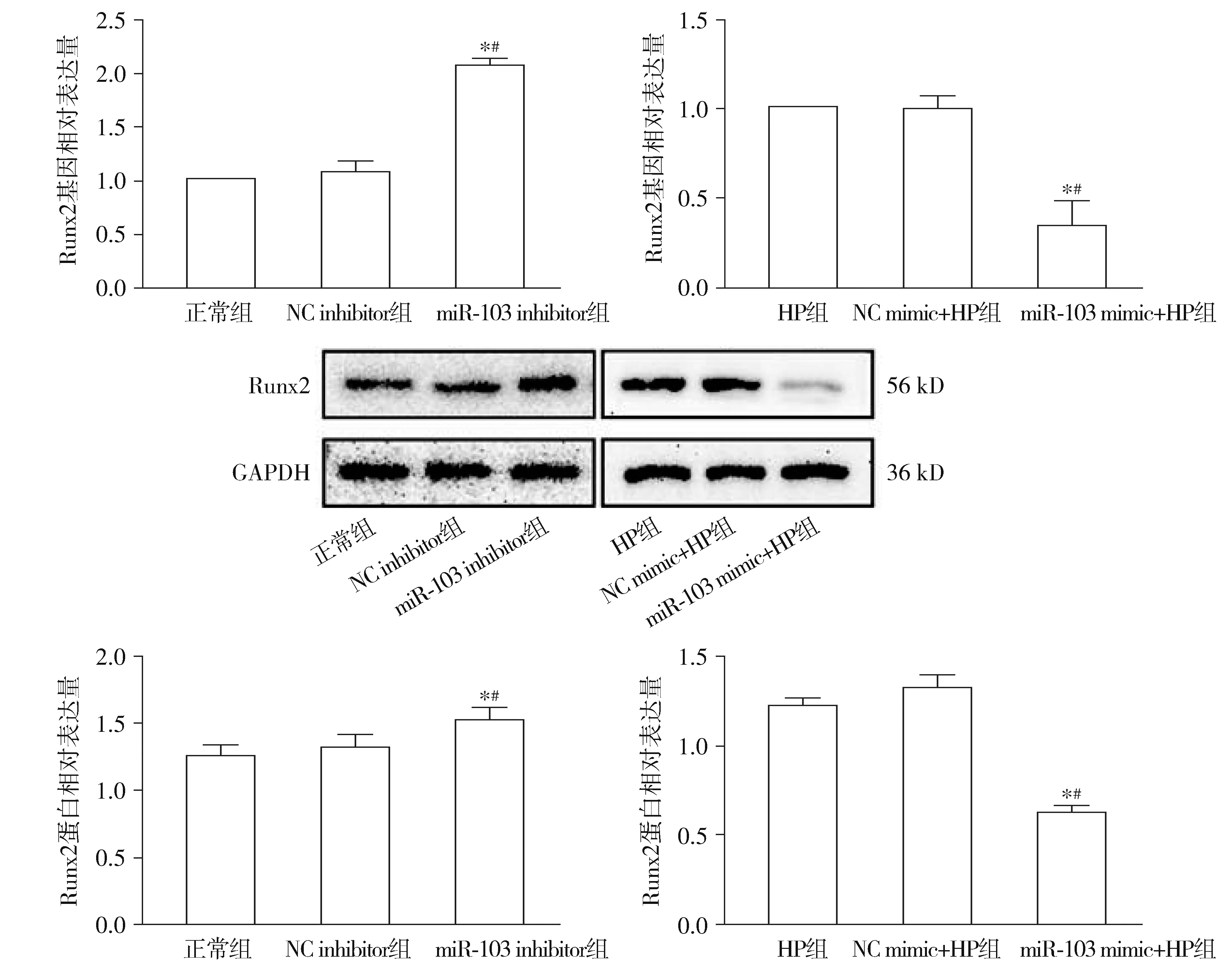
與正常組或高磷組比較,*P<0.05;與相應的NC組比較,#P<0.05
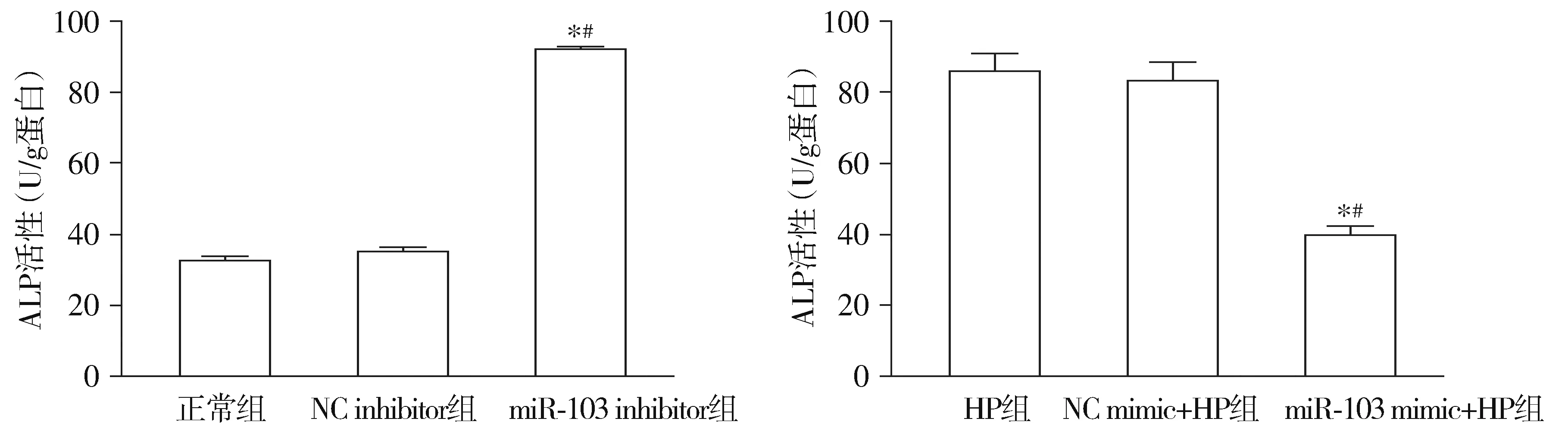
與正常組或高磷組比較,*P<0.05;與相應的NC組比較,#P<0.05
3 討論
血管鈣化是慢性腎臟病患者心血管疾病發病率高的主要原因[10]。高磷血癥是導致血管中膜鈣化的重要危險因素,VSMCs是血管中膜的重要組成成分[11]。研究表明,VSMCs鈣化發生的重要機制之一是VSMCs的表型轉化[5]。本研究通過體外培養原代大鼠VSMCs,發現高磷可誘導VSMCs發生鈣化,可能是通過抑制miR-103表達,促進了VSMCs表型轉化,進而促進了VSMCs鈣化。
鈣磷代謝紊亂時,VSMCs由收縮表型轉化為成骨/軟骨細胞樣表型來介導血管鈣化[12]。成骨轉錄因子Runx2和礦化調節蛋白ALP的特異性上調是成骨和VC的主要特征。因此Runx2是VSMCs發生表型轉化的標志,而ALP是血管鈣化發生的經典生物標志物[13,14]。本研究證明了給予高磷刺激,可以誘導VSMCs鈣化,促進Runx2表達,增加ALP活性,提示高磷可以誘導VSMCs發生表型轉化,進而引起VSMCs鈣化。
有研究證明miRNAs通過參與血管平滑肌細胞向成骨細胞樣細胞的轉分化而參與血管鈣化[6]。miR-103屬于miR-15/107家族,是一種進化保守的miRNA,在人體正常組織中廣泛表達,并參與癌癥及炎癥等疾病的發展[15]。研究顯示,miR-103可負性調節SATB同源盒2,抑制人骨髓間充質干細胞的增殖和成骨分化[16]。本研究顯示高磷環境,miR-103表達下調,提示高磷環境可抑制miR-103表達。為進一步證明miR-103對VSMCs的影響,本研究在VSMCs中給予了轉染miR-103的類似物與抑制物。結果顯示,給予miR-103抑制物后VSMCs鈣化增加,且Runx2表達和ALP活性均升高;高磷環境給予miR-103類似物后VSMCs鈣化減低,且Runx2表達和ALP活性均顯著降低。進一步證明了miR-103可負向調節Runx2表達,在VSMCs鈣化過程中起抑制作用。
綜上所述,高磷可誘導VSMCs鈣化,可能機制之一是高磷通過抑制VSMCs中miRNA-103表達,促進Runx2表達,從而誘導VSMCs表型轉化,進而促進VSMCs鈣化的發生。

