升降散加減方治療IgAN大鼠作用機制探討
張圓圓 靳培培 郭登洲
IgA腎病(immunoglobulin a nephropathy,IgAN)是指以IgA或以IgA為主的免疫復合物沉積于腎小球系膜區,臨床表現以血尿,伴或不伴蛋白尿為主的病理綜合征[1]。IgAN治療方面,西醫多以血管緊張素轉換酶抑制劑、血管緊張素受體拮抗劑控制血壓、減少尿蛋白,應用糖皮質激素、免疫抑制劑等治療為主,而傳統中醫雖對IgAN沒有明確的記載,但根據其臨床表現將其歸于“尿血”“腰痛”“水腫”“虛勞”等疾病的范疇,以其獨特的理論作指導來辨證論治本病,如《血證論·尿血》中提到“膀胱與血室并域而居,熱入血室則蓄血,熱結膀胱則尿血,尿乃水分之病,而亦干動血分者,以與血室并居,故相連累也”。可見濕熱常見于IgAN的發生發展過程中。本實驗通過觀察疏通三焦、清熱利濕理論指導的升降散加減方對IgAN大鼠24小時尿蛋白定量(24 hours urinary total protein,24h-UTP),血清肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)、血清白蛋白(albumin,ALB)、轉化生長因子β1(transforming growth factor β1,TGF-β1)、白細胞介素-6(interleukin-6,IL-6)、半乳糖缺乏的IgA(galactose deficient IgA,Gd-IgA)表達水平的影響以及IgAN大鼠腎臟組織病理的變化,來了解升降散加減方可能的作用機制,為臨床治療本病提供實驗理論依據。
1 材料與方法
1.1 動物與藥物
于河北醫科大學動物實驗中心購進48只雄性SD大鼠,健康清潔級,體重(150±10)g,動物合格證編號:1805044,許可證號:SCXK(冀)2013-1-003。
升降散加減方組成:僵蠶15 g、蟬蛻15 g、杏仁12 g、陳皮12 g、茯苓15 g、炒萊菔子12 g、黃芪15 g,購自河北省中醫院中藥房,以上藥物先經蒸餾水浸泡2小時,煎煮2次(40分鐘/次)后,過濾,合并濾液加熱蒸發,依據陳奇大鼠與人藥物劑量折算方法再分別濃縮至含生藥1 g/mL水提液,制成藥液備用,每次根據老鼠體重灌服。鹽酸貝那普利片由北京諾華制藥有限公司提供。
1.2 試劑與部分儀器
牛血清白蛋白(bovine serum albumin,BSA),購自北京索萊寶科技有限公司;脂多糖(lipopolysaccharide,LPS),購自北京索萊寶科技有限公司;四氯化碳(CCl4),購自北京索萊寶科技有限公司;蓖麻油,購自北京索萊寶科技有限公司。
尿液分析儀(美國CLINITEK50)(全自動洗板機8×12,美國)、全自動生化分析儀(Japan,Sysmex HEMIX-180)、離心機(上海安亭,TDL-5-A)、實時熒光定量PCR儀(BIO-RAD CFX96)、酶標儀(Thomer Fisher MK FC)、電熱恒溫水箱(600型,天津泰斯特)等。
1.3 造模與分組給藥
將SD大鼠隨機分為正常組12只、造模組36只,進行1周適應性喂養,采用聯合BSA灌胃+尾靜脈注射LPS+皮下注射CCl4、蓖麻油的免疫復合的方法建立實驗性IgAN模型,方案如下:口服免疫原BSA劑量較常用劑量增加1倍,以600 mg/kg隔天灌胃,持續6周;CCl4注射方式由既往的腹腔注射改為皮下注射,皮下注射蓖麻油0.5 mL+CCl40.10 mL,每周1次,持續9周,并聯合運用LPS,分別于第6、8周尾靜脈注射LPS 0.05 mg。模型制作成功后,將造模組大鼠隨機分成中藥組、西藥組和模型組各12只。中藥組每日灌服中藥,西藥組每日灌服1.8 mg/kg鹽酸貝那普利,模型組、正常組給予等量蒸餾水灌胃,每日1次,共8周。
1.4 采集標本與檢測指標
1.4.1 24h-UTP檢測 分別于實驗第1、9、15、19周留取24小時尿液,用全自動生化分析儀檢測,并記錄好相關數據。
1.4.2 血清指標檢測 實驗19周后,禁食12小時,禁水4小時,腹腔注射麻醉后(10%水合氯醛3.5 mL/kg),采用股動脈采血,運用全自動生化分析儀測定Scr、BUN、ALB等指標;運用ELISA法檢測血清中TGF-β1、IL-6、Gd-IgA的含量。
1.4.3 腎組織鏡檢及免疫熒光檢查 大鼠股動脈取血后,立即將大鼠腎臟分離,將切取的腎組織用4%的多聚甲醛液進行固定,用于蘇木精—伊紅染色(hematoxylin-eosin staining,HE)、馬松染色(Masson staining,Masson)、過碘酸雪夫氏染色(schiff periodic scid shiff,PAS)、過碘酸—銀—烏洛托品(Perioddic acid silver meth enamine,PASM)常規染色的光鏡制備使用;將一部分腎臟組織迅速制成冰凍切片,用于進行免疫熒光檢測;取大小為1 mm×1 mm的腎組織于4%的戊二醛固定液中用以進行透射電鏡樣本制備。
1.5 統計學處理

2 結果
2.1 各組大鼠的一般情況
正常組大鼠毛色光亮,精神、攝食、飲水均正常,體重逐漸增加;模型組、中藥組、西藥組大鼠在造模階段出現毛色亮度降低,精神不振,進食減少,體重增加緩慢;而藥物干預治療后,中藥組、西藥組大鼠上述癥狀有所恢復。
2.2 各組大鼠24h-UTP檢測結果
實驗第1周,各組實驗大鼠尿蛋白均為陰性,組間比較無統計學差異(P>0.05)。實驗第9周,與正常組相比,模型組、中藥組、西藥組實驗大鼠24h-UTP均增高,差異有統計學意義(P<0.05)。第15、19周,與正常組相比,模型組實驗大鼠24h-UTP升高,差異有統計學意義(P<0.05);與模型組相比,中藥組、西藥組實驗大鼠24h-UTP均降低,差異有統計學意義(P<0.05); 與西藥組相比,中藥組大鼠24h-UTP 無統計學差異(P>0.05)。見表1。

表1 各組IgAN大鼠24h-UTP的變化比較
2.3 各組大鼠血清指標檢測結果
與正常組相比,各組實驗大鼠血清中Scr、BUN、ALB的含量無統計學差異(P>0.05);與模型組相比,中藥組、西藥組實驗大鼠血清中Scr、BUN、ALB的含量無統計學差異(P>0.05);與西藥組比較,中藥組實驗大鼠血清中Scr、BUN、ALB的含量無統計學差異(P>0.05)。見表2。

表2 各組IgAN大鼠血清Scr、BUN和ALB的比較
2.4 光鏡觀察各組大鼠腎臟結構
正常組大鼠腎小球等形態結構均正常,基底膜、系膜細胞、間質細胞及胞外基質未見異常病理改變,無間質炎性細胞浸潤,血管腔清晰;模型組大鼠腎小球呈代償擴張和萎縮病變,系膜細胞和內皮細胞呈中重度增生,系膜基質表現為彌漫性增寬增厚,腎小管間質炎性細胞浸潤,呈間質纖維化,毛細血管袢阻塞;西醫組、中藥組大鼠光鏡下腎組織病理改變與模型組相似,但較模型組病理損傷較輕。見圖1~4。
2.5 電鏡觀察各組大鼠腎臟系膜區
正常組大鼠腎小球系膜區清晰,無電子致密物,基質分布均勻,足突排列有序,大小相等,基底膜厚度一致;模型組系膜細胞增生,基質增多,系膜區散在高密度電子致密物沉積,足細胞可見足突節段性融合、絨毛變性;西藥組、中藥組大鼠電鏡下見少量電子致密物沉積系膜區,足突輕度融合或不明顯,腎小球系膜細胞輕度增生,西藥組、中藥組大鼠電鏡下病理損傷較模型組有所減輕。見圖5。

注: A:正常組;B:模型組;C:西藥組;D:中藥組。

注: A:正常組;B:模型組;C:西藥組;D:中藥組。

注: A:正常組;B:模型組;C:西藥組;D:中藥組。

注: A:正常組;B:模型組;C:西藥組;D:中藥組。

注: A:正常組;B:模型組;C:西藥組;D:中藥組。

注: A:正常組;B:模型組;C:西藥組;D:中藥組。
2.6 免疫熒光法觀察各組大鼠腎臟腎小球系膜區
正常組大鼠無免疫復合物沉積于腎小球系膜區;模型組大鼠有團塊狀免疫復合物沉積于腎小球系膜區;西藥組、中藥組大鼠有不同程度的免疫復合物沉積于腎小球系膜區,但沉積量較模型組少。見圖6。
2.7 ELISA法檢測各組大鼠血清中TGF-β1、IL-6、Gd-IgA的含量
與正常組相比,模型組大鼠血清中TGF-β1、IL-6、Gd-IgA含量均明顯升高,差異有統計學意義(P<0.05);與模型組相比,西藥組、中藥組大鼠血清中TGF-β1、IL-6、Gd-IgA含量均下降,差異有統計學意義(P<0.05);與西藥組相比,中藥組大鼠血清中TGF-β1、IL-6、Gd-IgA差異無統計學意義(P>0.05)。見表3。
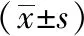
表3 各組IgAN大鼠血清中TGF-β1、IL-6 和Gd-IgA的比較
3 討論
3.1 檢測指標選擇依據
IgAN發病機制復雜,而免疫致病機制為本病的重要致病機制。IgAN的首要發病機制為IgA1異常糖基化[2]。IgA1分子正常的情況下有獨特的鉸鏈區結構,在鉸鏈區中有多個蘇氨酸、絲氨酸殘基,此為O糖基化的連接位,IgA1分子O糖基化過程中,N-乙酰半乳糖胺(GalNAc)在N-乙酰半乳糖胺轉移酶的作用下與絲氨酸、蘇氨酸連接形成O糖基化的基本結構,半乳糖(Gal)在C1GalT1和分子伴侶Cosmc的催化作用下與GalNAc連接,N-乙酰神經氨酸在α-2,6唾液酸轉移酶(ST6GALNAC2)或α-2,3唾液酸轉移酶(ST3GAL)的作用下與GalNAc或Gal連接形成糖鏈[3]。而在產生IgA1的細胞中,GalNAc的唾液酸僅由ST6GALNAC2催化。IgA1分子的O-連接聚糖形成過程中,若IgA1分子鉸鏈區O -糖基化程度降低,缺乏半乳糖的GalNAc上直接連接唾液酸,此時形成的多聚糖無法被修飾則產生了Gd-IgA1,而Gd-IgA1與IgAN的發生相關[4]。Gd-IgA1可使IgA1易于自身聚集,或形成免疫復合物沉積于腎小球系膜區,此為IgA的主要發病原因[5]。Robert等[6]認為只要影響到糖基化的酶,就可能影響IgA1糖基化,C1GalT1、ST6GALNAC2即為上述過程中的關鍵酶。影響這2種酶表達或活性的因素,即能使 C1GalT1活性低并且(或者)使ST6GALNAC2活性增強就會使IgA1異常糖基化。最新研究發現, TGF-β通過下調C1GalT1和Cosmc的 mRNA水平來影響二者的產生[7]。IL-6在IgAN 患者的血清中含量升高,會降低Cosmc和C1GalT1的表達,進而影響IgA1的糖基化[8-9]。此外,IL-6還能增加ST6GalNAcⅡ 的表達。
3.2 疏通三焦,清熱利濕理論依據
IgA腎病在中醫上屬于“水腫”“血尿”等范疇,根據陳香美等[10]制作的大樣本IgAN患者中醫證候的流行病學調查顯示IgAN患者主要以“濕熱”“血瘀”兩種證候為主(31.6%、28.9%)。時振聲教授[11]也認為濕熱是導致腎病發生的主要病因病機。人體水液代謝與肺、脾、腎、三焦關系密切,肺主通調水道;脾主運化水液;腎主水,調節體內水液的潴流、分布、排泄,三焦是水液運行的通道,其中脾居中焦,主運化水液,是水液代謝的樞紐。當各種病理因素,如七情內傷等致使脾的運化受損,則會引起水液停聚為濕邪,此時若機體正氣虧虛感受外邪則會化生濕熱。濕為陰邪,其性重濁黏滯,易襲陰位,故而侵犯下焦,腎為五臟之下極,故最易受之。此外,濕邪日久亦可化熱,而濕熱可循水液運行三焦,引起肺、脾、腎三臟功能失調:濕熱壅塞上焦,則肺失宣發肅降,氣化失司,故見肢體水腫;濕熱壅塞中焦,脾失健運,中焦運化水液失司,引起惡性循環,加重濕熱;濕熱壅塞下焦,腎失封藏,五臟六腑所藏之精不固而下泄,故可見蛋白尿,濕熱蘊結于膀胱,灼傷脈絡可見血尿。
郭登洲教授結合多年臨床治療經驗及目前研究共識,認為濕熱為本病的重要病因[12-14],而“血瘀”貫穿于IgA腎病的發生、發展整個過程中。其病機為脾胃虛弱導致水液運化失司,水液停聚,日久化熱,從而影響脾胃的正常運化,致使濕熱更勝;濕熱下注,累及下焦,水熱互結,損傷腎臟,使血溢出脈外,出現血尿,日久致使腎臟出現病理變化;同時濕熱日久,耗傷陰液,陰虧血耗,則血行遲緩,瘀血內生;“濕熱”“血瘀”兩者相互影響,共同促進疾病的發展,加重腎臟組織的損傷。因此筆者團隊認為“濕熱內蘊,瘀血阻絡”是IgAN基本證候。因此治療上當以疏通三焦,清熱利濕為原則,方用升降散加減方使三焦通暢,濕熱得以清利,從而使疾病得到有效控制以期達到治愈。
3.3 升降散加減方用藥分析
升降散加減方由僵蠶、蟬蛻、杏仁、陳皮、茯苓、炒萊菔子、黃芪組成。其中僵蠶氣輕味浮,可祛風散結,宣發氣機,開其濕熱郁結;僵蠶、蟬蛻,生發清陽以宣發諸身氣機,使郁結得開,氣機暢達;杏仁開上焦肺氣,肺宣濕開,則熱隨濕去;以陳皮通調中焦氣機,使氣機調達,給濕邪以去處;茯苓、炒萊菔子利濕通腑導下焦濕熱,使下焦通暢;黃芪補氣之不足,諸藥合用疏利三焦、清利濕熱。氣充則化濕利水,正氣足而邪不可干。課題組運用升降散加減方治療IgAN,對于減輕血尿、蛋白尿確有實效,在此基礎上進行了前期臨床觀察,結果表明升降散加減方有助于減低終點事件的發生,減少血尿、蛋白尿,治療IgAN療效確切[15],這也進一步證明了濕熱在IgAN發病過程中起重要作用。
綜上,疏通三焦、清熱利濕理論指導下的升降散加減方可減輕IgAN大鼠腎臟的病理變化,其降低尿中蛋白及減輕腎臟病理變化的效果與貝那普利相當。可見本方對IgAN大鼠有治療作用,其作用機制可能與降低血清中TGF-β1、IL-6、Gd-IgA的含量有關。

