基于TCGA數據庫分析FNDC3B基因在胰腺癌中的表達及預后意義
洪俊強,孔祥泉,杜開新,羅水英,林小藝,羅惠煌,連舒晴,廖雪洪
1.福建醫科大學附屬廈門弘愛醫院放療科,福建廈門 361000;2.福建省龍巖市第一醫院放療科,福建龍巖 364000;3.廈門大學附屬中山醫院病理科,福建廈門 361000
胰腺癌是一種常見的消化系統腫瘤,惡性程度高,預后差,5年生存率僅為9%,只能通過手術來治愈[1]。早期發病的時候常常沒有任何癥狀[2-3],90%以上的胰腺癌患者就診時已是中晚期,通常需要各個學科的綜合治療[4]。胰腺癌異質性很高,利用分子分型可以更好地預測腫瘤預后,制定有效的治療策略,提高患者的生存率[5]。FNDC3B是癌癥組織中最常見的上調基因之一,與癌癥類型和腫瘤起源無關[6]。研究表明,FNDC3B在乳腺癌、食管癌、膠質母細胞瘤和肝細胞癌中高表達,并與癌細胞增殖、侵襲和轉移有關[7-11]。然而,FNDC3B在胰腺癌中的作用研究至今未見報道。因此,該研究將探索FNDC3B在胰腺癌細胞中所起的作用。基于對腫瘤基因組圖譜(the cancer genome atlas,TCGA)數據庫的深入分析,探討FNDC3B在胰腺癌中的表達水平與臨床病理特征、預后的關系,并尋找調控FNDC3B的信號通路。現報道如下。
1 資料與方法
1.1 一般資料
從TCGA網站下載關于胰腺癌的基因表達數據及信息,并規范化原始測序數據,通過基因作圖進行注釋,最終一共篩選了141個胰腺癌樣本,均含有FNDC3B表達水平和完整的臨床信息,根據FNDC3B的表達量中位數將樣本分為FNDC3B低表達組(69例)及FNDC3B高表達組(72例)。利用The Human Protein Atlas網站,下載胰腺癌腫瘤組織中FNDC3B免疫組化染色的圖片。見圖1。
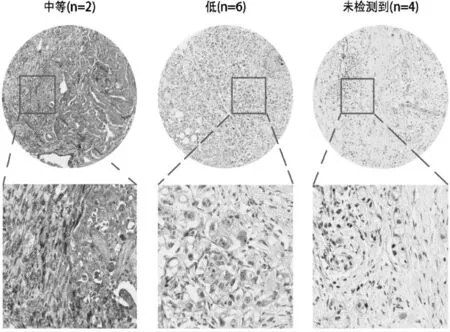
圖1 胰腺癌組織中FNDC3B免疫組化學表達情況(SP×400)
1.2 方法
使用GSEA 4.0.3軟件按照默認的加權富集統計方式進行基因富集分析 (gene set enrichment analysis,GSEA),隨機組合次數設為100次。將FNDC38基因的表達作為表型標記,根據P值、標準化富集評分對每個表型的富集途徑進行排序。
1.3 統計方法
采用SPSS 22.0統計學軟件進行數據處理,FNDC3B高表達組和FNDC3B低表達組的臨床病理參數均以(%)表示,采用卡方檢驗;采用Kaplan-Meier法對胰腺癌患者進行生存分析,采用Log-Rank檢驗、Cox回歸模型分析胰腺癌患者預后的影響因素;P<0.05為差異有統計學意義。
2 結果
2.1 入組對象的基本特征分析
在納入的141例胰腺癌患者中,年齡≤60歲45例(31.9%),>60歲96例(68.1%);男81例(57.4%),女60例(42.6%);T分期T1+T2為24例(17.0%),T3+T4為117例(83.0%);N分期N0為40例(28.4%),N1為101例(71.6%);TNM分期Ⅰ期+Ⅱ期為134例(95.0%),Ⅲ期+Ⅳ期為7例(5.0%);腫瘤大小<5 cm有118例(83.7%),≥5 cm有23例(16.3%);組織學分級G1+G2有96例(68.1%),G3+G4有45例(31.9%);其中,97例(68.8%)患者接受分子靶向治療,38例(27.0%)患者接受放射治療。中位生存時間15.4個月。
2.2 FNDC3B高表達水平與低表達水平臨床病理特征對比
FNDC3B高表達水平與FNDC3B低表達水平在胰腺癌患者的N分期方面,差異有統計學意義(P<0.05),FNDC3B高表達水平與FNDC3B低表達水平在胰腺癌患者的年齡、性別、T分期、TNM分期、腫瘤大小及腫瘤分級方面,差異無統計學意義(P>0.05),見表1。
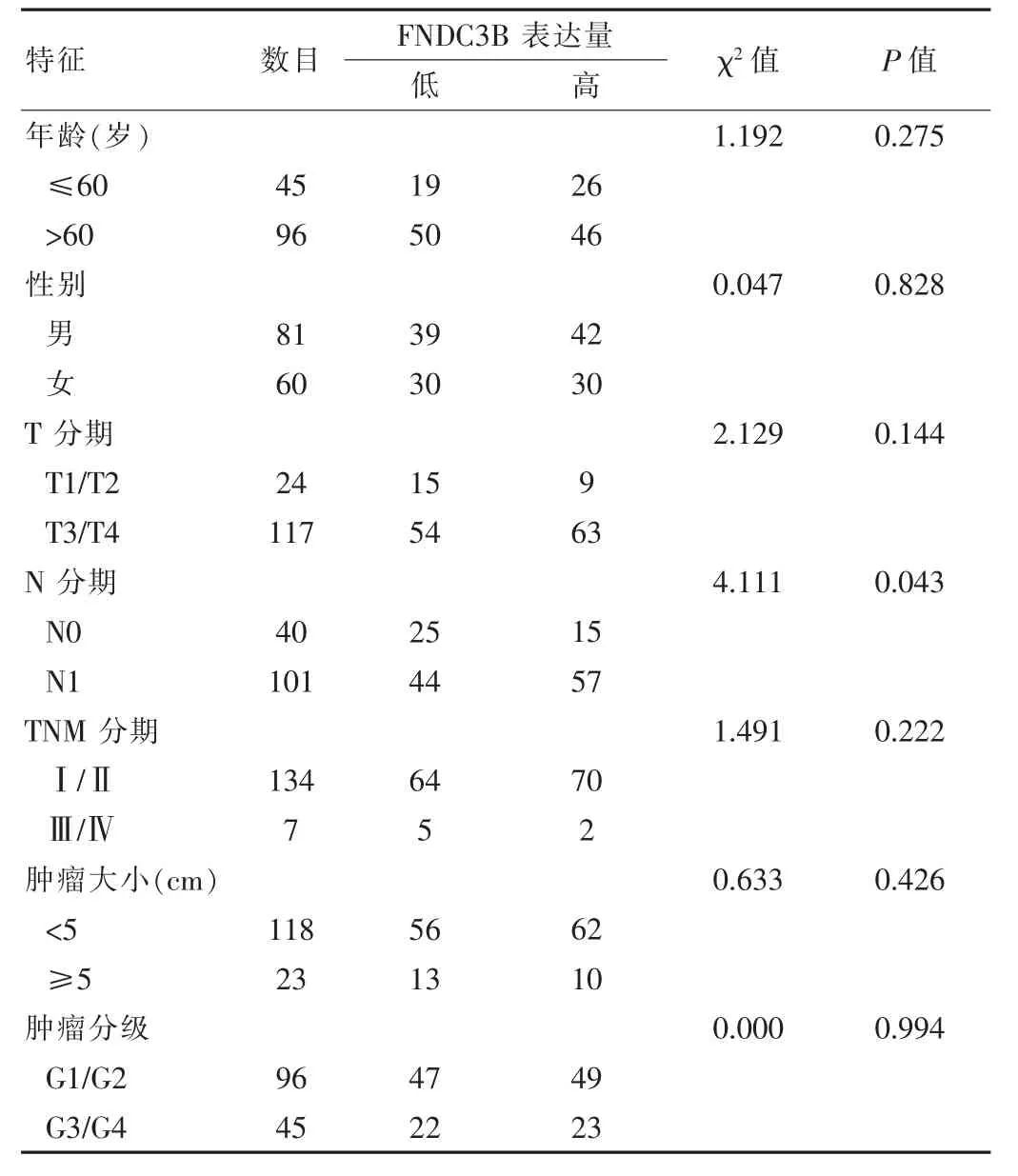
表1 FNDC3B高表達水平與低表達水平臨床病理特征對比
2.3 胰腺癌患者的生存預后分析
單因素分析顯示,高表達FNDC3B與胰腺癌患者總生存期顯著相關(HR:1.905,95%CI:0.207~3.008,P=0.006),其他臨床病理特征包括T分期、N分期、分子靶向治療及放射治療也與胰腺癌患者總生存期相關;在多 因 素 分 析 中,FNDC3B表 達 (HR:1.861,95%CI:1.147~3.019,P=0.012)、分子靶向治療(HR:0.363,95%CI:0.216~0.611,P<0.001)及腫瘤分級(HR:1.948,95%CI:1.198~3.167,P=0.007)是胰腺癌的3個獨立預后因素。見表2。采用Kaplan-Meier法分析各臨床病理因素與胰腺癌患者總生存時間的關系。見圖2。
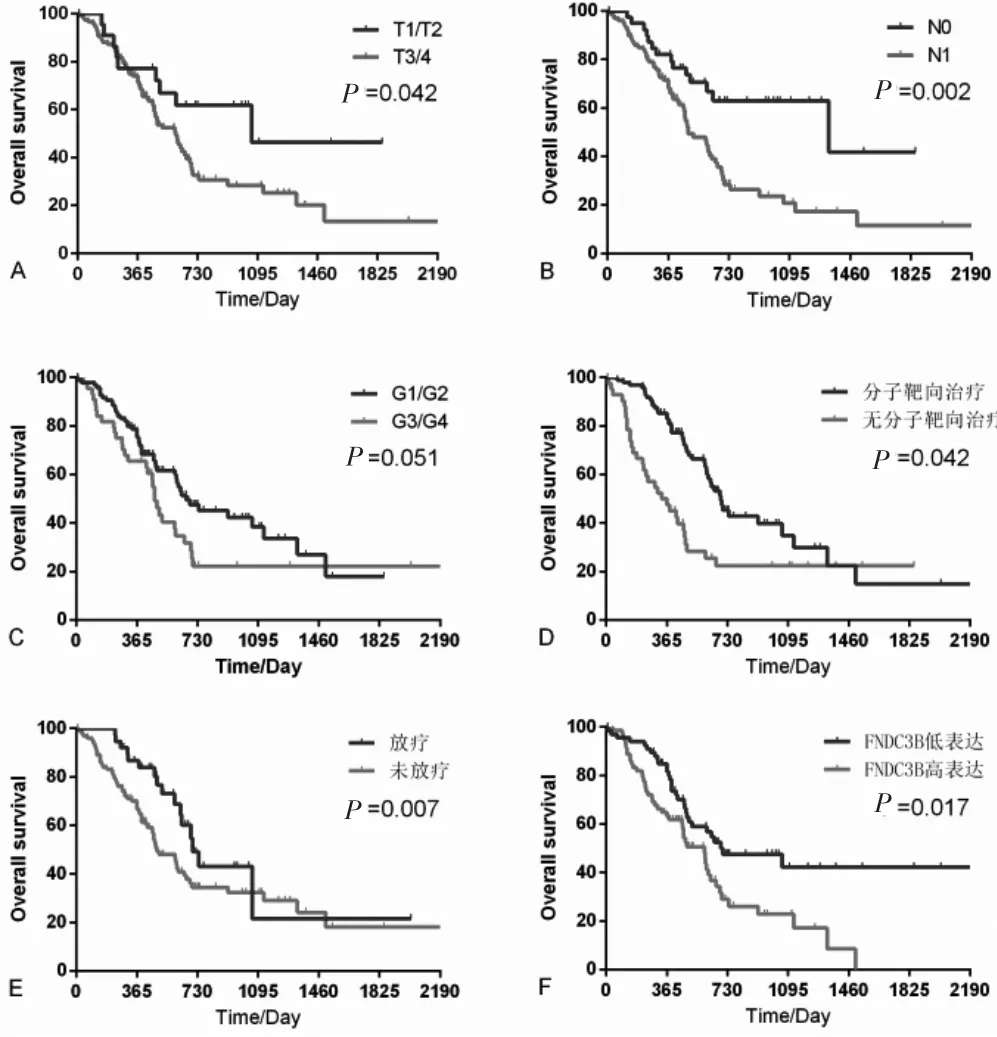
圖2 各臨床病理因素與總生存時間的關系
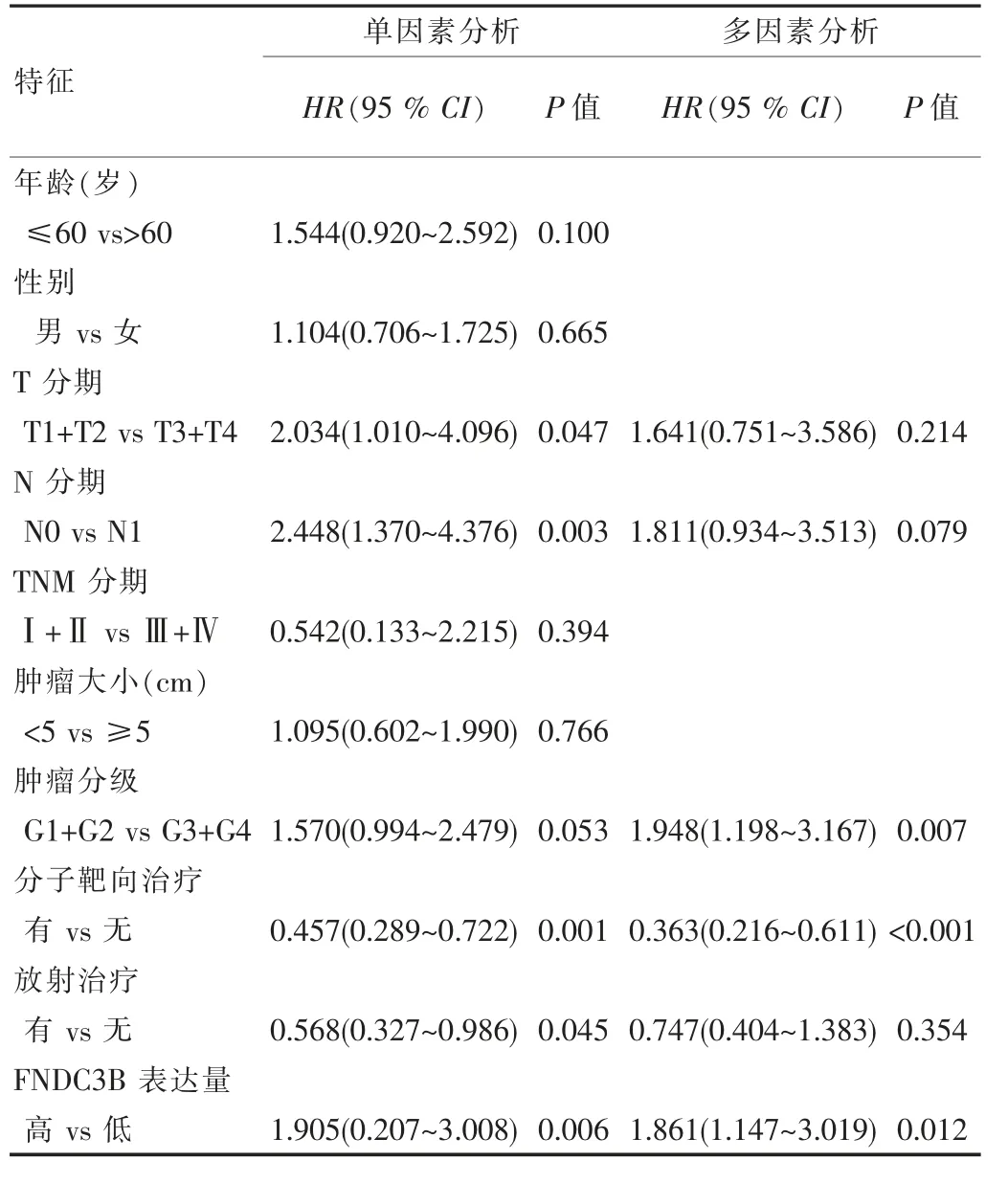
表2 COX回歸模型分析胰腺癌患者總生存期與臨床病理特征的關系
2.4 FNDC3B的功能基因集富集分析
GSEA結果顯示,FNDC3B高表達的樣本富集到癌癥相關通路(P<0.001,FDR=0.000)、胰腺腫瘤(P<0.001,FDR=0.000)、ECM受體相互作用 (P<0.001,FDR=0.000)、白細胞跨內皮遷移(P<0.001,FDR=0.000)、黏著斑(P<0.001,FDR=0.000)、調節肌動蛋白細胞骨架(P<0.001,FDR=0.000)、細胞因子和細胞因子受體相互作用(P<0.001,FDR=0.000)、細胞黏附分子(P<0.001,FDR=0.000)、黏附連接(P<0.001,FDR=0.000)等信號通路。見圖3。
3 討論
近年來,隨著全基因組測序技術的不斷發展和成熟,為挖掘新的生物標志物以及新的靶點治療提供了極大的幫助,但在早期診斷胰腺癌及預后分子靶標等方面,仍需要更進一步的探索[12-13]。
該研究的多因素結果顯示,腫瘤分級、分子靶向治療及FNDC3B是影響胰腺癌患者總生存的獨立危險因素,提示腫瘤分級差、沒有接受臨床靶向治療的胰腺癌患者,可能存在明顯的預后不良,這與既往相關研究結論相符[14-16]。同時,從研究結果也可以看出,FNDC3B高表達的胰腺癌患者預后更差,說明FNDC3B基因的表達情況對胰腺癌患者預后的評估具有重要的價值,可以作為胰腺癌預后評估的有效指標。
Lin等[17]學者發現,FNDC3B可通過FNⅢ1~4結構域與膜聯蛋白A2結合來促進肝癌的遷移和轉移。Cai等[18]學者證實,FNDC3B通過誘導上皮間質轉化激活PI3K/AKT、Rb1和TGF-β途徑來促進肝癌細胞增殖。抑制FNDC3B在舌鱗狀細胞中的表達能夠抑制癌細胞EMT的發生,提示FNDC3B對促進舌鱗狀細胞癌的增殖、侵襲和遷移也起到重要作用[19-20]。該研究結果顯示,FNDC3B高表達的胰腺癌患者具有更高的淋巴結轉移率,提示FNDC3B可能與胰腺癌的惡性程度密切相關,促進腫瘤的侵襲及轉移,加速腫瘤的進展。
通過GSEA來進一步探究FNDC3B表達水平增高是否參與胰腺癌發生及進展的作用機制。研究結果表明,FNDC3B高表達的胰腺癌樣本主要富集在癌癥相關信號通路、胰腺腫瘤、ECM受體相互作用、白細胞跨內皮遷移、黏著斑、調節肌動蛋白細胞骨架、細胞因子和細胞因子受體相互作用、細胞粘附分子、黏附連接等信號通路。結果提示FNDC3B參與了胰腺癌的發生和發展,通過調節細胞黏連、組織遷移、細胞因子相互作用等來影響腫瘤的增殖和轉移。為了改善這部分患者的預后,可以研發抑制FNDC3B靶點的新型靶向藥,將來可能會是一種有效的治療策略,值得進一步研究[21-22]。該文存在不足,僅從基因角度探索對胰腺癌的預后影響,沒有進一步挖掘FNDC3B基因表達與蛋白表達的關系,以及二者對胰腺癌患者預后的影響,這也是后續需要進一步探索的方向。
綜上所述,FNDC3B基因的表達與胰腺癌患者預后不良密切相關,是評估胰腺癌預后的有效指標,這對胰腺癌研發新的分子靶向藥物治療提供了理論依據。

