基于網絡藥理學和分子對接探討桔梗-甘草防治COVID-19的機制
馬英華,張古英,趙宜樂,韓 雨,姜錫娟,解偉偉,安 娜,安志華,秦亞彬 (.河北省兒童醫院藥學部,石家莊 05003;.河北醫科大學第二醫院藥學部,石家莊 050000)
在抗擊新型冠狀病毒肺炎(Coronavirus disease 2019,COVID-19)時[1],中醫藥與西藥相輔相成,做出了巨大貢獻[2-3]。桔梗為桔梗科植物桔梗[Platycodongrandiflorum(Jacq.)A.DC.]的干燥根[4]。甘草為豆科植物甘草(GlycyrrhizauralensisFisch.)、脹果甘草(GlycyrrhizainflataBat.)或光果甘草(GlycyrrhizaglabraL.)的干燥根和根莖[5]。桔梗和甘草配伍,最早來源于中醫經典《傷寒論》中的桔梗湯,主要用于治療肺熱咽痛、肺熱咳嗽、肺癰等證[6]。桔梗-甘草藥對經加味可以演化為清金化痰湯、托里消毒散、清肺湯等經典名方[7-8]。同時,桔梗和甘草是在COVID-19的治療中高頻次出現的中藥[9]。但桔梗-甘草藥對干預COVID-19的作用機制尚不明確。
網絡藥理學從系統整體角度出發,對生物系統的網絡信號進行多成分-多靶點的系統研究,廣泛應用于中藥研究中,而分子對接更能從藥物分子設計的角度佐證網絡藥理學的研究結果[10-11]。本研究基于網絡藥理學和分子對接技術,探討并驗證桔梗-甘草藥對干預COVID-19的作用機制,以期為治療COVID-19提供理論支持。
1 資料與方法
1.1活性成分和靶點篩選 利用TCMSP(https://tcmspw.com/tcmsp.php)數據庫,檢索關鍵詞“桔梗”和“甘草”,以口服利用度(oral bioavailability,OB)≥30%和類藥性(drug likeness,DL)≥0.18為篩選條件,篩選出藥效活性成分。同時預測成分潛在作用靶點,利用蛋白質數據庫Uniprot(https://www.uniprot.org/)和perl腳本程序對靶點基因的名稱進行轉換,校正為官方的縮寫名稱。
1.2疾病靶點篩選 利用基因數據庫Gene Cards(https://www.genecards.org)、OMIM(https://www.omim.org/)、TTD(http://db.idrblab.net/ttd/)、PharmGkb(https://www.pharmgkb.org/)、DrugBank(https://go.drugbank.com/),對關鍵詞“COVID-19”和“novel coronavirus”進行檢索,限定選擇相關度≥1的靶點,收集疾病靶點。
1.3藥物-成分-靶點網絡構建 安裝R語言軟件R×64 4.0.2,在R語言上安裝Venny 2.1.0,將藥物與疾病靶點取交集繪制韋恩圖,得到交集靶點文檔,并運用Cytoscape 3.7.2軟件繪制相互作用網絡圖。
1.4PPI網絡構建 使用STRING(https://string-db.org/)網站,將1.3項下得到的交集靶點導入數據庫,物種限定為“Homo sapiens”,設置最低相互作用閾值“medium confidence”為0.7,隱藏離散點,得到PPI網絡圖,結果以tsv的格式導出,備用。將這些數據導入Cytoscape軟件進行可視化,運用CytoNCA插件對交集基因進行打分篩選,得到核心基因。
1.5通路富集分析 使用perl腳本,將交集靶點的symbol 轉換為基因ID,再次使用R語言軟件,安裝Bioconductor數據庫安裝包,對交集靶點進行GO(gene ontology)分析和KEGG(kyoto encyclopedia of genes and genomes)通路分析,最終得到GO分析的柱形圖、KEGG通路分析的氣泡圖和通路途徑圖。
1.6活性分子與靶點蛋白對接 從PubChem(https:// pubchem.ncbi.nlm.nih.gov/)數據庫中下載活性成分(Degree≥11)的二維化學結構,利用Chem Office 3D 18.1.0軟件轉換為三維結構,轉碼為mol2格式文件,備用。從RCSB PDB(http://www.rcsb.org/)數據庫下載Mpro(PDB ID:6LU7)和ACE2(PDB ID:1R42)的3D結構,應用PyMOL軟件進行去水分子和去有機物操作,備用。將上述活性化合物和蛋白結構文件導入AutoDock Tools 1.5.6軟件進行優化操作,設置蛋白活性口袋,定義盒子大小為(40×40×40)個網格點,每個網格點的距離(spacing)為1.0 nm,最后利用AutoDock Vina軟件進行分子對接。
2 結果
2.1活性成分和靶點篩選 在TCMSP數據庫中查詢桔梗和甘草的成分,共收集到367種化學成分(桔梗102種,甘草265種),設置參數(OB≥30%,DL≥0.18)進行篩選,結果共篩選得到99種成分(桔梗7種,甘草92種)。同時,利用TCMSP數據庫篩選桔梗和甘草成分所對應的靶點基因,共獲得2 766個靶點。
2.2疾病靶點篩選 在數據庫Gene Cards、OMIM、TTD、PharmGkb和DrugBank中,以“COVID-19”和“novel coronavirus”為搜索詞,得到與COVID-19相關的靶點,設置相關度≥1,去重取并集,共獲得674個靶點。在R語言軟件中運行腳本進行韋恩圖繪制,對交集結果進行可視化,見圖1A,其中GeneCard 482個、OMIM 3個、TTD 100個、PharmGkb 9個、DrugBank 119個。
2.3活性成分-關鍵靶點相互作用網絡分析 利用R語言軟件,繪制成分-靶點的韋恩圖,得到交集基因67個,見圖1B,并應用Cytoscape 3.7.2軟件進行網絡構建和可視化,見圖2。圓形表示靶點,長方形表示甘草有效成分,倒三角形表示桔梗有效成分,連線表示二者之間的相互作用關系。如圖2所示,共有150個節點(83種成分和67個交集基因)和672條連線,此結果體現了中藥多成分多靶點共同作用的意義。根據拓撲學分析,該網絡中所有靶點按度值(Degree)打分排序,靶點節點大小用“Degree”表示,得到靶點的得分排序。度值越大表示靶點被越多的有效成分所靶向,說明靶向靶點對蛋白相互作用網絡的關鍵作用。而大于平均度值的交集基因有10個,分別為PTGS2(78)、ESR1(71)、NOS2(62)、PPARG(58)、GSK3B(53)、CDK2(53)、CCNA2(50)、MAPK14(43)、PTGS1(41)和DPP4(35)。

圖1 來自5個數據庫的靶點韋恩圖注:A.COVID-19疾病靶點韋恩圖;B.桔梗-甘草藥對與COVID-19交集靶點韋恩圖。Fig.1 Target Venn diagrams from 5 databasesNotes:A.Venn diagram of COVID-19 disease targets;B.Venn diagram of intersection targets in Platycodonis Radix-Licorice drug pair and COVID-19 disease.
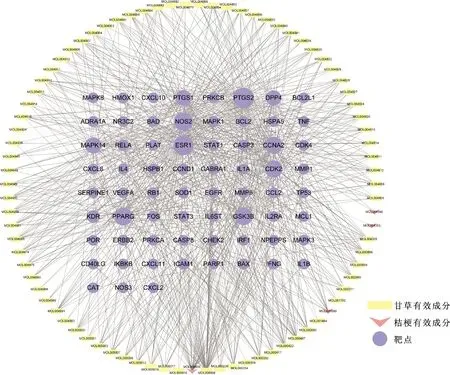
圖2 藥物-成分-靶點相互作用網絡Fig.2 Drug-component-target interaction network
2.4PPI網絡構建及查找核心基因 將67個交集基因導入STRING數據庫,設置物種為人類,剔除離散靶點,篩選得分大于0.7的靶點,最終得到PPI網絡的關系數據,將數據導入Cytoscape軟件構建蛋白相互作用網絡圖(圖3A)。運用CytoNCA插件對交集基因進行打分,篩選依據為中介中心性(betweenness centrality,BC)、緊密中心性(closeness centrality,CC)、程度中心性(degree centrality,DC)、特征向量中心性(eigenvector centrality,EC)、本地平均水平連接性(local average connectivity,LAC)和網絡中心性(network centrality,NC),若6項的評分均大于中位數,則將該基因保留,否則將其剔除(圖3B)。最后經過2輪篩選,得到核心基因(圖3C)。最終核心基因包括RELA、STAT1、MAPK3、TP53、MAPK1、MAPK8、STAT3、MAPK14、IL1B和TNF(詳細節點參數見表1)。結果表明,桔梗-甘草藥對可能通過以上核心基因干預COVID-19的進展。同時,將2.3項下的主要作用靶標與PPI網絡的核心基因取交集,得到MAPK14基因,可以推測MAPK14基因不僅對藥材和疾病作用的影響大,而且在PPI網絡中居于重要地位,推斷這個靶點可能是桔梗-甘草藥對拮抗新型冠狀病毒的重要靶標。

圖3 使用Cytoscape軟件構建的PPI網絡圖注:A.使用CytoNCA插件第一次過濾篩選出的各評分均高于中位數的倒三角節點;B.通過CytoNCA插件第二次過濾構建的子網絡;C.最后使用CytoNCA插件2次篩選得到的核心基因。Fig.3 Establishing PPI network by using CytoscapeNotes:A.CytoNCA plug-in was used to filter out the yellow nodes whose scores were higher than the median for the first time;B.subnetwork constructed by a second filtration via CytoNCA;C.final core genes screened after two filtrations by using CytoNCA.

表1 蛋白相互作用網絡核心靶點蛋白拓撲參數Tab.1 Topological parameters of core target proteins in PPI network
2.5GO富集分析和KEGG通路分析 經分析,共獲得2 120個生物過程(biological process,BP)、38種細胞組分(cellular component,CC)和136個分子功能(molecular function,MF),篩選各組分前10個富集最顯著的GO分析(圖4),其中BP主要與抗氧化反應、細胞對化學壓力的反應、凋亡信號通路的調控、對脂多糖的反應和對細菌起源分子的反應等相關,CC 主要集中在細胞膜活性上,而MF主要與細胞因子活性和受體結合相關。以上結果提示桔梗-甘草藥對的靶點主要與細菌和病毒感染等密切相關。通過KEGG通路分析,共獲得166條信號通路,選取前30條富集最顯著的通路繪制氣泡圖,見圖5,其中x軸表示富集因子(rich factor),即背景基因集中在這個通路的所有基因的數量,y軸表示通路名稱,氣泡顏色表示P值大小,氣泡大小表示基因數量。如圖5所示,富集通路涉及Coronavirus disease-COVID-19通路,涉及的其他通路大致可分為免疫反應相關通路、炎癥相關通路、抑制病毒感染通路和抑制癌癥的相關通路。以上結果提示桔梗-甘草藥對可能通過干預這些信號通路來抑制COVID-19的進展。

圖4 桔梗-甘草藥對干預COVID-19的GO富集分析結果Fig.4 GO enrichment analysis of Platycodonis Radix-Licorice drug pair for intervention against COVID-19

圖5 桔梗-甘草藥對干預COVID-19的KEGG富集分析結果Fig.5 KEGG enrichment analysis of Platycodonis Radix-Licorice drug pair for intervention against COVID-19
2.6核心活性成分與ACE2和Mpro的分子對接 分子對接技術通過計算機輔助藥物設計對主要活性成分與疾病關鍵靶點蛋白進行模擬研究,從而簡單驗證網絡藥理學的分析結果,其結合自由能越小,則配體與受體的親和力越大,從而側面佐證活性成分與關鍵靶點存在相互作用。一般結合自由能小于-5.0 kcal·mol-1則認為模擬成功,小于-7.0 kcal·mol-1則認為兩者有較好的結合能力。將網絡藥理學分析中得到的前11種活性成分(Degree≥11)分別與ACE2和Mpro進行對接,計算結合自由能,采用最小的結合構象,結果見表2。同時,自由能最小的前4種活性化合物(鱗葉甘草素A、槲皮素、甘草查爾酮A和木犀草素)的分子對接圖見圖6。

表2 核心活性成分與SARS-CoV-2的結合位點Mpro和ACE2分子對接效能Tab.2 Molecule docking efficiency of core active components with Mpro and ACE2 at the binding sites of SARS-CoV-2

圖6 活性成分與ACE2和Mpro的分子對接模式Fig.6 Molecular docking diagram of active ingredients with ACE2 and Mpro
3 討論
目前對于COVID-19缺乏特效治療藥物,根據《新型冠狀病毒肺炎診療方案(試行第8版)》(國衛辦函),治療以抗病毒、抗感染、免疫治療和對癥治療為主。在中醫理論背景下[12],COVID-19屬于中醫疫病范疇[13],其病因主要是感受“疫戾”之氣,病理因素主要以濕為主,伴隨毒和瘀,入肺化熱,所以初期治療以清熱解毒化濕為主[14]。從古至今,中醫藥在各種瘟疫病的治療中都發揮著重要作用[15]。經典藥對桔梗和甘草合用,對COVID-19有一定的防控作用。但是,其對COVID-19的治療作用尚缺乏直接證據。
本研究采用網絡藥理學結合分子對接技術系統分析了經典藥對桔梗-甘草干預COVID-19的潛在作用機制。從現存的中藥數據庫中獲得靶標信息,篩選出99種活性成分,并與COVID-19疾病靶標取交集,獲得67個交集靶點,通過對關鍵交集靶點進行PPI網絡分析和篩選,得到關鍵靶點MAPK14。MAPK14,即p38α,是p38絲裂原活化蛋白激酶(p38MAPK)家族成員之一[16]。MAPK14作為MAPK家族中的重要成員之一,其表達與機體生理功能密切相關,表達異常可引發機體免疫功能失調,導致許多疾病的發生,同時也與炎癥反應息息相關。當機體受到不同理化因素、炎性因子、脂多糖、紫外線照射等刺激后,可通過活化MAPK14蛋白來激活p38MAPK通路,從而啟動炎癥級聯反應[17]。因此,推測桔梗-甘草藥對可能通過調控MAPK14蛋白的表達而起到抑制病毒的作用。通過對關鍵交集靶點進行GO富集分析發現,其BP主要與抗氧化反應、細胞對化學壓力的反應、凋亡信號通路的調控、對脂多糖的反應、對細菌起源分子的反應密切相關,表明桔梗-甘草藥對可能具有抗病毒和抗感染的作用。而KEGG通路分析結果則顯示桔梗-甘草藥對干預COVID-19的通路大致可以分為免疫反應相關通路、炎癥相關通路、抑制病毒感染通路和抑制癌癥的相關通路,該結果提示桔梗-甘草藥對可能通過多渠道、多通路抑制COVID-19的進展。
新型冠狀病毒于2020年2月11日被國際病毒分類委員會命名為嚴重急性呼吸綜合征冠狀病毒2(SARS-CoV-2)。研究發現,SARS-CoV-2與嚴重急性呼吸綜合征冠狀病毒(severe acute respiratory syndrome-coronavirus,SARS-CoV)、中東呼吸系統綜合征冠狀病毒(middle east respiratory syndrome-coronavirus,MER-SCoV)一樣,同屬于β屬的冠狀病毒[18-19],2019-nCoV與SARS-CoV的基因序列同源性高達79%,與MER-SCoV序列的同源性也達到了40%左右,且三者都是通過刺突糖(spike glycoprotein,S)蛋白的表達與人體黏膜上皮細胞膜表面的ACE2的受體結合而入侵機體,繼而大量復制,導致肺炎[20-21]。而ACE2作為炎癥因子調節蛋白[22],通過酪氨酸蛋白磷酸化,激活MAPK受體,誘導激活促炎因子,導致線粒體功能障礙,從而損害組織細胞[23]。因此,活性成分與Mpro和ACE2的靶點結合能有效抑制病毒的進一步入侵,從而減輕病毒感染的程度。目前,利用分子對接技術模擬、驗證活性成分與病毒靶點的結合,初步篩選出能與化學抗病毒藥物相匹敵的活性成分,為進一步的實驗驗證奠定了理論基礎,也為這些活性成分能夠成為抗病毒藥提供了理論依據,既減少實驗資源的盲目浪費,又為進一步的實驗研究奠定了基礎。
綜上所述,中藥經典藥對桔梗-甘草干預COVID-19是通過多成分、多靶點、多通路的協同方式實現,為COVID-19的中醫防治提供了可行性理論參考。同時,通過分子對接分析藥對的核心成分,也為新藥的開發提供了新方向,縮短了用于篩選有效化合物的時間,提高了新藥開發的效率。但是本研究也存在一定的局限性,即預測的理論結果還需后期的實驗進行進一步驗證,才能為COVID-19的中醫防治提供更可靠的理論和數據支持。

