間接競爭化學發光酶聯免疫分析方法檢測禽肉中金剛烷胺和氯霉素殘留
許小炫,蘇曉娜,譚 庶,鐘翠麗,曾道平,張 燕,徐振林,王 序,楊金易,*
(1.華南農業大學食品學院,廣東 廣州 510642;2.溫氏食品集團股份有限公司,廣東 云浮 527400;3.廣東產品質量監督檢驗研究院,廣東 佛山 528300)
金剛烷胺(amantadine,AMA)是用于治療流感疾病的抗病毒藥物,農業部2005年第560號公告規定禁止AMA類藥物在養殖業的使用,然而2012年“速生雞”事件反映了養禽業仍存在AMA濫用的問題[1]。研究表明,動物飼養中AMA的濫用問題增強了流感病毒的耐藥性,而且對人體會產生神經毒性等毒副作用[2-4]。氯霉素(chloramphenicol,CAP)是一種廣譜抗生素,我國農業部已將CAP從2000年版《中國獸藥典》刪除并列為禁藥,但自“CAP風波”以來,CAP的濫用問題層出不窮[5]。CAP殘留不僅會使大部分細菌對其產生耐藥性,還可能導致骨髓造血機能絮亂、粒細胞/血小板減少、再生障礙性貧血等毒副作用[6]。目前實施的動物性食品中AMA殘留量測定方法的檢測限為1 μg/kg,2004年歐盟委員會已將CAP的檢測底限降低為0.1 μg/kg[7]。
當前報道的檢測禽肉樣品中AMA和CAP殘留的方法主要有儀器分析法[8-9]、微生物測定法[10-11]、免疫分析法[12-13]。儀器分析法主要包括高效液相色譜法[14-15]和氣相色譜法[16-17],準確性高,但有操作復雜、檢測時間長、對人員素質要求高、難以滿足快速檢測等問題。近年來報道的免疫分析法有酶聯免疫吸附法[18-19]、化學發光免疫[20-21]、免疫傳感器[22]、膠體金試紙條[23-24]、免疫磁珠[25]、免疫芯片[26]等。化學發光酶聯免疫分析法(chemiluminescence enzyme-linked immunoassay,CLEIA)是根據酶聯免疫分析的基本原理,將高特異性的免疫反應和高靈敏度的化學發光反應相結合以檢測抗原或者抗體的免疫技術。目前已有使用CLEIA方法檢測動物組織中的AMA和CAP的文獻報道[20-21],然而,這些方法的不足之處在于檢測目標過于單一,均為獨立的前處理過程,無法實現同時處理和分析,不可避免地帶來檢測效率低下、成本高、浪費時間等問題,更無法滿足愈來愈繁重的突發事件和應急監控工作的需要。目前適用于AMA和CAP殘留同步檢測的免疫分析方法及前處理方法鮮見報道,因此有必要開發出一種能同時提取禽肉樣品中AMA和CAP兩類藥物總量的樣品處理技術以及相應的CLEIA檢測方法。
目前已報道的提取AMA和CAP的有機溶劑多為乙腈、酸性乙腈、乙酸乙酯和堿性乙酸乙酯[27-28]。AMA在結構上屬于有機堿,在酸性溶液中易溶于水,在堿性溶液中易溶于有機溶劑。通過儀器驗證證實,AMA和CAP在堿性環境中能被有機溶劑更好地萃取[29-30]。針對AMA和CAP的化學特征,本研究利用實驗室前期所得的AMA抗體及抗原、CAP抗體及抗原建立了間接競爭性CLEIA(ic-CLEIA)檢測方法,并創新性地使用碳酸鉀和乙酸乙酯提取藥物的方法將AMA和CAP的樣品前處理方法合并,對ic-CLEIA方法進行系統評估,適用于實際樣品中AMA和CAP藥物的同步檢測。本方法旨在使檢測結果不僅靈敏度高、準確可靠,而且操作方便、節約時間,可以滿足禽肉AMA和CAP藥物兩種藥物的實際檢測需求,為后期實現快速聯檢禽肉樣品中多種違禁藥物殘留檢測方法提供技術依據。
1 材料與方法
1.1 材料與試劑
未含AMA及CAP雞肉、鴨肉、鴿肉 市購。
AMA多克隆抗體(anti-AMA pAb,2.33 mg/mL)、AMA包被原(AMA-BSA,7.43 mg/mL)、CAP單克隆抗體(anti-CAP mAb,3.5 mg/mL)、CAP包被原(CAP-BSA,18 mg/mL)由廣東省食品安全重點實驗室制備并保存[31-32];AMA、CAP、金剛乙胺、氟苯尼考 國藥集團化學試劑有限公司上海分公司;辣根過氧化物酶標記羊抗鼠IgG(1 mg/mL)、辣根過氧化物酶標記羊抗兔IgG(1 mg/mL) 安諾倫生物科技有限公司;96 孔不透明白色發光板 深圳金燦華實業有限公司;ECL化學發光液 GE Healthcare中國公司;所用溶劑和試劑均為分析純或色譜純。
1.2 儀器與設備
JZ-II型均質器 莆田市南榮貿易有限公司;超低溫高速離心機 美國E p p e n n d o r f 公司;WallacVICTOR31420多功能標記分析儀 美國PE公司;氮吹儀 康寧科技有限公司;QP50質譜儀 日本島津公司;1200系列液相色譜儀 美國Agilent公司;ZHJH-1122超凈工作臺 上海新苗醫療器械公司。
1.3 方法
1.3.1 ic-CLEIA的操作步驟
包被:用包被液將包被原稀釋至相應的最適濃度,包被96 孔不透明白色發光板,每孔150 μL,4 ℃條件下16 h包被。封閉:經每孔300 μL洗液洗滌2 次后,每孔加入170 μL封閉液,37 ℃封閉4 h,甩干孔中的液體,置于37 ℃烘箱中2 h備用。競爭反應:加入標準品或樣品溶液(50 μL/孔),先加入50 μL酶標二抗,再加入50 μL抗體工作液,混勻后25 ℃反應一定時間,洗滌4 次,每孔加入100 μL底物緩沖液和底物液等體積混合后的化學發光反應液,輕拍混勻,蓋上蓋板膜,2 min后用化學發光免疫分析儀測定每孔的發光值RLU。
1.3.2 ic-CLEIA方法的優化
1.3.2.1 包被原及單克隆抗體的稀釋倍數組合
取96 孔化學發光板,用包被液將包被原作一系列稀釋,稀釋倍數為2 500、5 000、10 000、20 000、30 000、40 000 倍;AMA多克隆抗體按5 000、10 000、15 000、20 000、40 000 倍稀釋,而CAP單克隆抗體按20 000、40 000、80 000、120 000、160 000 倍稀釋,按照1.3.1節的步驟操作,計算出標準曲線的RLUmax、IC50和RLUmax/IC50,以RLUmax/IC50較高、IC50較低、RLUmax適中時的條件為CLEIA的最佳反應條件。
1.3.2.2 二抗稀釋倍數和競爭時間優化
AMA的羊抗兔酶標二抗按2 000、4 000、6 000、8 000 倍和10 000 倍稀釋,CAP的羊抗鼠酶標二抗按6 000、8 000、10 000、20 000 倍和30 000 倍稀釋,以20、25、30 min和40 min競爭時間反應,按照1.3.1節的步驟操作,以RLUmax/IC50較高、IC50較低、RLUmax適中時的條件為CLEIA的最佳反應條件。
1.3.3 樣品前處理
稱取空白禽肉樣品2 g置于50 mL離心管中,加入6 mL乙酸乙酯和1 mL去離子水,渦旋振蕩3 min,加入2 mL碳酸鉀溶液,渦旋振蕩60 s,4 000 r/min離心5 min,取3 mL上清液于離心管中,于65 ℃氮氣或空氣吹干,加入2 mL正己烷和1 mL PB溶液,渦旋振蕩1 min,4 000 r/min離心1 min,棄去上層正己烷層,取下層溶液進行ic-CLEIA分析(稀釋倍數為1)。
1.3.4 添加回收實驗
向空白樣品中添加AMA和CAP標準品溶液,使其AMA的含量為0.5、1 μg/kg和2 μg/kg,CAP含量為0.05、0.1 μg/kg和0.2 μg/kg,經前處理后用同一批次化學發光板對同批樣品進行檢測,每個樣品設4 個重復,計算批內變異;用不同批次化學發光板對同批樣品進行檢測,每個樣品設4 個重復,計算批間變異。
1.3.5 儀器方法驗證
禽肉中AMA殘留的儀器方法測定參照DB 21/2394ü 2014《雞肝和雞肉中AMA、金剛乙胺的檢測 超高效液相色譜串聯質譜法》進行,檢測限為0.5 μg/kg。禽肉中CAP殘留的儀器方法測定參照GB/T 22338ü 2008《動物源性食品中CAP類藥物殘留量測定》進行,檢測限為0.1 μg/kg。
1.4 數據分析
以AMA標準品濃度或CAP標準品濃度的對數值為橫坐標(X),以發光值RLU為縱坐標(Y),應用Origin 8.5軟件中的四參數擬合競爭標準曲線;根據樣品RLU值,由標準曲線查出相應的濃度,乘以稀釋倍數,即為樣品的實際濃度。使用Origin 8.5軟件繪制相關ic-CLEIA圖表。數據統計使用SAS 6.12軟件計算完成。
2 結果與分析
2.1 CLEIA最優條件的優化
2.1.1 包被原、抗體最適工作濃度的確定
本研究以RLUmax、IC50和RLUmax/IC50作為評價各影響因素的標準,IC50越小,方法的靈敏度更高,RLUmax和RLUmax/IC50的高低決定曲線的線性可用范圍寬窄。由圖1、2可看出,當包被原稀釋倍數為10 000,抗體稀釋倍數為15 000時,AMA-CLEIA的IC50較低,RLUmax/IC50較高,因此AMA-CLEIA的包被原和抗體的最適工作質量濃度為743 μg/L和155 μg/L。同理,CAP-CLEIA的包被原和抗體的最適工作質量濃度為3.6 mg/L(稀釋倍數5 000)和43.8 μg/L(稀釋倍數80 000)。
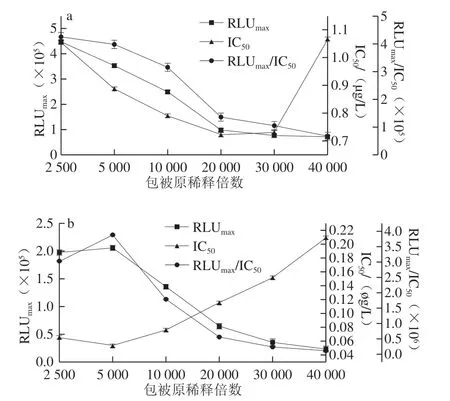
圖1 AMA(a)和CAP(b)包被原稀釋倍數的優化Fig.1 Optimization of dilution factor of AMA-BSA (a) and CAP-BSA (b)
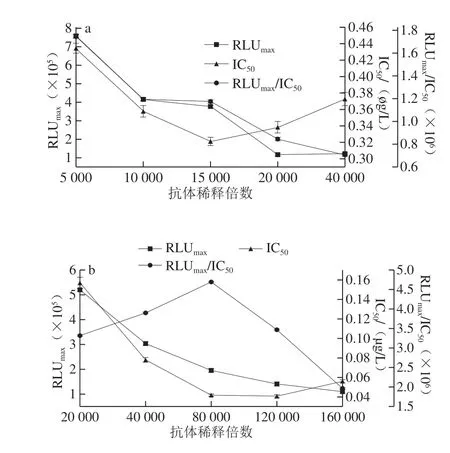
圖2 AMA(a)和CAP(b)抗體稀釋倍數的優化Fig.2 Optimization of dilution factor of anti-AMA (a) and anti-CAP (b) antibody
2.1.2 競爭時間和酶標二抗稀釋倍數的確定
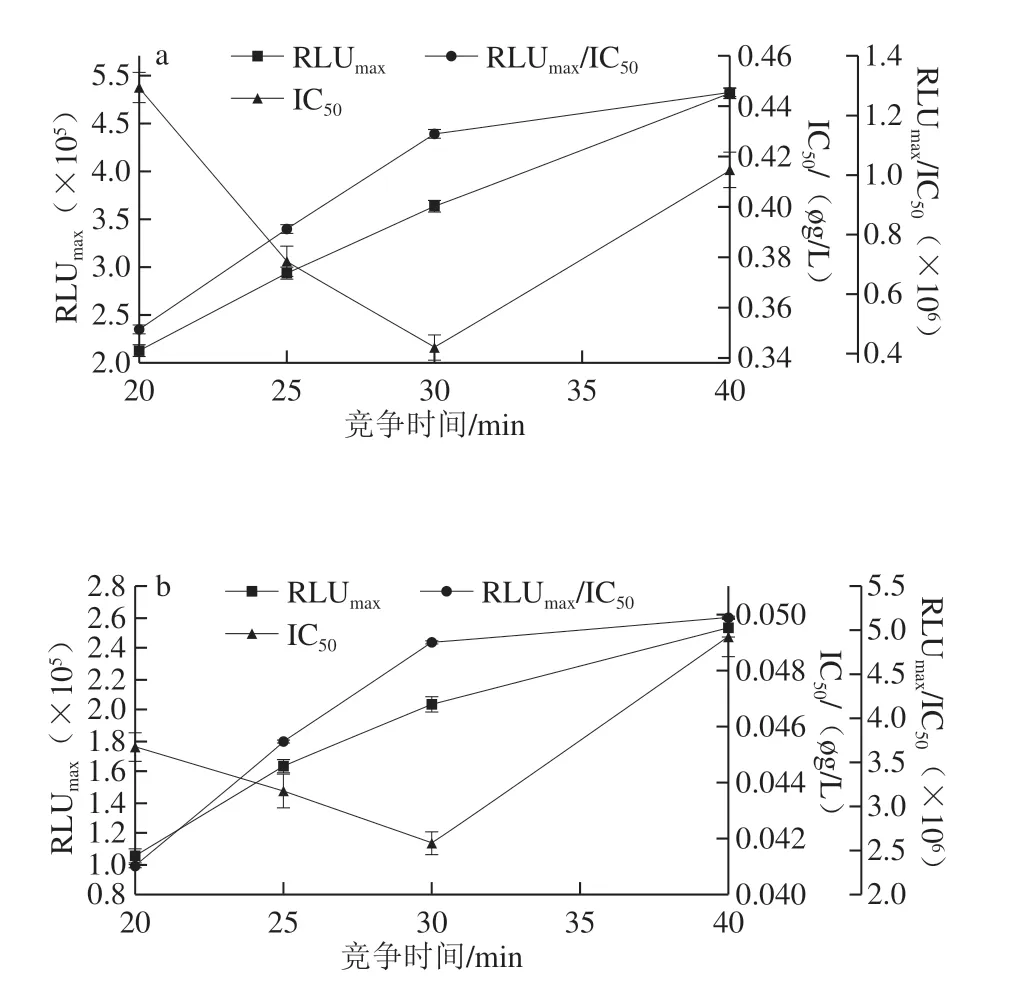
圖3 AMA(a)和CAP(b)競爭時間的優化Fig.3 Optimization of competition time for AMA (a) and CAP (b)
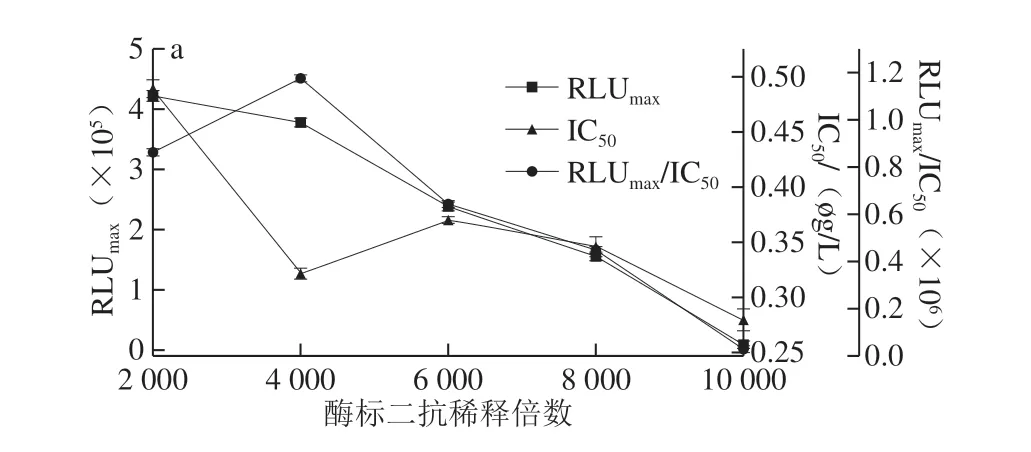
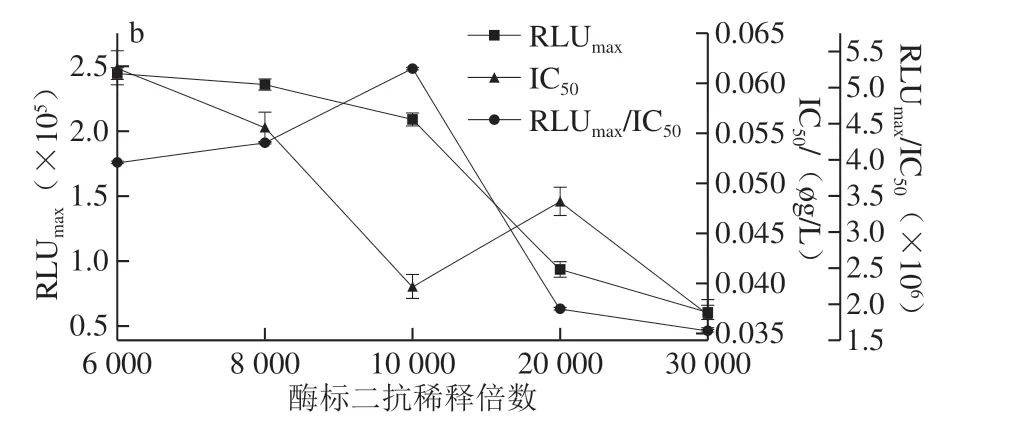
圖4 AMA(a)和CAP(b)酶標二抗稀釋倍數的優化Fig.4 Optimization of dilution factor of RP-labeled secondary antibody against AMA (a) and CAP (b)
抗原抗體能否充分結合與其反應時間長短有關,所以要對反應時間進行優化。如圖3 所示,當競爭時間為30 min時,IC50最小,RLUmax/IC50較大,因此AMA-CLEIA和CAP-CLEIA的最佳競爭反應時間為30 min。如圖4可知,AMA-CLEIA和CAP-CLEIA的最佳酶標二抗稀釋倍數為4 000和10 000。
2.1.3 標準曲線的建立
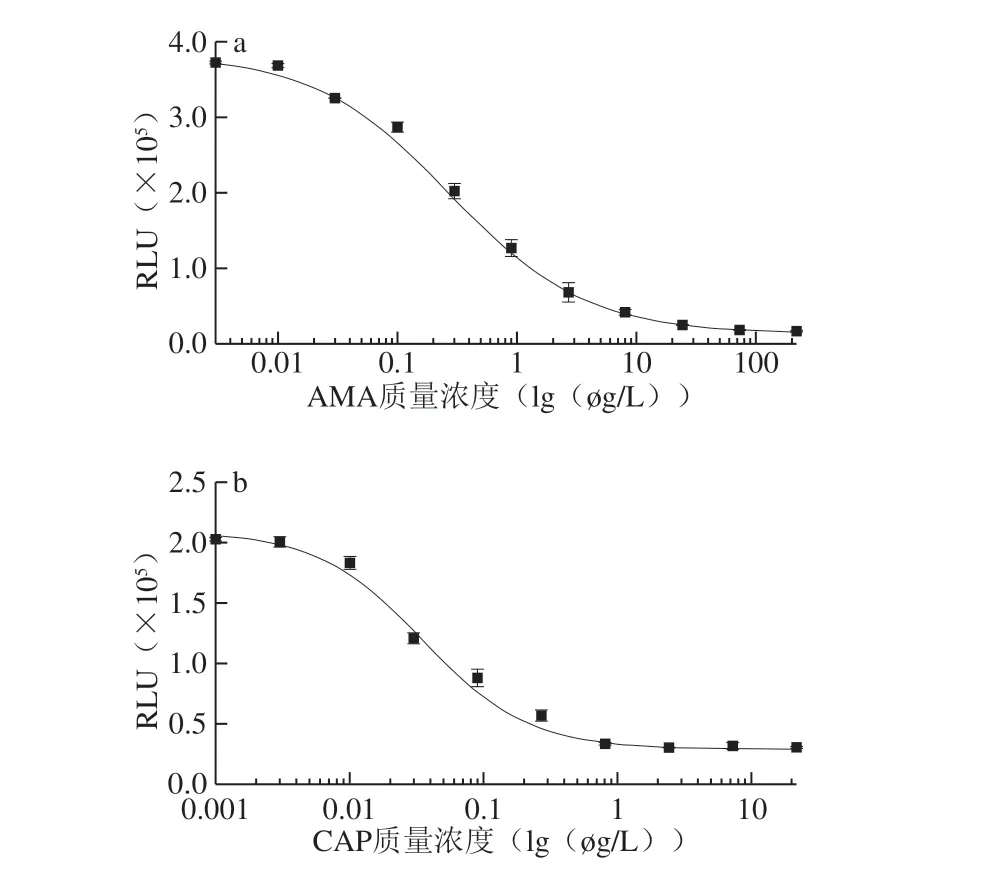
圖5 ic-CLEIA檢測AMA(a)和CAP(b)的標準曲線Fig.5 Calibration curve for indirect competitive chemiluminescence enzyme linked immunoassay (ic-CLEIA) analysis of AMA (a) and CAP (b)
按照上述CLEIA條件優化結果,以AMA或CAP標準品溶液質量濃度對數為橫坐標,RLU值為縱坐標,繪制標準曲線,結果如圖5所示。AMA標準曲線的線性范圍(IC20~IC80)為0.06~1.77 μg/L,IC50為0.33 μg/L,檢出限為0.0 6 μ g/L。C A P 標準曲線的線性范圍(IC20~IC80)為0.010~0.179 μg/L,IC50為0.039 μg/L,檢出限為0.009 μg/L。
2.2 樣品前處理的優化
2.2.1 提取助劑種類和濃度的確定
研究去離子水、氨水、碳酸鈉溶液、氫氧化鈉溶液和碳酸鉀溶液5 種提取助劑的提取效果,結果如圖6所示,根據回收率進行比較,提取AMA效果最好的是碳酸鉀溶液,其次是氨水和碳酸鈉溶液,去離子水和氫氧化鈉溶液的提取效果較差。5 種提取助劑提取CAP差異性并不顯著,都能取得良好的回收率。最終選擇碳酸鉀溶液為AMA和CAP的提取助劑。比較了不同濃度的碳酸鉀的提取效率,由圖7可知,當碳酸鉀濃度為1.2 mol/L時,AMA和CAP的添加回收率達到最高,因此確定碳酸鉀的最佳濃度為1.2 mol/L。
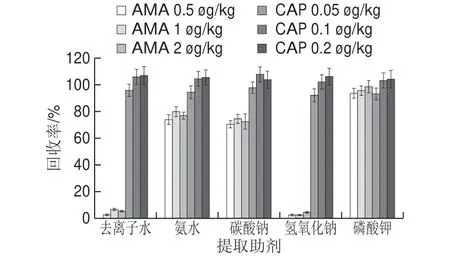
圖6 不同提取助劑的AMA和CAP添加回收結果Fig.6 Effect of extraction solvents on the recovery of AMA and CAP
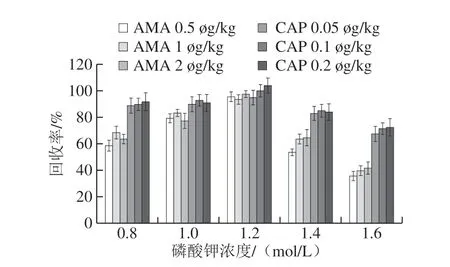
圖7 不同濃度碳酸鉀的AMA和CAP添加回收結果Fig.7 Evaluation of the concentration of potassium carbonate on the recoveries of AMA and CAP
2.2.2 提取時間的優化

圖8 不同振蕩時間的AMA和CAP添加回收結果Fig.8 Effect of shaking time on the recoveries of AMA and CAP
本研究的前處理方法中,加入純水和乙酸乙酯后,比較不同振蕩時間的提取效率,結果如圖8所示。振蕩時間越長,AMA和CAP的回收率越高,當振蕩時間為4 min時,2 種藥物的回收率與振蕩時間3 min無顯著差異。因此振蕩時間確定為3 min。加入碳酸鉀溶液后,比較不同萃取時間的提取效率,結果如圖9所示,60 s已經將樣品中的CAP和AMA幾乎完全提取出,從節約時間和效率方面考慮,最終確定萃取時間為60 s。

圖9 不同萃取時間的AMA和CAP添加回收結果Fig.9 Effect of extraction time on the recoveries of AMA and CAP
2.2.3 樣品復溶液的優化
由于藥物性質和基質效應的作用,不同緩沖體系和離子強度的復溶液會影響藥物的實際樣品添加回收率。本實驗選擇PB緩沖液作為樣品復溶液,并比較不同濃度的PB緩沖液下AMA和CAP的回收率,結果如圖10所示,隨著PB緩沖液的濃度增大,AMA的回收率先增大后趨于平穩,CAP的回收率則越來越高,當緩沖液濃度超過0.05 mol/L時,CAP的回收率超過120%。因此,確定PB緩沖液的最佳濃度為0.05 mol/L。
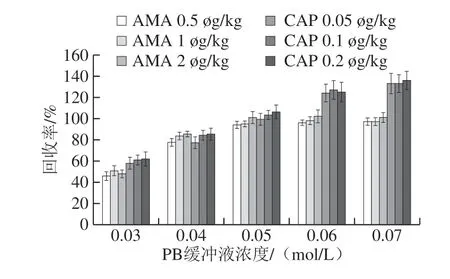
圖10 不同濃度PB緩沖液的AMA和CAP添加回收結果Fig.10 Effect of PB buffer concentration on the recoveries of AMA and CAP
2.3 精密度實驗結果
CLEIA方法的精密度以批內變異和批間變異表示。每個標準品質量濃度做6 次重復,測得質量濃度的變異系數表示批內變異;取不同批次包被的化學發光板,測得標準曲線的IC50和RLUmax值,連續進行6 d測定,以IC50和RLUmax值的變異系數表示批間變異。結果如表1~3所示,批內變異系數均小于10%,批間變異均小于5.6%,表明實驗重復性較好。
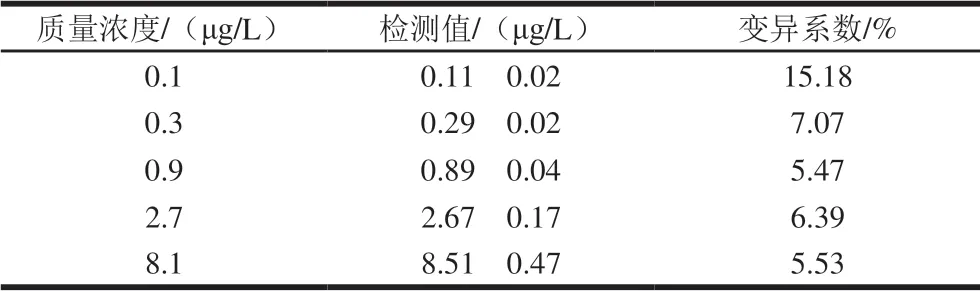
表1 AMA批內變異(n=6)Table 1 Intra-assay coefficients of variation of the CLEIA method for AMA (n= 6)

表2 CAP批內變異(n= 6)Table 2 Intra-assay coefficients of variation of the CLEIA method for CAP (n= 6)
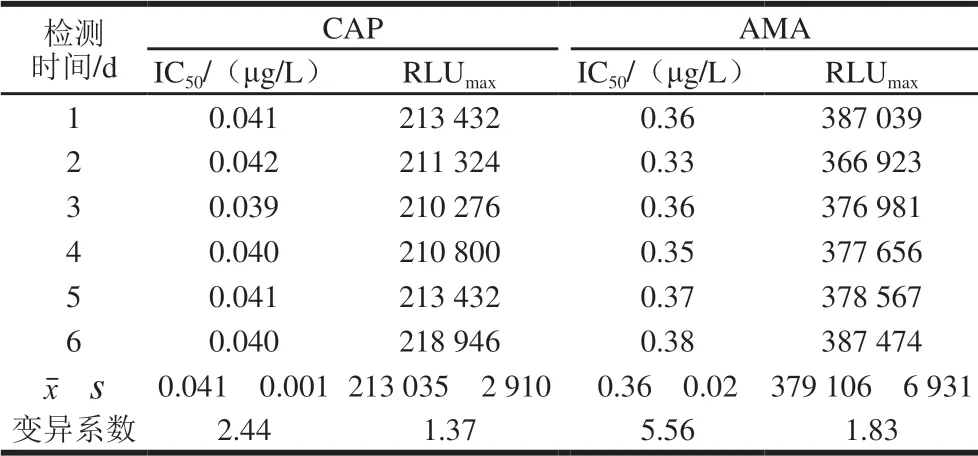
表3 AMA和CAP的批間變異(n=6)Table 3 Inter-assay coefficients of variation of the CLEIA method for AMA and CAP (n= 6)
2.4 特異性實驗結果

表4 AMA和CAP結構類似物藥物交叉反應率Table 4 Cross-reactivityof anti-AMA pAb and anti-CAP pAb determined by ic-CLEIA
由表4所示,除與金剛乙胺存在24.32%的交叉反應率外,AMA與其他結構類似物和功能類似物的交叉反應率均小于0.01%。CAP與其他結構功能類似物均不存在明顯交叉反應。表明CLEIA方法特異性良好,不易出現假陽性,錯檢等現象。
2.5 空白樣品添加實驗結果
選取高中低3 個添加量水平進行樣品添加回收實驗,結果如表5所示。其中所測樣品中AMA的平均添加回收率在92.55%~105.14%之間,CAP平均添加回收率在92.00%~112.50%之間,且兩者批內和批間變異系數小于10.48%。方法準確度能達到檢測要求,適用于禽肉樣品中AMA和CAP的檢測。
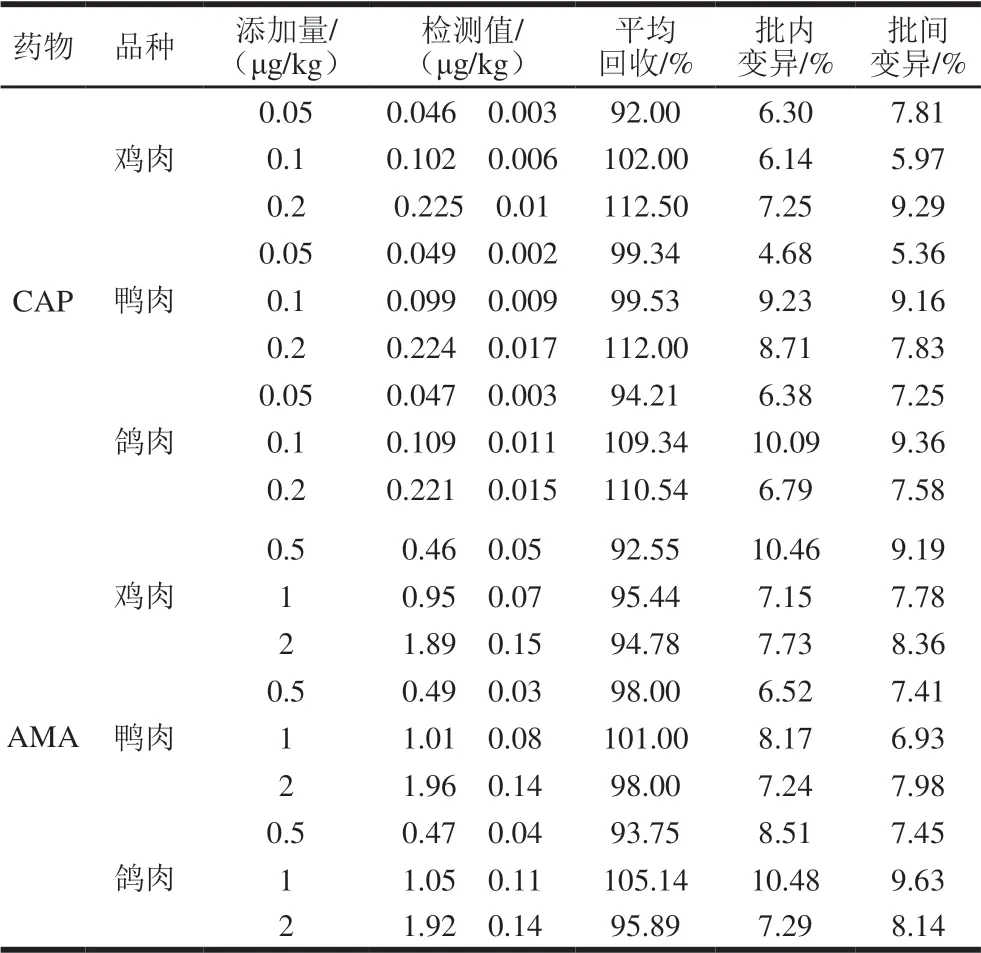
表5 AMA和CAP的實際樣品添加回收率和變異系數(n=4)Table 5 Recoveries and coefficients of variation (CVs) of AMA and CAP spiked into poultry muscles (n= 4)
2.6 儀器方法對比
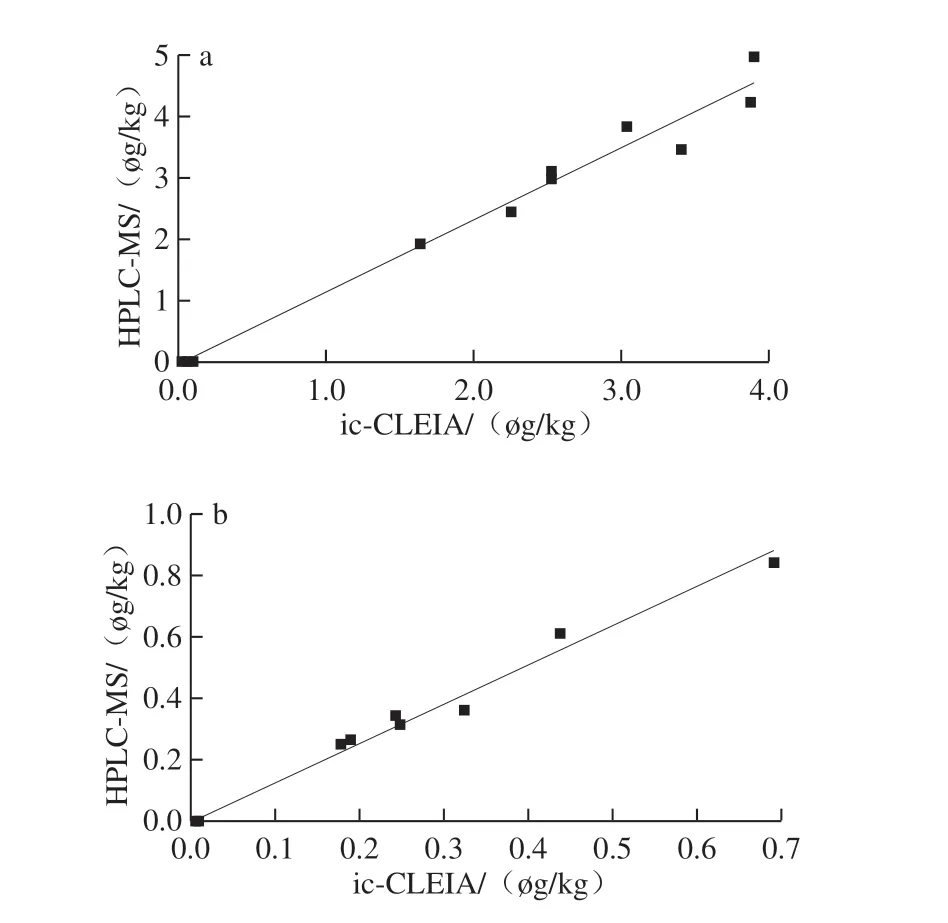
圖11 AMA(a)和CAP(b)ic-CLEIA與LC-MS方法對比Fig.11 Good linear correlation between ic-CLEIA and LC-MS values for AMA (a) and CAP (b)
隨機購買100 份家禽樣品,其中雞肉60 份、鴨肉30 份、鴿肉10 份,均質化后放入-20 ℃保存。按照建立的ic-CLEIA方法檢測所有樣品中的AMA和CAP,以DB 21/2394ü 2014的檢測限(0.5 μg/kg)作為AMA陰陽性判定值,其中檢出8 份樣品為AMA陽性,92 份樣品為AMA陰性;以GB/T 22338ü 2008的檢測限(0.1 μg/kg)作為CAP陰陽性判定值,其中檢出5 份樣品為CAP陽性,95 份樣品為CAP陰性,將可疑樣品和9 份陰性樣品分別再用ic-CLEIA方法和高效液相色譜-質譜(high performance liquid chromatography-mass spectrometry,HPLC-MS)方法檢測,進行統計學分析比較測定結果。以HPLC-MS所測得的AMA或CAP的濃度為Y軸,以ic-CLEIA測得的AMA或CAP的濃度為X軸,繪制散點圖。如圖11所示,AMA的回歸方程為Y=1.18X-0.06,R2=0.988 1;CAP的回歸方程為Y=1.278X-0.005,R2=0.989 7。說明建立的AMA和CAP的ic-CLEIA方法的測定結果準確可靠。
3 結 論
本研究建立了檢測禽肉中AMA和CAP殘留的ic-CLEIA檢測方法,AMA ic-CLEIA方法線性范圍為0.06~1.77 μg/L,IC50為0.33 μg/L,檢出限為0.06 μg/L;CAP ic-CLEIA方法線性范圍為0.010~0.179 μg/L,IC50為0.039 μg/L,檢出限為0.009 μg/L。除AMA與金剛乙胺有部分交叉外,2 種ic-CLEIA方法的特異性良好;優化了樣品前處理各項參數,制定了一種用碳酸鉀和乙酸乙酯同時提取禽肉中AMA和CAP的樣品前處理方法。在最佳條件下,AMA和CAP的添加回收率分別為92.55%~105.14%和92.00%~112.50%,變異系數均低于10.48%;經儀器方法確證,本方法及樣品前處理方法檢測結果準確可靠,可以滿足禽肉中AMA和CAP兩種藥物的實際檢測需求。與蔡云虹[11]、楊麗麗[12]酶聯免疫檢測方法相比,本方法不僅靈敏度和準確度有了顯著提高,而且能夠應用于禽肉產品多殘留藥物的同時檢測,具有良好的應用前景。

