基于網絡藥理學探討散寒除濕抗毒方治療COVID-19的物質基礎和作用機制
廖金花 王 興 彭雙鳳 凌 利 田 鑫 韋祖猛 邵 婧 李 林*
1.江西中醫藥大學,江西 南昌 330006; 2.江西中醫藥大學附屬醫院,江西 南昌 330006
2019年末以來,新型冠狀病毒肺炎(COVID-19)逐漸在全國乃至全球爆發,引起國內外的高度重視,而中醫藥在COVID-19的治療中發揮著至關重要的作用。COVID-19屬于中醫學“疫”病范疇[1],病因以“濕”為主,可稱之為“濕毒疫”,病位以上焦為主[2]。散寒除濕抗毒方為國醫大師伍炳彩的自擬方,被納入到“江西省新型冠狀病毒肺炎中醫藥防治方案(試行第三版)”(以下簡稱江西方案)中,作為治療寒濕郁肺證的推薦方,在江西省的疫情防治中取得了良好的效果[3]。
寒濕郁肺證是由于疫毒濕寒與伏燥搏結所致[4];國醫大師伍炳彩以“寒溫一統”思想為指導,以《傷寒論》-麻黃加術湯合《溫病條辨》-杏蘇散加減而成,起到散寒祛濕,理肺化痰的功效。方中麻黃為君,開腠理、透毛竅,宣肺平喘;桂枝功效有三:一則解肌發表,助君藥解表逐邪,二則溫通血脈,暢行營陰,三則化氣行水以利寒濕;白術“主風寒濕痹”(《神農本草經》),長于健脾祛濕,配麻黃以發汗祛濕;杏仁降氣平喘、蘇子降氣化痰、止咳平喘,杏、蘇與麻黃相伍,一宣一降,以助肺氣之宣降;前胡降氣化痰、桔梗與枳殼配伍宣降肺氣,既疏理胸膈氣機,又化痰止咳祛邪,三藥合用,氣順津布則痰消;陳皮、半夏行氣燥濕化痰,以上共為臣藥。茯苓健脾以杜生痰之源;生姜、大棗滋脾行津,調和脾胃;炙甘草益氣和中,助正達邪,緩和藥性,防溫燥之麻、桂辛散太過而傷元氣之弊,是使藥而兼佐藥之用。諸藥合用,邪正兼顧,共奏散寒除濕,宣降肺氣,理肺化痰之功,為散寒除濕抗毒之方劑。
文章通過網絡藥理學分析散寒除濕抗毒方的潛在有效化學成分、治療靶點及相關通路,為本方治療COVID-19提供理論基礎和科學依據,亦為本方更好的在國際抗疫中發揮積極作用提供理論支撐。
1 材料與方法
1.1 篩選與獲取散寒除濕抗毒方藥物成分 在TCMSP(http://tcmspw.com/tcmsp.php)數據庫據庫中分別輸入散寒除濕抗毒方全方生麻黃、杏仁、桂枝、炙甘草、炒白術、紫蘇、法半夏、陳皮、前胡、桔梗、枳殼、茯苓、生姜、大棗,以口服生物利用度(OB)≥30%,類藥性指數(DL)≥0.18為條件進行篩選,獲得14味中藥潛在的有效成分。
1.2 收集散寒除濕抗毒方對應靶點 基于TCMSP數據庫,根據上述篩選出的散寒除濕抗毒方中14味中藥潛在的有效成分預測作用靶點。
1.3 獲取COVID-19疾病靶點 分別在GeneCard(https://www.genecards.org/)和OMIM(https://omim.org/)數據庫以“Coronavirusdisease 2019”和“coronavirus”為關鍵詞,得到與COVID-19疾病相關的靶點。
1.4 獲取潛在作用靶點 利用Uniprot(https://www.uniprot.org/)數據庫查詢散寒除濕抗毒方可能的作用靶點蛋白對應的基因名,將其基因名和1.3獲取的疾病靶點基因名分別錄入到Venny2.1在線軟件作圖工具平臺(https://bioinfogp.cnb.csic.es/tools/venny/),制作韋恩圖,獲得交集靶點基因名,作為潛在作用靶點。
1.5 構建藥物-成分-靶點-疾病網絡圖 將中藥化學成分的靶點中與潛在作用靶點相合部分,以及“1.4”所得的潛在作用靶點導入Cytoscape 3.7.2軟件,構建“藥物-成分-靶點-疾病”相互作用網絡,使用Network Analyzer功能對藥物中的主要化學成分進行分析,節點的大小代表度(degree)值的大小。
1.6 構建清熱化濕抗毒方對COVID-19疾病的作用靶點蛋白網絡圖 將獲得的潛在作用靶點導入STRING網絡平臺(https://string-db.org/cgi/input.pl),選擇物種為Homosapiens進行分析,獲得蛋白相互作用關系表,將蛋白相互作用表導入Cytoscape 3.7.2軟件,構建蛋白相互作用網絡圖(PPI),其中節點的大小、顏色的深淺變化代表度值的大小,并根據節點的度值篩選出核心作用靶點。
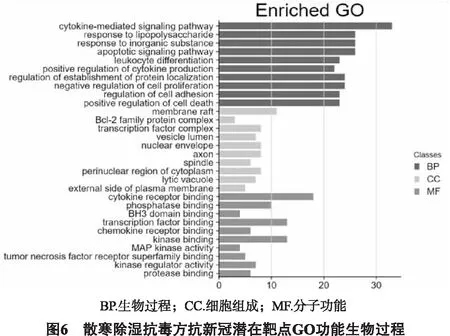
1.7 GO和KEGG富集分析 通過Metascape(https://metascape.org/)基因注釋及分析平臺對潛在作用靶點進行富集分析,得到GO(Geneontology)和KEGG(Kyotoencyclopediaofgenesandgenomes)富集分析的柱狀圖,并進行分層聚類,預測散寒除濕抗毒方化學成分主要作用靶點和潛在生物活動機制。為了進一步獲得相關生物活動之間的關系,運用Metascape對GO和KEGG富集通路進行聚類分析,獲取散寒除濕抗毒方治療COVID-19最可能的作用機制。
2 結果
2.1 中藥活性化合物及靶點的篩選 通過TCMSP數據庫以OB≥30%、DL≥0.18篩選后得到散寒除濕抗毒方活性化合物共266個,其中白術7個、半夏13個、陳皮5個、大棗29個、茯苓15個、甘草92個、桂枝7個、桔梗7個、杏仁19個、麻黃23個、前胡25個、生姜5個、枳殼5個、紫蘇14個;通過TCMSP數據庫獲取中藥成分對應的靶點,其中白術23個、半夏172個、陳皮30個、大棗435個、茯苓30個、甘草1769個、桂枝74個、桔梗92個、杏仁207個、麻黃498個、前胡373個、生姜75個、枳殼123個、紫蘇151個,去掉重復項后共289個。
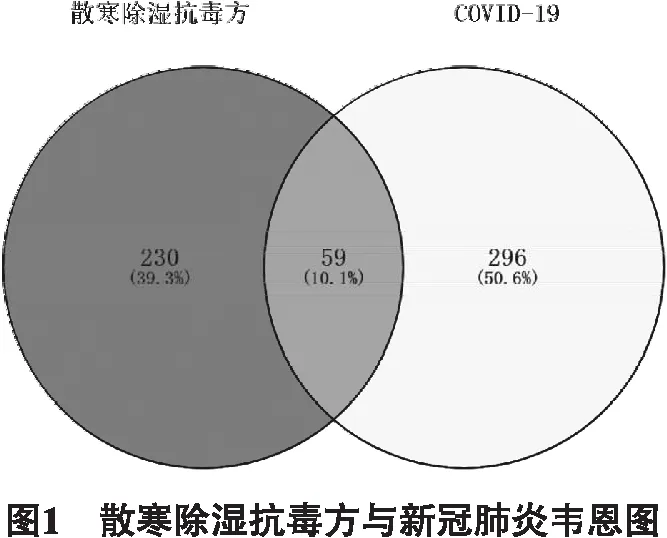
2.2 潛在作用靶點的預測 根據GeneCards、OMIM數據庫檢索到COVID-19的疾病靶點355個,在Venny2.1在線軟件作圖工具平臺輸入藥物靶點與疾病靶點,繪制韋恩圖(如圖1所示),兩者交集部分為潛在作用靶點共59個。
2.3 藥物-成分-靶點-疾病網絡圖的構建 將散寒除濕抗毒方潛在的有效成分靶點與59個潛在作用靶點輸入Cytoscape軟件,篩除與靶點無交集的孤立成分,繪制藥物-成分-靶點-疾病網絡圖(如圖2所示)。節點度值(Degree)>15(3倍中位數)的中藥潛在有效成分有7種(詳見表1),分別為槲皮素、β-谷甾醇、木犀草素、柚皮素、山柰酚、川陳皮素、(+)兒茶素,Degree>40的潛在作用靶點有14個,分別為MAPK3、TNF、IL6、TP53、CASP3、MAPK8、ALB、MAPK1、IL10、IL1B、PTGS2、CXCL8、CCL2、FOS;從表1中發現大部分為多味中藥的共有化學成分,且每種成分與多個靶點對應,一個靶點又可對應多種成分,體現了散寒除濕抗毒方多味中藥可共同作用于同一靶點,每味中藥又可作用于多個靶點的干預特點,能有效干預COVID-19的多靶點,達到較好的治療效果。
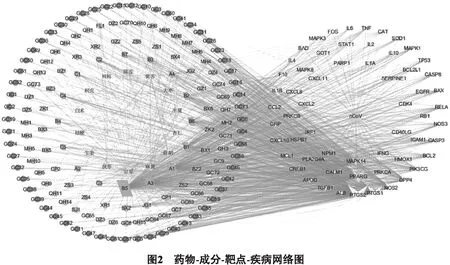

表1 Degree>10的藥物主要化學成分信息
2.4 PPI網絡圖的構建 將59個潛在作用靶點錄入STRING數據庫中,得到PPI網絡關系信息表,使用Cytoscape軟件對網絡關系信息表進行可視化分析,構建PPI網絡圖(如圖3所示)。Degree>32.5(中位數)的靶點基因有29個,與2.3中Degree>40的潛在作用靶點相互映射,取交集得到潛在核心靶點IL6、TNF、CASP3、MAPK、PPARG,推測散寒除濕抗毒方可能主要通過以上5個靶點對COVID-19進行干預治療。
為了進一步探討這些潛在靶點之間相互作用的生物過程,運用Metascape以MCODE算法識別靶點之間最密切的生物過程,收集P<0.01,最小計數為3和富集因子>1.5(富集因子是觀察到的計數與偶然期望的計數之比)的術語,并根據其成分靶點之間相互關系的密切程度得到前3個具有豐富生物過程的核心富集模塊,進行富集分析后按P值劃分,選取3個最佳功能描述(表2),圖4中左上核心富集模塊主要涉及乙型肝炎、細胞凋亡和弓形蟲病,右上核心富集模塊主要涉及糖尿病并發癥中的AGE-RAGE信號通路、癌癥的途徑和鞘脂信號通路,左下核心富集模塊主要涉及趨化因子信號通路、細胞因子與細胞因子受體的相互作用和IL-17信號通路。

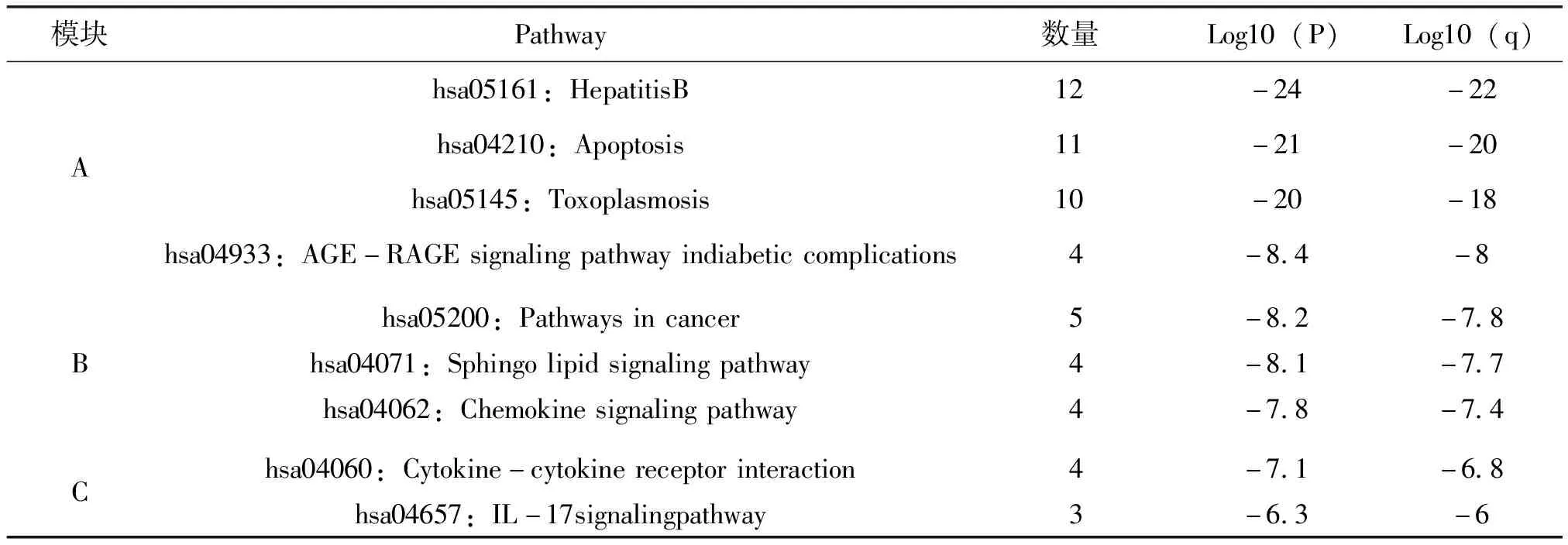
表2 核心富集模塊功能描述
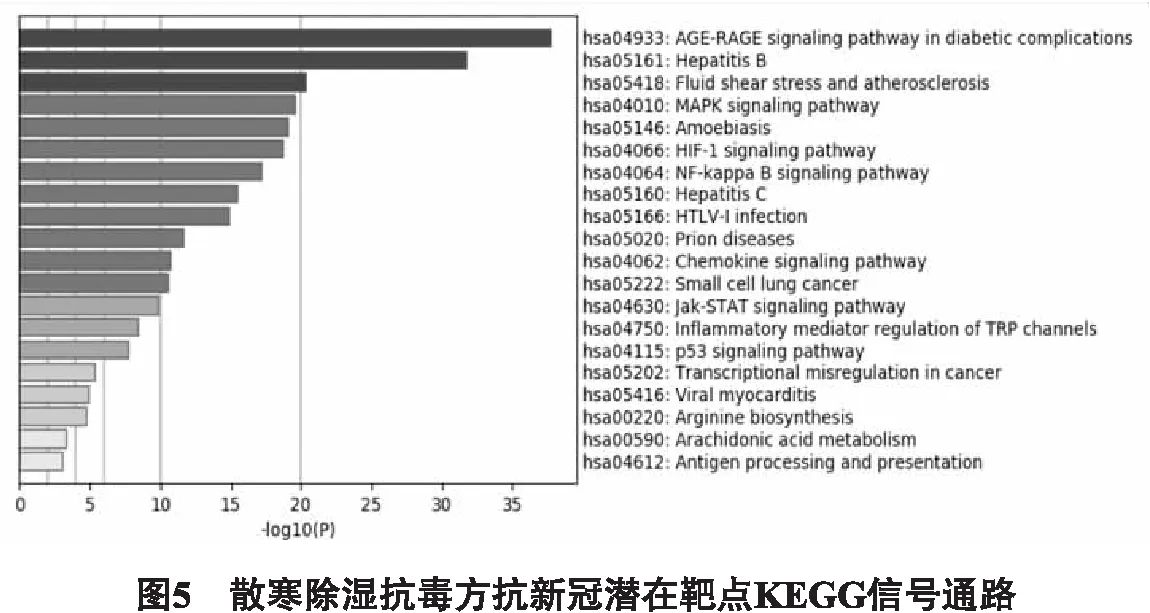
2.5 富集分析 為探討上述59個交集靶點在治療COVID-19中的作用機制,運用Metascape對59個的靶點進行KEGG(如圖5所示)和GO(如圖6所示)富集分析,KEGG分析得到206條通路途徑,GO分析得到419分子功能、4435個生物學過程、323個細胞組分,KEGG取前20條通路,GO 分子功能、生物學過程和細胞組分分別取前10個作為重點展示。主要涉及的KEGG富集通路主要涉及:糖尿病并發癥的年齡-憤怒信號通路、MAPK信號通路、趨化因子信號通路;GO生物學過程:細胞因子介導的信號通路、凋亡信號通路、調節細胞粘附等;GO細胞組成:膜筏、Bcl-2家族蛋白復合物、轉錄因子復合體等;GO分子功能:細胞因子受體結合、磷酸酶結合、BH3域綁定、轉錄因子結合、趨化因子受體結合等。
3 討論
《說文解字》中提到“疫者,民皆病也”,疫病具有強烈的傳染性,本次COVID-19亦屬于中醫“疫”病范疇[5]。針對此次疫情,仝小林院士等[6]通過實際調查,初步提出本病歸屬于“寒濕疫”,認為“寒濕”是COVID-19爆發的關鍵因素。國醫大師伍炳彩認為對于COVID-19寒濕兼燥者,當以麻黃加術湯去寒濕,合用杏蘇散治涼燥,故自擬散寒除濕抗毒方用于治療寒濕兼燥的新冠肺炎[7],現已被納入到江西方案中作為推薦方,為新冠肺炎治療提供了江西方案。
本研究共篩選出散寒除濕抗毒方治療COVID-19的148個成分,運用Cytoscape 3.7.2通過中位Degree值篩選得到7個主要潛在成分,其中6種為黃酮類化合物,分別為槲皮素、β-谷甾醇、木犀草素、柚皮素、山柰酚、川陳皮素,另1種為黃烷衍生物(+)兒茶素。散寒除濕抗毒方與COVID-19有59個交集靶點,通過PPI網絡與“藥物-成分-靶點-疾病網絡”相映射發現本方可能主要通過作用于IL6、TNF、CASP3、MAPK、PPARG等潛在核心靶點,改善新冠肺炎患者臨床癥狀,從而達到干預COVID-19的效果。
3.1 散寒除濕抗毒方通過調節免疫-炎癥反應干預COVID-19 COVID-19入侵人體后可誘導過度的炎癥反應,導致彌漫性肺損傷、ARDS、多器官衰竭甚至死亡。因此,調控免疫-炎癥反應是治療COVID-19,改善臨床癥狀的途徑之一[8];涉及的化合物有:槲皮素、β-谷甾醇、木犀草素、柚皮素、山柰酚、川陳皮素;涉及的靶點有:PTGS2、TNF、IL6、IL-10。
有研究發現,槲皮素能抑制巨噬細胞分泌PTGS2,刺激巨噬細胞進一步分化成熟,成為活化巨噬細胞,增強吞噬功能,從而調節免疫炎癥反應[9];又有研究發現槲皮素可以抑制單純皰疹病毒1型感染誘導的IRF-3和NF-JB的激活,減少RAW264.7細胞產生的炎癥因子:腫瘤壞死因子-α(TNF-α)[10]。β-谷甾醇可通過下調IL6和TNF-α水平,改善炎癥反應[11];柚皮素能通過抑制環氧合酶(COX),減少前列腺素PGE2的合成,減少炎性因子的釋放,調節免疫炎癥反應[12];山柰酚可減少促炎細胞因子(IL-12和TNF-α)的釋放,并通過抑制IKK的磷酸化和IKBα的降解來調節NF-KB的水平,從而改善CPL介導的炎癥[13];川陳皮素能抑制腎小球系膜細胞HBZY-1炎癥因子MCP-1和IL6的表達水平,減輕炎癥反應[14];(+)兒茶素中所含的要表沒食子兒茶酚沒食子酸(EGCG)及表沒食子兒茶酚(EGC)在MDCK細胞中對流感病毒的復制具有抑制活性,其中EGCG可能與病毒粘合,防止病毒入侵MDCK細胞,間接減輕炎癥反應[15]。
3.2 散寒除濕抗毒方可能通過調控細胞凋亡干預COVID-19 細胞凋亡主要有三種途徑:線粒體通路、死亡受體通路和內質網通路。冠狀病毒主要通過外在途徑(死亡受體通路)誘導細胞凋亡。散寒除濕抗毒方可通過PARP1、CASP3、CASP8、MAPK1、MAPK3、MAPK8、TNF、TP53等靶點調控細胞凋亡。
研究發現:SADS-CoV感染時細胞可出現明顯的CPE,顯微鏡下可見凋亡細胞胞質固縮和細胞膜融合、染色質凝縮并附在核膜周邊,形成凋亡小體[16]。Fas/CD95 是細胞膜上主要的死亡受體,許多冠狀病毒的S蛋白可誘導激活細胞膜死亡受體,最終引起由 Caspase 級聯信號途徑誘導的細胞凋亡[17]。SARS-CoV誘導的細胞凋亡依賴于Caspase家族,Caspase抑制劑過表達可抑制細胞凋亡[18]。木犀草素既能通過調控CASP8、CASP3的表達干預流感病毒誘導的細胞凋亡[18],又能通過降低過氧化物酶活性、TNF-α和IL6水平,以及提高IL-4和IL-10水平,抑制NF-KB,從而抑制細胞凋亡途徑[18];新冠患者心肌細胞或激活后白細胞釋放的TNF、IL6具有啟動凋亡程序的作用[23]。散寒除濕抗毒方可通過調控細胞凋亡過程,進而對COVID-19進行干預。
3.3 散寒除濕抗毒方可能通過鞘脂類信號通路干預COVID-19 鞘脂類通路激活,可使血管通透性增加,表面活性劑鈍化,肺泡上皮細胞凋亡,誘發肺水腫[24]。散寒除濕抗毒方可通過靶點:BAX、BCL2、MAPK14、NOS3、PRKCA、PRKCB、MAPK1、MAPK3、MAPK8、RELA、TNF、TP53調節鞘脂類信號通路,緩解肺水腫及肺組織損傷。
國內第一例新冠尸體解剖發現:右肺嚴重淤血,肺水腫,心外膜水腫。故調節血管屏障對新冠肺炎的治療具有重要的臨床意義[25-26]。而鞘脂類物質是一種極其重要的血管生成因子和具有強大的血管屏障調節特性的信號介質。鞘氨醇1-磷酸(S1P)是神經鞘磷脂代謝產生的一種有生物活性的脂類,由神經酰胺代謝產生,S1P已在體外被證實了具有增強肺血管屏障的功能[27-29];血小板一直被認為可以降低血管內皮通透性,研究發現,S1P是人類血小板產生的關鍵屏障保護性介質[30];S1PR4和S1PR5可與Giand G12/13偶聯,通過G12/13的信號可以抑制遷移,降低內皮屏障功能,并通過促進GTPase Rho和Rho相關激酶(ROCK)的激活來誘導血管收縮;S1P還能有效減輕NOS2刺激的肺損傷[30]。散寒除濕抗毒方中的化合物山奈酚、槲皮素、木犀草素都具有調控鞘脂類信號通路的作用。
綜上可知,散寒除濕抗毒方可通過調節免疫-炎癥反應,以及通過調控細胞凋亡及鞘脂類信號通路,對COVID-19進行干預。散寒除濕抗毒方作為國醫大師伍炳彩的自擬方,被選入“江西方案”中作為推薦方,其對于新冠肺炎的治療效果在臨床中也已經得以證實。本研究通過對散寒除濕抗毒方的藥物潛在有效成分、潛在作用靶點及相關通路進行分析,預測散寒除濕抗毒方治療COVID-19的潛在作用機制,為中醫藥治療COVID-19提供一定的理論基礎和科學依據,為后續研究及開發院內制劑提供參考。

