淫羊藿甙干預脂肪間充質干細胞修復膝骨性關節炎的作用及相關機制研究
余永林 吳家順 熱合米丁·艾買提 周 倩 劉華慧 管曉舫
(武漢市中醫醫院二橋院區,武漢 430051)
骨性關節炎又稱退行性關節炎、老年性關節炎等,是因關節軟骨受到磨損或破壞引發的關節與關節周圍病變,其病理改變以軟骨退變為核心,伴隨關節邊緣骨質增生與關節周圍軟組織炎癥反應。臨床上主要通過非甾體類抗炎藥物緩解骨性關節炎的癥狀,目前尚無直接治愈或能夠完全修復重建軟骨組織的藥物,因此軟骨損傷與退變后的修復重建一直是醫學研究的難題。
間充質干細胞(mesenchymal stem cell,MSC)具有良好的旁分泌能力與免疫調節活性,可直接分化形成特異性結締組織細胞并遷移至受損部位,刺激祖細胞增殖,抑制軟骨細胞凋亡與軟骨變性,進而促進組織修復,在骨性關節炎與軟骨損傷治療中具有重要意義[1-3]。脂肪間充質干細胞(adipose mesenchymal stem cell,AMSC)與其他成體干細胞相比,具有來源豐富、增殖能力強、體積小、可傳代次數多、干細胞特性穩定等諸多優勢,在骨性關節炎與軟骨損傷治療中受到廣泛關注,并取得了較好的效果[4-5]。
淫羊藿甙為淫羊藿的主要有效成分,具有補腎陽、壯筋骨等藥理活性,可促進骨髓細胞DNA合成并激活成骨細胞信號通路,促進MSC的成骨分化,促進骨形成,同時還可以通過調節炎癥與免疫等改善軟骨微環境,已成為治療骨性關節炎的常用中藥[6-7]。體外研究顯示,淫羊藿甙可促進MSC增殖并誘導其向軟骨細胞分化[8]。本實驗主要觀察淫羊藿甙干預的AMSC治療兔骨性關節炎的效果,并分析其可能的作用機制,以期為中藥聯合MSC移植治療骨性關節炎的臨床應用提供實驗室依據。
1 材料與方法
1.1材料
1.1.1實驗動物 健康成年雄性新西蘭大白兔,清潔級,體重2.3~2.5 kg,單籠飼養,采用標準飼料喂養,飼養環境溫度20℃~25℃,相對濕度50%~60%,自由進食水,正常光照。嚴格依照《關于善待實驗動物的指導性意見》中相關規定處理與飼養實驗動物。
1.1.2實驗應用的主要試劑 淫羊藿甙(489-32-7,純度:98%)為麻城市進鑫生物科技有限公司產品;一氧化氮(NO)、IL-1、TNF-α ELISA檢測試劑盒為上海仁捷生物科技有限公司產品;TLR4、MyD88、TRAF6、NF-κB p65一抗為艾博抗(上海)貿易有限公司產品;HRP標記的二抗為博士德生物工程有限公司產品;DMEM培養基為武漢純度生物科技有限公司產品;胎牛血清為南京生航生物技術有限公司產品。
1.2方法
1.2.1提取與鑒定AMSC 以3 ml/kg的劑量腹腔靜脈注射10%水合氯醛麻醉新西蘭大白兔3只,分離獲取其頸背部皮下的脂肪組織,去除血管等組織,PBS清洗3次后雙抗浸泡10 min,PBS清洗3次,將脂肪組織剪碎至乳糜狀后置于15 ml離心管,加入3倍體積的Ⅰ型膠原酶消化25 min,以含胎牛血清的培養基終止消化后過濾膠原酶消化液與脂肪顆粒,2 000 r/min 離心8 min,棄上清,加入含胎牛血清的DMEM培養基,8 h后首次換液,以后每3 d換液1次。約6 d時胰酶消化后第1次傳代,以后每第4~5 d傳代1次,直至得到第2代AMSCs。取第2代AMSCs懸液,調整細胞濃度為1×106個/ml,分裝于EP管中,分別加入單抗(CD90-FITC、CD105-FITC、CD44-FITC、CD14-FITC、CD45-FITC、CD19-FITC)標記,流式細胞術檢測AMSC免疫細胞表型。
1.2.2配制淫羊藿甙培養基 將2 mg淫羊藿甙溶解于2 ml DMSO,加入20 μl PBS,采用 0.22 μm 微孔濾膜過濾除菌,獲得1 mg/L的淫羊藿甙溶液,置于4℃環境中備用。進行實驗時,采用含10%胎牛血清的DMEM培養基將淫羊藿甙溶液配制成20、40、60 g/L的濃度使用。
1.2.3淫羊藿甙對AMSC增殖的影響 ①提取第2代AMSCs,胰酶消化后接種于96孔板,150 μl/孔(約含細胞5×106個),觀察細胞貼壁后分5組處理,A組更換為含10%胎牛血清的DMEM培養基,B組更換為成軟骨誘導培養基,C組更換為20 g/L的淫羊藿甙培養基,D組更換為40 g/L的淫羊藿甙培養基,E組更換為60 g/L的淫羊藿甙培養基,每組3復孔,培養48 h內,每孔加入MTT液15 μl,檢測細胞增殖吸光度值。以此結果篩選細胞增殖良好的淫羊藿甙濃度;②提取第2代AMSCs,胰酶消化后接種于96孔板,150 μl/孔(約含細胞5×106個),觀察細胞貼壁后分3組處理,F組更換為含10%胎牛血清的DMEM培養基,G組更換為成軟骨誘導培養基,H組更換為60 g/L的淫羊藿甙培養基,每組3復孔,培養3 d內每天取1塊板進行MTT檢測。以此篩選細胞增殖良好的處理時間。
1.2.4淫羊藿甙對AMSC軟骨分化的影響 取F、G、H組細胞,每隔1 d換液一次,培養 21 d 后進行甲苯胺藍染色,觀察軟骨基質生成情況。
1.2.5建立骨關節炎動物模型 采用10%水合氯醛麻醉30只新西蘭大白兔,將其仰臥位固定,在右后肢關節間隙切3 cm的縱行切口,打開關節腔后切斷內側副韌帶,打開關節囊后切斷前交叉韌帶并剔除內側半月板,生理鹽水沖洗后消毒,逐層縫合后包扎傷口。術后肌注抗生素預防感染。術后6周制作右膝關節軟骨病理切片證實造模成功。造模成功后2周將實驗兔隨機分3組,實驗組右側膝關節腔內注射60 g/L淫羊藿甙溶液干預3 d的AMSCs懸液1 ml(約含細胞數1×107個),對照組右側膝關節腔內注射AMSCs懸液1 ml(約含細胞數1×107個),空白組右側膝關節腔內注射生理鹽水1 ml。
1.2.6關節液炎癥因子檢測 干細胞注射14 d后麻醉大鼠,向右后肢膝關節內注射1 ml生理鹽水,反復抽吸數次后抽取關節液,2 500 r/min離心12 min,將上清液置于-20℃環境中保存。ELISA法檢測上清液內NO、IL-1與TNF-α濃度。操作步驟嚴格按照試劑盒說明書進行。
1.2.7關節軟骨病理切片分析 關節液抽吸完成后處死所有大鼠,分離獲取膝關節軟骨標本。將其置于100 g/L多聚甲醛中48 h,4℃脫鈣4周,進行常規石蠟包埋與切片處理,切片厚度約4 μm,取部分切片進行常規蘇木精-伊紅染色,無水乙醇脫水后二甲苯透明,中性樹膠封固后鏡下觀察。
1.2.8軟骨損傷Mankin′s評分 由兩名對實驗不知情的病理科醫師對膝關節軟骨病理切片進行Mankin′s評分,最后計算平均分。該評分包括軟骨結構、軟骨細胞數量與潮線的完整與否3個方面,評分0~14分,評分高說明軟骨破壞嚴重。
1.2.9軟骨細胞凋亡檢測 取部分膝關節軟骨標本切片脫蠟,加入蛋白酶K工作液反應20 min,PBS清洗3次后添加TUNEL反應混合液反應60 min,PBS清洗4次后添加DAB顯色液反應5 min,蘇木精復染40 s,鏡下觀察細胞凋亡情況。每張切片隨機選取6個視野記錄凋亡細胞數與細胞總數,計算凋亡率。
1.2.10軟骨組織內蛋白表達檢測 取軟骨組織50 μg,加入適量裂解液檢測蛋白濃度,上樣電泳,轉膜,以含脫脂奶粉的封閉液浸泡PVDF膜2 h;將PVDF膜浸泡于稀釋的一抗[TLR4(1∶1 000)、MyD88(1∶1 000)、TRAF6(1∶1 000)、NF-κB p65(1∶500)、β-actin(1∶1 000)]孵育液內24 h;清洗PVDF膜5次,將其浸泡于HRP標記的二抗孵育液內2 h;清洗PVDF膜5次,ECL顯色、曝光。
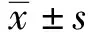
2 結果
2.1AMSC鑒定結果 流式細胞術檢測顯示,AMSC高表達CD90、CD105、CD44,低表達CD14、CD45、CD19,表現出了較高的細胞純度,見圖1。
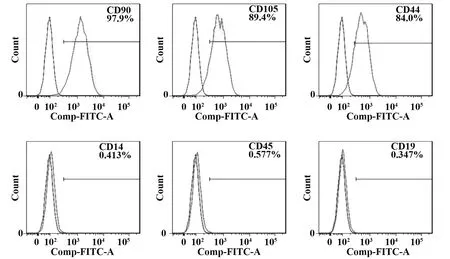
圖1 流式細胞術檢測AMSCs免疫表型
2.2淫羊藿甙對AMSC增殖的影響 培養48 h后,A、C組細胞增殖吸光度值比較差異無統計學意義(P>0.05),B、E組比較差異無統計學意義(P>0.05),B、D、E組細胞增殖吸光度值高于A組(P<0.05),B、E組細胞增殖吸光度值高于D組(P<0.05),見圖2A,結果顯示60 g/L的淫羊藿甙培養基可明顯促進AMSCs增殖。培養3 d內,F、G、H組細胞增殖吸光度值均隨時間延長逐漸增加,培養1 d時3組間細胞增殖吸光度值比較差異無統計學意義(P>0.05);培養2 d、3 d時的G、H組細胞增殖吸光度值高于F組,且G、H組細胞增殖吸光度值比較差異無統計學意義(P>0.05),見圖2B,結果顯示60 g/L淫羊藿甙培養基培養3 d可明顯促進AMSCs增殖。
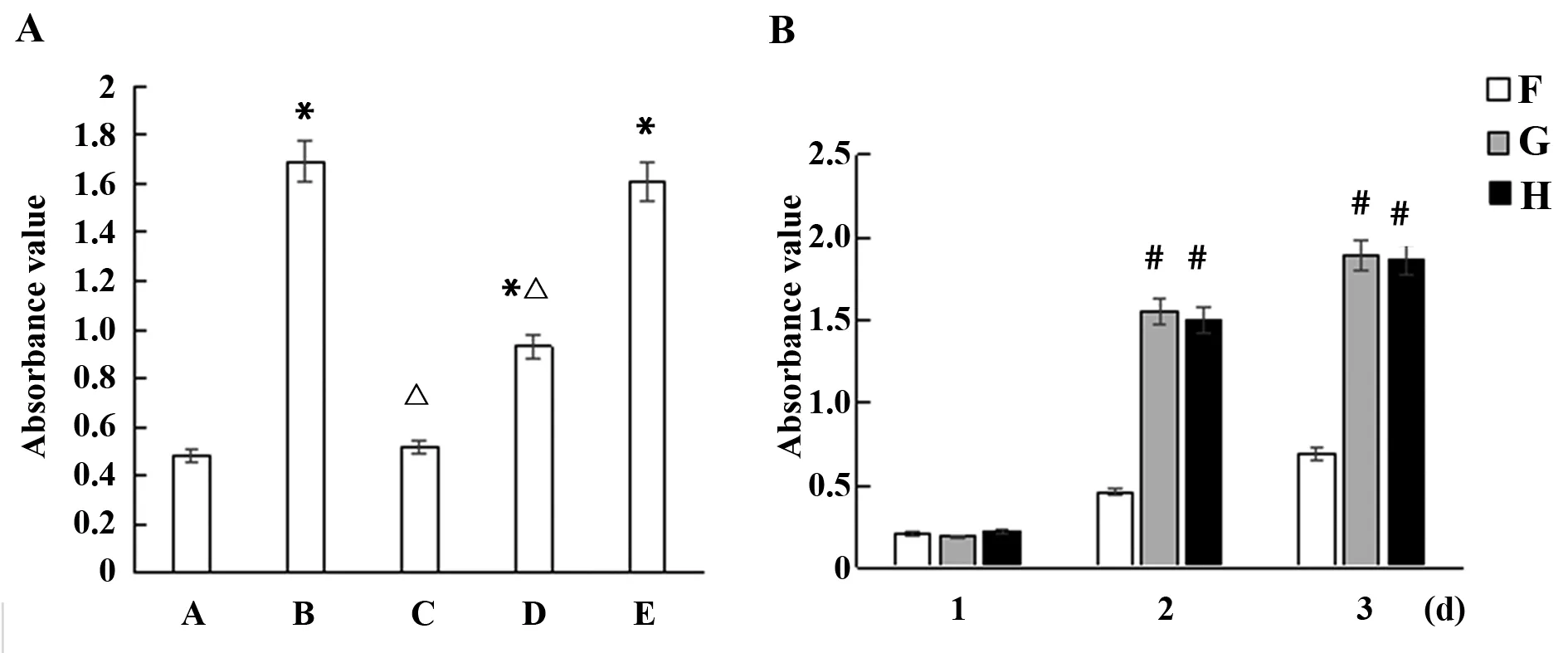
圖2 細胞增殖檢測結果
2.3淫羊藿甙對AMSC軟骨分化的影響 F組未見特征性甲苯胺藍異染(圖3A),G、H組胞漿可見特征性的甲苯胺藍異染(圖3B、C)。
圖3 AMSCs的甲苯胺藍染色(×100)
2.4關節液炎癥因子檢測 空白組關節液內NO、IL-1與TNF-α濃度高于對照組和實驗組(P<0.05);對照組NO、IL-1與TNF-α濃度高于實驗組(P<0.05),見表1。
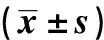
表1 各組炎癥因子濃度比較
2.5關節軟骨病理切片分析 空白組軟骨表面粗糙不平整,軟骨層較薄,軟骨細胞排列紊亂,表層可見脫落的軟骨細胞,深層可見軟骨細胞減少或簇集排列,潮線模糊不清;對照組軟骨表面較光滑且平整,關節軟骨層次較完整,軟骨細胞排列較空白組規則,軟骨細胞數量較多,可見較清晰的潮線;實驗組軟骨表面光滑平整,各層細胞排列規則有序,軟骨細胞數量多于對照組,可見清晰且完整的潮線,見圖4。
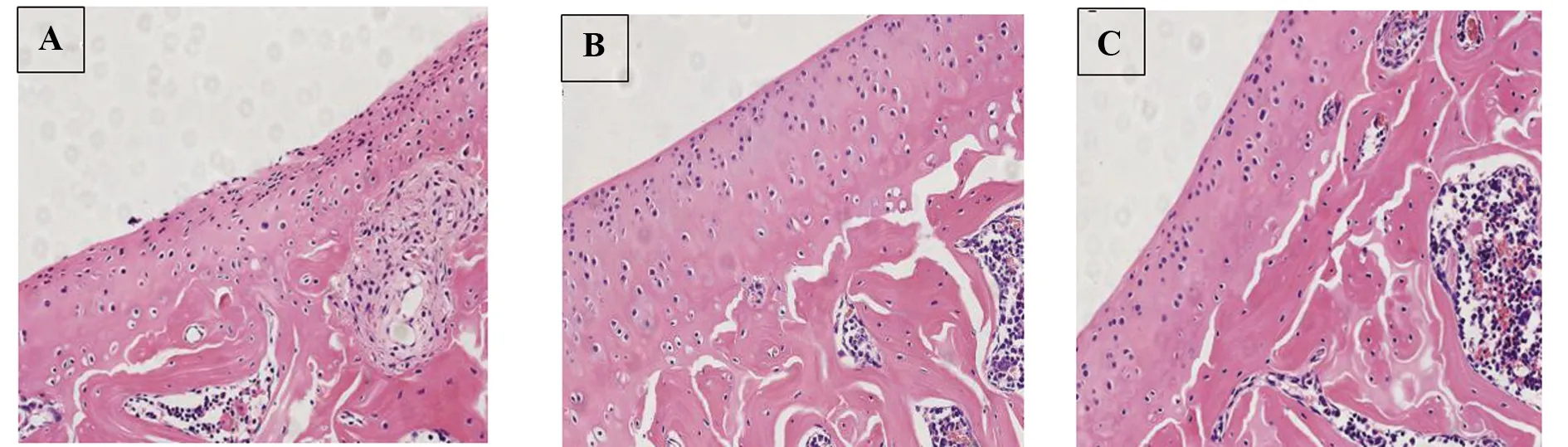
圖4 各組軟骨切片病理觀察(×100)
2.6軟骨損傷Mankin′s評分 空白組、對照組、實驗組軟骨損傷Mankin′s 評分分別為9.24±1.27、6.17±1.47、4.36±0.78,空白組評分高于對照組、實驗組(P<0.05),對照組高于實驗組(P<0.05)。
2.7軟骨細胞凋亡檢測 空白組凋亡軟骨細胞最多,實驗組凋亡的軟骨細胞最少,見圖5。空白組、對照組、實驗組軟骨細胞凋亡率分別為(30.28±6.13)%、(19.23±2.09)%、(12.66±1.17)%,空白組細胞凋亡率高于對照組、實驗組(P<0.05),對照組高于實驗組(P<0.05)。
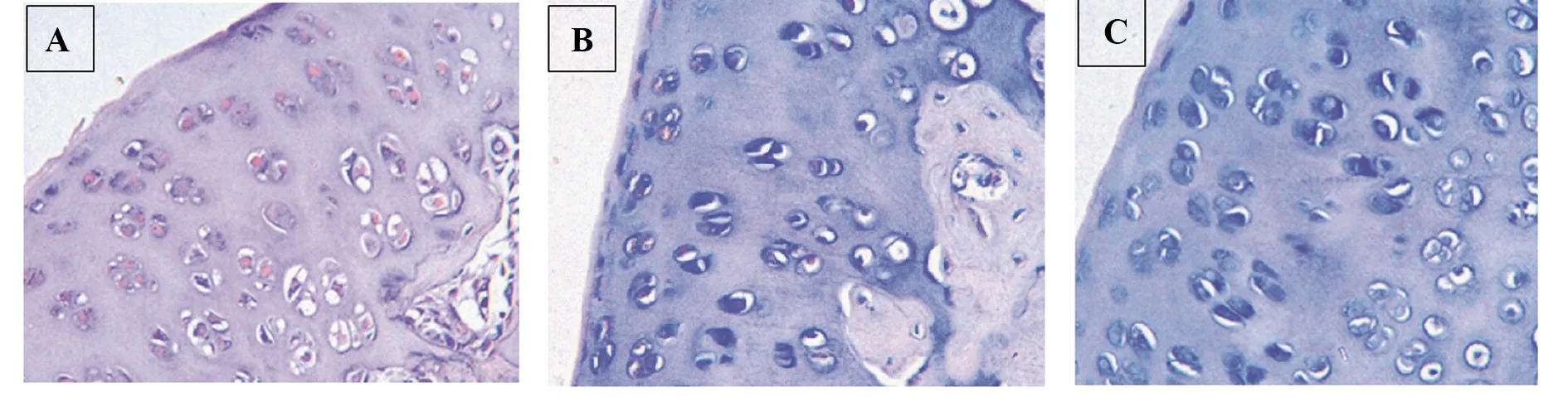
圖5 各組軟骨細胞凋亡觀察(×200)
2.8軟骨組織內蛋白表達檢測 與空白組相比,對照組與實驗組軟骨組織內的TLR4、MyD88、TRAF6與NF-κB p65蛋白表達量均減少(P<0.05);且實驗組TLR4、MyD88、TRAF6、NF-κB p65蛋白表達量均低于對照組(P<0.05),見圖6。
圖6 各組軟骨組織內蛋白表達檢測
3 討論
MSC在干細胞生物學研究、細胞與基因治療及組織工程研究中具有重要的應用價值,但是將其應用于臨床還需要經體外擴增獲得足夠數量的MSCs。生長因子可促進MSCs增殖,但價格較高,且在臨床應用中有諸多限制,因此近些年多數研究者開始利用中藥或中藥的有效成分促進AMSCs增殖。淫羊藿甙作為淫羊藿的有效成分價格低廉,可促進軟骨細胞的增殖與軟骨基質的分泌,抑制炎癥反應,有效治療骨關節炎。本實驗結果顯示,淫羊藿甙在體外呈濃度與時間依賴性促進MSCs增殖,驗證了既往研究結論[9]。此外實驗也證實,適當濃度的淫羊藿甙在體外可促進AMSCs分化為軟骨細胞。由此科研組認為通過淫羊藿甙的誘導可調控AMSCs的增殖與向軟骨細胞的分化。但是實驗設計的淫羊藿甙濃度與作用時間有限,對于最佳的干預濃度與干預時間還有待進一步探討。
骨性關節炎的病理改變非常復雜,其主要骨病理變化為關節軟骨的變性與炎癥因子的沉積等[10-11]。骨性關節炎患者關節腔內存在大量促炎癥因子介導或促進關節軟骨的破壞與關節周圍骨贅的形成,進而促進骨性關節炎的形成或加重骨性關節炎,因此關節腔內炎癥因子水平可反映骨性關節炎的嚴重程度[12]。本實驗結果顯示造模后兔關節腔內的NO、IL-1與TNF-α濃度明顯升高,此3種炎癥因子在關節腔內高水平聚集后作用于細胞,同時炎癥因子間又相互協同作用,激活相關的信號轉導通路,破壞關節軟骨細胞與滑膜細胞的代謝,誘發關節軟骨的降解、退變、老化及凋亡,加劇了關節炎癥。應用淫羊藿甙溶液干預的AMSCs懸液治療后,可顯著降低骨性關節炎兔關節腔內的炎癥因子水平,進而降低關節軟骨的降解、退變與軟骨細胞的凋亡,此結果在病理觀察中得到證實。并且這種關節軟骨的保護作用明顯優于單獨AMSC的應用。科研組認為淫羊藿甙溶液干預的AMSC可抑制關節腔內炎癥因子水平,改善關節內微環境,降低關節軟骨的降解并減少軟骨細胞的凋亡,具有關節軟骨保護作用。
本實驗結果顯示應用淫羊藿甙溶液干預的AMSCs懸液治療可顯著降低骨性關節炎兔關節軟骨內的TLR4、MyD88、TRAF6、NF-κB p65蛋白表達。NF-κB p65是NF-κB轉錄因子在細胞中較常見的作用形式,與炎癥因子產生、細胞增殖與凋亡、細胞外基質交聯密切相關[13-14]。TLR4是Ⅰ型跨膜蛋白受體之一,其可通過下游的MyD88依賴性信號轉導通路來激活各種炎癥因子,研究證實其與骨性關節炎的發病與發展密切相關[15]。TLR4與MyD88締合后將TRAF6募集到TLR4與MyD88的復合體,導致TRAF6的磷酸化,由磷酸化銜接子分子復合物將信號傳播到下游MAP激酶-AP1和IKK復合物NF-κB,刺激炎癥因子的釋放。本實驗結果說明,淫羊藿甙干預可能通過降低TLR4、MyD88、TRAF6、NF-κB p65蛋白的表達來減少關節腔內的NO、IL-1與TNF-α濃度,從而抑制炎癥反應,進而降低關節軟骨的降解并減少軟骨細胞的凋亡。由此課題組認為淫羊藿甙發揮關節軟骨的保護作用可能與調節TLR4/NF-κB信號通路有關。但是在淫羊藿甙發揮關節軟骨的保護作用中是只通過TLR4/NF-κB信號通路還是有其他通路參與目前還不能得出確切的結論,下一步將進行TLR4/NF-κB信號通路阻斷實驗加以驗證。
采用淫羊藿甙干預AMSCs可降低關節腔內NO、IL-1與TNF-α等炎癥因子水平,改善骨性關節炎的微環境,抑制關節軟骨細胞的凋亡,從而達到保護關節軟骨的作用,且該作用可能與調節TLR4/NF-κB信號通路有關。本實驗為中藥聯合MSCs治療骨性關節炎提供了一定的實驗數據。

