基于AMPK/SIRT1/PGC-1α信號通路研究香青蘭總黃酮對大鼠心肌缺血再灌注損傷的保護機制
趙云麗 袁勇 馬曉莉 黃川生 文志萍 郭新紅 王新春

摘 要 目的:研究香青蘭總黃酮(TFDM)對腺苷酸活化蛋白激酶(AMPK)/沉默信息調節因子1(SIRT1)/過氧化物酶體增殖物激活受體γ輔激活因子1α(PGC-1α)信號通路的影響,探究其保護大鼠心肌缺血再灌注損傷(MIRI)的作用機制。方法:將50只健康雄性SD大鼠隨機分為假手術組、模型組、TFDM組[60 mg/(kg·d),以提取物計]、Compound C+TFDM組[灌胃60 mg/(kg·d)TFDM+再灌注前15 min尾靜脈注射250 μg/kg Compound C (AMPK抑制劑)]、EX-527+TFDM組[灌胃60 mg/(kg·d)TFDM+再灌注前20 min腹腔注射5 mg/kg EX-527(SIRT1抑制劑)],每組10只。每天灌胃給藥1次,連續7 d。末次灌胃給藥后,假手術組大鼠行假手術,其余4組大鼠均采用結扎冠狀動脈左前降支缺血30 min、再灌注2 h構建MIRI模型。再灌注結束后,采用蘇木精-伊紅染色法觀察大鼠心肌組織病理學變化;采用反相高效液相色譜法測定其心肌組織中腺苷三磷酸(ATP)、腺苷二磷酸(ADP)、腺苷一磷酸(AMP)及煙酰胺腺嘌呤二核苷酸(NAD+)的含量;采用實時熒光定量-聚合酶鏈式反應法檢測大鼠心肌組織中AMPK、SIRT1和PGC-1α mRNA表達水平;采用Western blotting法檢測大鼠心肌組織中AMPK蛋白的磷酸化水平和SIRT1、PGC-1α蛋白表達水平。結果:與假手術組比較,模型組大鼠心肌纖維排列紊亂、橫向條紋消失,細胞腫脹破裂、壞死,細胞核變形移位;心肌組織中ATP、NAD+含量和AMPK、SIRT1、PGC-1α mRNA表達水平以及SIRT1、PGC-1α蛋白表達水平均顯著降低(P<0.05或P<0.01),ADP、AMP含量及AMPK蛋白的磷酸化水平均顯著升高(P<0.01)。與模型組比較,TFDM組大鼠心肌病理學形態明顯改善;心肌組織中ATP、NAD+含量和AMPK、SIRT1、PGC-1α mRNA表達水平以及AMPK蛋白的磷酸化水平和SIRT1、PGC-1α蛋白表達水平均顯著升高(P<0.05或P<0.01),ADP、AMP含量均顯著降低(P<0.01)。與TFDM組比較,Compound C+TFDM組和EX-527+TFDM組大鼠上述指標的改善作用均被逆轉(P<0.05或P<0.01)。結論:TFDM可能是通過激活AMPK/SIRT1/PGC-1α信號通路,調節能量代謝,從而發揮其對心肌的保護作用。
關鍵詞 香青蘭總黃酮;能量代謝;腺苷酸活化蛋白激酶;沉默信息調節因子1;過氧化物酶體增殖物激活受體γ輔激活因子1α;機制
中圖分類號 R285 文獻標志碼 A 文章編號 1001-0408(2021)03-0278-06
DOI 10.6039/j.issn.1001-0408.2021.03.05
ABSTRACT? ?OBJECTIVE: To study the effects of Dracocephalum moldavica total flavonoids (TFDM) on AMPK/SIRT1/PGC-1α signaling pathway, and to explore the mechanism of its protective effect on myocardial ischemia reperfusion injury (MIRI) rats. METHODS: Totally 50 healthy male SD rats were randomly divided into sham operation group, model group, TFDM group [60 mg/(kg·d), by extract], Compound C+TFDM group [ig administration of 60 mg/(kg·d) TFDM+intravenous injection of 250? ? ? ? μg/kg Compound C (AMPK inhibitor) via tail vein 15 min before reperfusion], EX-527+TFDM group [ig administration of 60 mg/(kg·d) TFDM+ip injection of 5 mg/kg EX-527 (SIRT1 inhibitor) 20 min before reperfusion], with 10 rats in each group. They were given relevant medicine intragastrically, once a day, for consecutive 7 days.? After last ig administration, sham operation group underwent sham operation, other 4 groups were established MIRI model by ligating left anterior descending coronary artery, ischemia for 30 min and reperfusion for 2 h. After reperfusion, the myocardial histopathological changes were observed by HE staining; RP-HPLC method was used to determine the contents of ATP, ADP, AMP and NAD+ in cardiac tissue. mRNA expressions of AMPK, SIRT1 and PGC-1α were detected by quantitative real-time PCR assay. Western blotting assay was used to detect the phosphorylation level of AMPK protein and the expressions of SIRT1 and PGC-1α protein in myocardium. RESULTS: Compared with sham operation group, model group showed myocardial fibers arranged disorder and horizontal stripes disappearance, cell swelling burst and necrosis, and nuclei deformation displacement; the contents of ATP and NAD+, mRNA expression of AMPK, SIRT1 and PGC-1α, protein expression of SIRT1 and PGC-1α in cardiac tissue were decreased significantly (P<0.05 or P<0.01); the contents of ADP and AMP, the phosphorylation level of AMPK protein were increased significantly (P<0.01). Compared with model group, myocardial pathological morphology were improved significantly in TFDM group; the contents of ATP and NAD+ in cardiac tissue, mRNA expression of AMPK, SIRT1 and PGC-1α, the phosphorylation level of AMPK protein, the protein expression of SIRT1 and PGC-1α were increased significantly (P<0.05 or P<0.01), while the contents of ADP and AMP were decreased significantly (P<0.01). Compared with TFDM group, improvement effects of Compound C+TFDM group and EX-527+TFDM group on above indexes were reversed? (P<0.05 or P<0.01). CONCLUSIONS: TFDM may play a protective role on myocardium by activating AMPK/SIRT1/PGC-1α signaling pathway and regulating energy metabolism.
KEYWORDS? ?Dracocephalum moldavica total flavonoids; Energy metabolism; AMPK; SIRT1; PGC-1α; Mechanism
心肌缺血再灌注損傷(Myocardial ischemia-reperfusion injury,MIRI)是心腦血管疾病患者的主要死亡原因之一,會嚴重影響缺血性心臟疾病患者的預后;而且,MIRI的發病機制復雜,包括能量代謝障礙、自由基損傷、鈣超載和細胞凋亡等[1],而能量代謝又被認為是心肌細胞活動的物質基礎[2]。腺苷酸活化蛋白激酶(AMPK)是調節能量代謝的核心分子,參與了多種代謝過程的調節[3]。沉默信息調節因子1(SIRT1)是一種具有組蛋白脫乙酰化酶活性的轉錄調節因子,可感受機體的能量狀態,調節其他轉錄因子的表達,也參與了調節細胞代謝穩態和氧化應激損傷的過程[4]。過氧化物酶體增殖物激活受體γ輔激活因子1α(PGC-1α)是AMPK和SIRT1的下游靶蛋白,是線粒體生物合成、氧化代謝及細胞能量穩態的關鍵調節分子[5-6]。
香青蘭總黃酮(Dracocephalum moldavica L. total flavonoids,簡稱“TFDM”)是從新疆特色資源香青蘭植物中提取得到的一類天然黃酮類活性成分,具有抗氧化及防治心腦血管疾病等作用[7-9]。本課題組前期研究發現,TFDM對MIRI模型大鼠有明顯的保護作用[7],可提高其心肌組織中腺苷三磷酸(ATP)的含量[8],增強其線粒體活力以及改善其能量代謝紊亂、線粒體結構和功能[9]。而AMPK/SIRT1/PGC-1α作為一條能量感應網絡,可以通過感應機體能量及氧化應激狀態從而在能量代謝中發揮重要作用[10-11]。因此,本研究通過考察TFDM對MIRI模型大鼠AMPK/SIRT1/PGC-1α信號通路的影響,探討TFDM治療MIRI的作用機制,為TFDM防治MIRI提供潛在的治療靶點及理論依據。
1 材料
1.1 主要儀器
本研究所用主要儀器有:HX-300型動物呼吸機(成都泰盟科技有限公司),Pico-17型臺式低溫離心機(美國Thermo Fisher Scientific公司),e2695型高效液相色譜(HPLC)儀、Alliance 2695型二極管陣列檢測器(美國Waters公司),XL-200型低速離心儀器(江蘇海門其林貝爾儀器廠),EM-UC6型超薄型切片儀(美國Leica公司),VE-180型垂直電泳及電轉儀(上海天能科技有限公司),ChemiDoc XRS+型凝膠成像系統(美國Bio Rad公司),Rotor-Gene Q型實時熒光定量-聚合酶鏈式反應(PCR)儀(德國Qiangen公司)。
1.2 主要藥品與試劑
本研究所用主要藥品與試劑有:TFDM提取物(批號20141008,純度57%,其中田薊苷的含量為82.53 mg/g)由新疆藥物研究所提供;Compound C(AMPK抑制劑,批號S7840,純度≥99%)、EX-527(SIRT1抑制劑,批號S1541,純度≥99%)均購自美國Selleck公司;烏拉坦(批號20151106,純度95%)購自武漢遠城科技發展有限公司;ATP二鈉鹽對照品(批號SLBT6850,純度≥99%)、腺苷二磷酸(ADP)二鈉鹽對照品(批號SLBM5638V,純度≥95%)、腺苷一磷酸(AMP)鈉鹽對照品(批號BCBT3249,純度≥99%)、煙酰胺腺嘌呤二核苷酸(NAD+)對照品(批號SLBT3662,純度≥96.5%)均購自美國Sigma公司;兔源AMPK多克隆抗體(批號ab131512)、兔源磷酸化AMPK(p-AMPK)多克隆抗體(批號ab23875)、鼠源SIRT1單克隆抗體(批號ab110304)、兔源PGC-1α多克隆抗體(批號ab191838)均購自美國Abcam公司;兔源甘油醛-3-磷酸脫氫酶(GAPDH)多克隆抗體(批號10494-1-AP)購自武漢三鷹生物技術有限公司;辣根酶素標記山羊抗小鼠免疫球蛋白G(IgG)二抗(批號141987)、辣根酶素標記山羊抗兔IgG二抗(批號140193)購自北京中杉金橋生物技術有限公司;二喹啉甲酸(BCA)蛋白定量測試盒(批號A045-4)購自南京建成生物工程研究所;聚偏二氟乙烯(PVDF)膜(批號R8PA2084)、ECL發光液(批號1923101)均購自美國Millopore公司;cDNA逆轉錄試劑盒(批號00422714)購自美國Thermo Fisher Scientific公司;組織總RNA抽提試劑盒(批號DP431)、QuantiNovaTM SYBR? Green PCR Kit熒光定量PCR試劑盒(批號154045739)均購自德國Qiangen公司;PCR試驗中的引物序列均由上海生工生物公司設計及合成;其余試劑均為分析純或實驗室常用規格,水為蒸餾水。
1.3 動物
SPF級健康SD大鼠50只,雄性,體質量230~280 g,由新疆維吾爾自治區實驗動物研究中心提供[動物使用合格證號為SYXK(新)2016-0001]。所有大鼠均自由攝食、飲水,并分籠飼養于溫度為22~25 ℃、相對濕度為40%~60%的環境中,適應性飼養1周后用于實驗。本研究實驗過程滿足動物實驗“3R”原則。
2 方法
2.1 分組與給藥
將50只SD大鼠隨機分為假手術組、模型組、TFDM組、Compound C+TFDM組和EX-527+TFDM組,每組10只。假手術組和模型組大鼠灌胃等體積生理鹽水;TFDM組大鼠灌胃60 mg/(kg·d)TFDM(以提取物計,下同)[8,12];Compound C+TFDM組大鼠灌胃TFDM 60 mg/(kg·d),并于再灌注前15 min尾靜脈注射250 μg/kg Compound C[13];EX-527+TFDM組大鼠灌胃TFDM 60 mg/(kg·d),并于再灌注前20 min腹腔注射5 mg/kg EX-527[14]。藥物均使用生理鹽水溶解,灌胃體積均為2.5 mL/kg,每天灌胃給藥1次,連續7 d。給藥結束后,除假手術組外的其余4組大鼠均建立MIRI模型。
2.2 大鼠MIRI模型的建立及取材
腹腔注射25%烏拉坦(5 mL/kg)將大鼠麻醉后,將其仰位固定,進行氣管插管;沿胸骨左緣3~4肋間開胸后,立刻連接呼吸機(呼吸頻率60次/min,潮氣量60? mL/kg,呼吸比3 ∶ 2),暴露心臟,迅速結扎左冠狀動脈前降支,結扎完成后立刻讓心臟回位;缺血30 min后,剪斷結扎線,再灌注120 min[9]。再灌注結束后,迅速剪取心臟,置于冰生理鹽水中,輕柔洗去心腔內血液,將整顆心臟置于-80 ℃冰箱中凍存,待測。假手術組大鼠進行同樣實驗操作,但不結扎左冠狀動脈前降支。
2.3 大鼠心肌組織病理學形態觀察
采用蘇木精-伊紅(HE)染色法觀察大鼠心肌組織病理學形態變化。取大鼠心臟心尖及左心室壁進行常規石蠟包埋、切片(厚度為5 μm)。將組織切片經二甲苯及梯度乙醇脫蠟后,以蘇木精染色3 min,再以1%鹽酸乙醇分化30 s,然后以0.5%伊紅染色3 min,接著依次經梯度乙醇和二甲苯進行脫水透明,于通風櫥中晾干后,用中性樹膠封片,顯微鏡下拍照并觀察大鼠心肌組織的病理學形態變化。
2.4 大鼠心肌組織中ATP、ADP、AMP和NAD+含量測定
按照前期建立的反相HPLC法測定大鼠心肌組織中ATP、ADP、AMP、NAD+的含量[15]。取大鼠心肌組織適量,迅速稱質量,冰浴下按3 mL/kg的量分次加入預冷的0.5 mol/L HClO4溶液,低溫下制備組織勻漿,再于冰上靜置5 min,使蛋白充分沉淀。然后將組織勻漿液在4 ℃下以12 000 r/min離心5 min,取上清,再用2.5 mol/L K2CO3溶液調節組織上清液的pH至中性,再次在4 ℃下以12 000 r/min離心5 min,以0.22 ?m微孔濾膜過濾,取濾液,然后按文獻[15]色譜條件進樣分析。
2.5 大鼠心肌組織中AMPK、SIRT1和PGC-1α mRNA表達水平測定
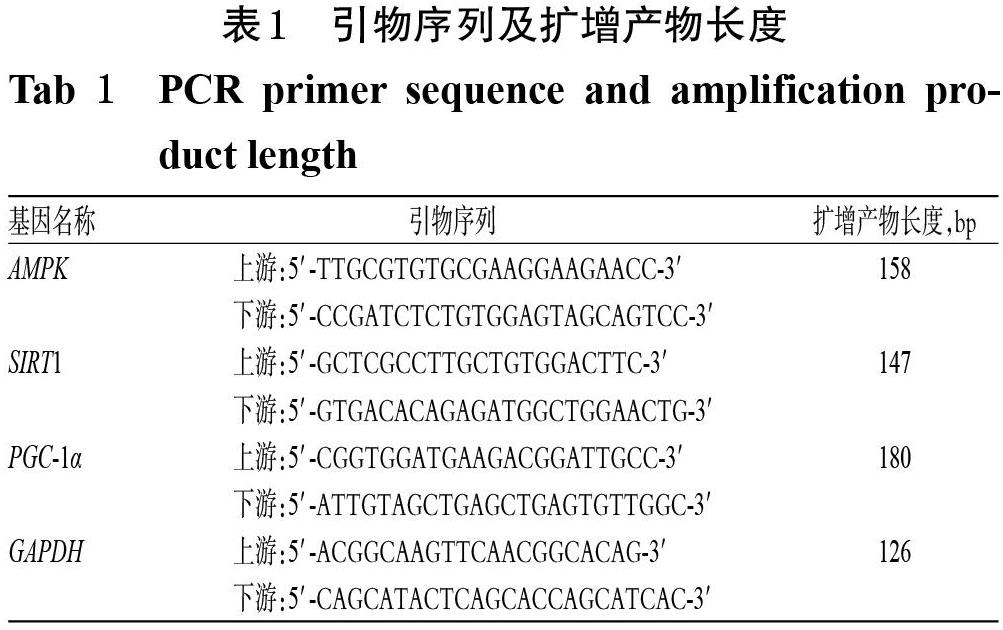
采用實時熒光定量-PCR法測定大鼠心肌組織中AMPK、SIRT1和PGC-1α mRNA表達水平。取大鼠心肌組織適量,使用組織總RNA抽提試劑盒提取其總RNA,驗證其純度后,按cDNA逆轉錄試劑盒方法合成cDNA,并以cDNA為模板進行PCR擴增。反應體系(共20 μL)包括2×QuantiNova SYBR Green PCR Master mix 10 μL,上、下游引物各1 μL,cDNA模板 2 μL,ddH2O 6? ? μL。PCR反應條件為95 ℃預變性 1 min;95 ℃ 變性10 s,60 ℃退火/延伸15 s,共40個循環。以GAPDH為內參,采用2-ΔΔCt法計算各目的基因的表達水平。引物序列及擴增產物長度見表1。
2.6 大鼠心肌組織中AMPK蛋白磷酸化水平及SITR1和PGC-1α 蛋白表達水平檢測
采用Western blotting法檢測大鼠心肌組織中AMPK蛋白的磷酸化水平及SITR1、PGC-1α蛋白表達水平。取大鼠心肌組織80 mg,用含有蛋白酶抑制劑和磷酸酶抑制劑的RIPA裂解液提取其總蛋白,采用BCA法測定蛋白濃度。蛋白經變性處理(99 ℃,10 min)后,取50 μg在80 V電壓下經10%十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)電泳分離90 min,濕法轉膜(200 mA,120 min)至PVDF膜上;將膜用5%脫脂奶粉封閉1 h,然后分別加入AMPK一抗(稀釋比例為1 ∶ 500)、p-AMPK一抗(稀釋比例為1:1 000)、SIRT1一抗(稀釋比例為1 ∶ 1 000)、PGC-1α一抗(稀釋比例為1 ∶ 1 000)、GAPDH一抗(稀釋比例為1 ∶ 5 000),4 °C孵育過夜;以TBST緩沖液洗膜10 min×3次,然后加入相應二抗(稀釋比例均為1 ∶ 20 000),室溫孵育1 h;以TBST緩沖液洗膜10 min×3次,采用ECL化學發光液顯影后,經凝膠成像系統成像。采用Image J 1.6.0軟件對蛋白條帶進行灰度值分析,以p-AMPK與AMPK條帶灰度值的比值表示AMPK蛋白的磷酸化水平,以其余目標蛋白與內參GAPDH條帶的灰度值比值表示目標蛋白的相對表達水平。
2.7 統計學方法
采用SPSS 22.0軟件進行統計分析。數據結果以x±s表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD檢驗。P<0.05表示差異具有統計學意義。
3 結果
3.1 TFDM對MIRI模型大鼠心肌組織病理學形態的影響
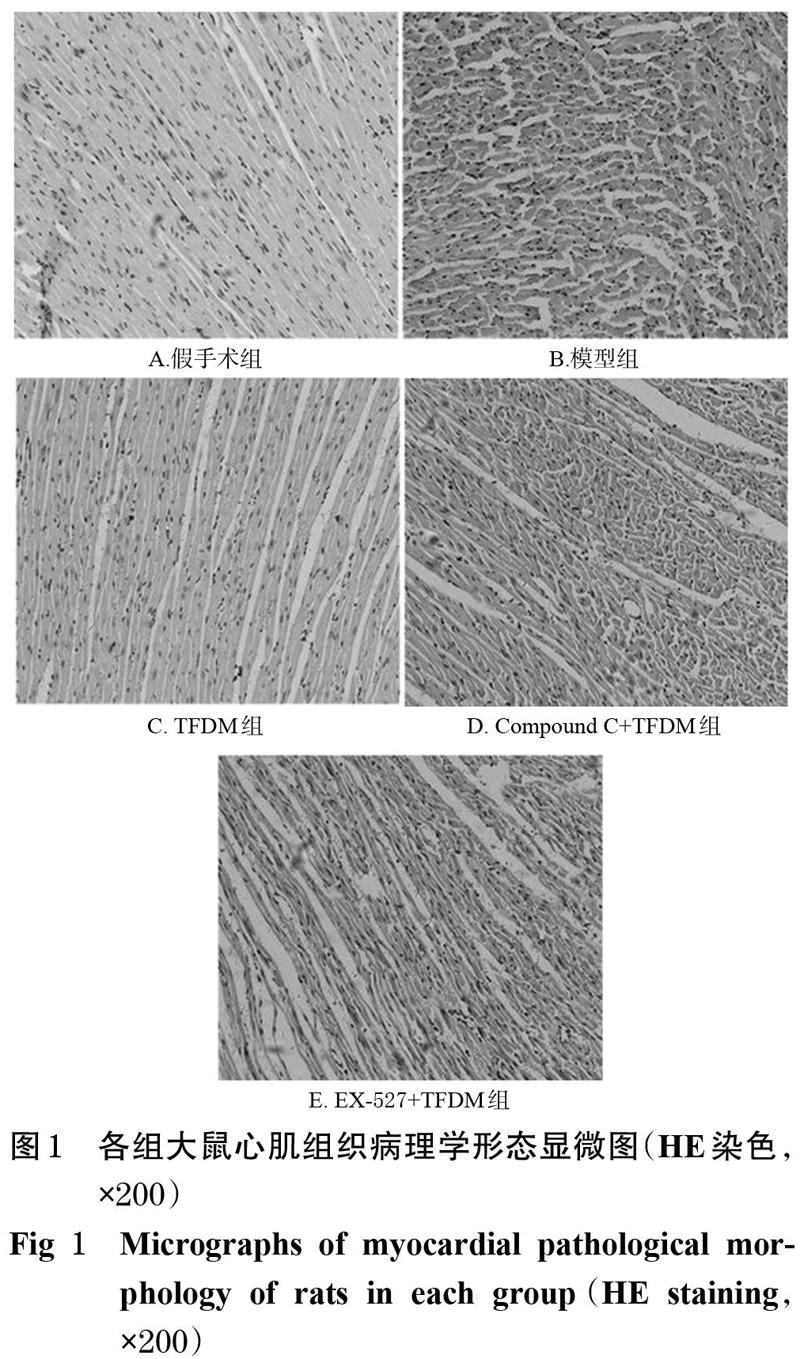
HE染色結果顯示,假手術組大鼠心肌膜完整,心肌纖維排列整齊、界限清晰、呈束狀分布,細胞核形態規則、分布均勻;模型組大鼠心肌纖維排列紊亂、橫向條紋消失,細胞腫脹破裂、壞死,細胞核變形移位;TFDM組大鼠心肌纖維排列相對整齊、界限較清晰、呈束狀分布;而Compound C+TFDM組和EX-527+TFDM組大鼠心肌組織心肌膜不完整,心肌纖維排列不緊密。各組大鼠心肌組織病理學形態顯微圖見圖1。
3.2 TFDM對MIRI模型大鼠心肌組織中ATP、ADP、AMP和NAD+含量的影響
與假手術組比較,模型組大鼠心肌組織中ATP、NAD+含量顯著降低(P<0.01),而ADP、AMP含量顯著升高(P<0.01);與模型組比較,TFDM組大鼠心肌組織中ATP、NAD+含量顯著升高(P<0.01),ADP、AMP含量顯著降低(P<0.01);與TFDM組比較,Compound C+TFDM組和EX-527+TFDM組大鼠心肌組織中的ATP、NAD+含量均顯著降低(P<0.01),ADP、AMP含量均顯著升高(P<0.05或P<0.01)。各組大鼠心肌組織中ATP、ADP、AMP和NAD+含量測定結果見表2。
3.3 TFDM對MIRI模型大鼠心肌組織中AMPK、SIRT1和PGC-1α mRNA表達的影響
與假手術組比較,模型組大鼠心肌組織中AMPK、SIRT1和PGC-1α mRNA的表達水平均顯著降低(P<0.05或P<0.01);與模型組比較,TFDM組大鼠心肌組織中AMPK、SIRT1和PGC-1α mRNA的表達水平均顯著升高(P<0.05或P<0.01);與TFDM組比較,Compound C+TFDM組和EX-527+TFDM組大鼠心肌組織中AMPK、SIRT1和PGC-1 α mRNA的表達水平均顯著降低(P<0.01)。各組大鼠心肌組織中AMPK、SIRT1、PGC-1α mRNA的表達水平測定結果見表3。
3.4 TFDM對MIRI模型大鼠心肌組織中AMPK蛋白磷酸化及SIRT1、PGC-1α 蛋白表達的影響
與假手術組比較,模型組大鼠心肌組織中AMPK蛋白的磷酸化水平顯著升高(P<0.01),SIRT1、PGC-1α蛋白表達水平均顯著降低(P<0.05或P<0.01);與模型組比較,TFDM組大鼠心肌組織中AMPK蛋白的磷酸化水平和SIRT1、PGC-1α蛋白表達水平均顯著升高(P<0.01);與TFDM組比較,Compound C+TFDM組和EX-527+TFDM組大鼠心肌組織中AMPK蛋白的磷酸化水平和SIRT1、PGC-1α 蛋白表達水平均顯著降低(P<0.05或P<0.01)。各組大鼠心肌組織中p-AMPK、AMPK、SIRT1、PGC-1α蛋白表達的電泳圖見圖2,AMPK蛋白磷酸化水平及SIRT1、PGC-1α蛋白表達水平測定結果見表4。
4 討論
AMPK屬于絲氨酸/蘇氨酸蛋白激酶,是一種調節生物能量代謝的核心分子,可參與多種代謝的調節過程[3,16]。相關研究顯示,心肌缺血再灌注后大鼠心肌組織明顯受損,細胞處于缺血缺氧的應激狀態,氧供缺乏,導致體內ATP生成不足、AMP含量增加,從而使AMPK被磷酸化激活[17]。活化的AMPK(即p-AMPK)可作用于多種下游底物,抑制ATP的消耗,并啟動生成ATP的途徑以維持機體能量代謝平衡,增加細胞內NAD+的含量,繼而使依賴NAD+的SIRT1被激活而發揮其相應生物學效應[18]。AMPK和SIRT1分別可以通過磷酸化和去乙酰化作用調控PGC-1α的表達;而PGC-1α可調節抗氧化酶的活性,減少MDA+及活性氧(ROS)的含量,發揮抗氧化應激作用,從而保護心肌缺血性損傷[19-21]。
本研究結果顯示,模型組大鼠心肌組織明顯受損,病理形態學方面主要表現為心肌纖維排列紊亂、橫向條紋消失,細胞腫脹破裂、壞死,細胞核變形移位,表明MIRI模型造模成功;而TFDM組大鼠心肌組織的上述癥狀明顯改善,且TFDM能明顯提高大鼠心肌組織中ATP、NAD+的含量,降低ADP、AMP的含量,表明TFDM可通過改善缺血心肌細胞ATP的能量代謝,從而保護受損心肌。在心肌缺血缺氧時,AMPK作為“細胞能量感應器”,可被迅速磷酸化從而發揮其調節作用[18]。本研究發現,模型組大鼠心肌組織中AMPK mRNA的表達水平顯著降低、AMPK蛋白的磷酸化水平顯著升高,這可能是機體代償性地產生了p-AMPK,以維持能量穩定、減少損傷;此外,SIRT1、PGC-1α mRNA及其蛋白的表達水平均顯著下降,表明SIRT1、PGC-1α參與了MIRI模型大鼠心肌損傷的過程。而與模型組比較,TFDM組大鼠心肌組織中AMPK mRNA表達水平、AMPK蛋白的磷酸化水平進一步升高,同時SIRT1、PGC-1α mRNA及其蛋白表達水平也均顯著升高,這說明TFDM可激活AMPK通路,并上調SIRT1、PGC-1α mRNA及其蛋白的表達。
另外,本研究進一步發現,給予抑制劑Compound C和EX-527后,可顯著逆轉TFDM對上述指標的調節作用。Compound C是AMPK的抑制劑,有學者在前期動物實驗和細胞試驗中已驗證過其安全性和有效性,有一定研究基礎[15];EX-527是SIRT1的抑制劑,其不影響細胞生長、細胞活力和p53調控的基因的表達,對SIRT1具有較高的選擇性[20]。本研究采用這2個通路抑制劑分別進行處理,首先能夠更加明確、直觀地反映TFDM對AMPK/SIRT1/PGC-1α信號轉導通路的影響;其次是預測AMPK和SIRT1在對PGC-1α活性的調節中誰占據主導作用。本研究結果提示AMPK/SIRT1/PGC-1α信號通路參與了TFDM給藥后對MIRI模型大鼠的保護作用,但AMPK和SIRT1在此作用機制中誰占主導位置尚未得到明確結論。
綜上所述,TFDM在MIRI過程中可以激活AMPK/SIRT1/PGC-1α信號通路,調節能量代謝,從而發揮其對心肌組織的保護作用。
參考文獻
[ 1 ] LI L,PAN CS,YAN L,et al. Ginsenoside Rg1 ameliorates rat myocardial ischemia-reperfusion injury by modulating energy metabolism pathways[J]. Front Physiol,2018. DOI:10.3389/fphys.2018.00078.
[ 2 ] WANG S,YE L,WANG L. Protective mechanism of Shen- mai on myocardial ischemia-reperfusion through the energy metabolism pathway[J]. Am J Transl Res,2019,11(7):4046-4062.
[ 3 ] QI D,YONG LH. AMPK:energy sensor and survival me- chanism in the ischemic heart[J]. Trends Endocrinol Metab,2015,26(8):422-429.
[ 4 ] MA S,FENG J,ZHANG R,et al. SIRT1 activation by resveratrol alleviates cardiac dysfunction via mitochondrial regulation in diabetic cardiomyopathy mice[J]. Oxid Med Cell Longev,2017. DOI:10.1155/2017/4602715.
[ 5 ] LIMING Y,BING G,WEIXUN D,et al. Melatonin ameliorates myocardial ischemia/reperfusion injury in type 1 diabetic rats by preserving mitochondrial function:role of AMPK-PGC-1α-SIRT3 signaling[J]. Sci Rep,2017. DOI:10.1038/srep41337.
[ 6 ] NAAZ S,MISHRA S,PAL PK,et al. Activation of SIRT1/PGC1α/SIRT3 pathway by melatonin provides protection against mitochondrial dysfunction in isoproterenol induced myocardial injury[J]. Heliyon,2020. DOI:10.1016/j.heliyon.2020.e05159.
[ 7 ] 樊鑫梅,曹文疆,邢建國,等.香青蘭總黃酮對大鼠心肌缺血再灌注損傷保護作用的研究[J].中成藥,2013,35(8):1625-1629.
[ 8 ] 姚佳茗,曹文疆,袁勇,等.香青蘭總黃酮對心肌缺血-再灌注損傷線粒體保護作用的研究[J].石河子大學學報(自然科學版),2015,33(5):599-603.
[ 9 ] YUAN Y,CAO W,HONG Y,et al. Tilianin pretreatment prevents myocardial ischemia-reperfusion injury via pre- servation of mitochondrial function in rat heart[J]. Phytomedicine,2017. DOI:10.1016/j.phymed.2017.08.007.
[10] CHOI YK,KIM JH,LEE DK,et al. Carbon monoxide potentiation of L-type Ca(2+)channel activity increases HIF-1α-independent VEGF expression via an AMPKα/SIRT1-mediated PGC-1α/ERRα axis[J]. Antioxid Redox Signal,2017,27(1):21-36.
[11] YUAN Y,SHI M,LI L,et al. Mesenchymal stem cell-conditioned media ameliorate diabetic endothelial dysfunction by improving mitochondrial bioenergetics via the Sirt1/AMPK/PGC-1alpha pathway[J]. Clin Sci(Lond),2016,130(23):2181-2198.
[12] 袁勇,邢建國,王立萍,等.香青蘭總黃酮在大鼠體內的藥代動力學研究[J].石河子大學學報(自然科學版),2014,32(1):69-72.
[13] 徐青榮.硫化氫緩釋供體ADT后處理對大鼠在體心肌缺血再灌注損傷的保護:AMPK介導的自噬流在其中的作用[D].蘇州:蘇州大學,2015.
[14] 付雯雯.基于SIRT1信號通路的人參皂苷Rb2和Rg2預處理對心肌損傷的保護作用及機制研究[D].長春:吉林大學,2017.
[15] TIAN L,CAO W,YUE R,et al. Pretreatment with tilianin improves mitochondrial energy metabolism and oxidative stress in rats with myocardial ischemia/reperfusion injury via AMPK/SIRT1/PGC-1α signaling pathway[J]. J Pharmacol Sci,2019. DOI:10.1016/j.jphs.2019.02.008.
[16] VELAGAPUDI R,EL-BAKOUSH A,LEPIARZ I,et al. AMPK and SIRT1 activation contribute to inhibition of neuroinflammation by thymoquinone in BV2 microglia
[J]. Mol Cell Biochem,2017,435(1/2):149-162.
[17] SALT IP,HARDIE DG. AMP-activated protein kinase:an ubiquitous signaling pathway with key roles in the cardiovascular system[J]. Circ Res,2017,120(11):1825-1841.
[18] CATTELAN A,CEOLOTTO G,BOVA S,et al. NAD(+)-dependent SIRT1 deactivation has a key role on ischemia-reperfusion-induced apoptosis[J]. Vascul Pharmacol,2015. DOI:10.1016/j.vph.2015.02.004.
[19] YU L,LIANG H,DONG X,et al. Reduced silent information regulator 1 signaling exacerbates myocardial ische- mia-reperfusion injury in type 2 diabetic rats and the? ? protective effect of melatonin[J]. J Pineal Res,2015,59(3):376-390.
[20] SOLOMON JM,PASUPULETI R,XU L,et al. Inhibition of SIRT1 catalytic activity increases p53 acetylation but does not alter cell survival following DNA damage[J]. Mol Cell Biol,2006,26(1):28-38.
[21] SONG MY,JUNG HW,KANG SY,et al. Atractylenolide Ⅲ enhances energy metabolism by increasing the SIRT-1 and PGC1α expression with AMPK phosphorylation in C2C12 mouse skeletal muscle cells[J]. Biol Pharm Bull,2017,40(3):339-344.
(收稿日期:2020-11-03 修回日期:2020-12-22)
(編輯:林 靜)

