LC-MS/MS法同時檢測人血漿中氟尿嘧啶、尿嘧啶和二氫尿嘧啶的濃度及其臨床應用
范先煜,汪碩聞,范國榮
(上海交通大學附屬第一人民醫院臨床藥學科,上海 200080)
氟尿嘧啶(5-FU)是一種廣譜、細胞毒性抗腫瘤藥,常單獨或與其他化療藥物聯合使用,是治療頭頸部癌、胰腺癌、胃癌及結直腸癌的重要藥物。5-FU的治療窗窄,體內濃度個體間差異大,因此5-FU的臨床療效和藥品不良反應(ADRs)在不同患者間也具有很大差異。研究發現,基于體表面積給藥的多數患者都沒有達到最佳的藥物暴露。許多研究已指出,根據5-FU的藥動學性質調整劑量可通過降低毒性和提高療效顯著改善臨床結局[1-2]。
體內約80%的5-FU通過二氫嘧啶脫氫酶(DPD)快速代謝成無活性的代謝產物,DPD的活性存在個體差異,活性下降可導致5-FU的清除受阻[2]。由于DPD也是體內尿嘧啶(U)代謝為二氫尿嘧啶(UH2)的關鍵酶,酶活性缺失會導致轉化的減少,因此可通過化療前測定血漿中UH2與U血藥濃度比值(UH2/U),間接反映DPD活性大小,用于預測患者給藥后可能發生的毒性反應[3]。相比用藥物遺傳學方法篩查基因多態性,測定UH2/U具有更高的靈敏度[4],且節省檢測時間和成本[5],能夠可靠地反映酶活性的缺失。
為了盡可能降低毒副反應的發生,臨床上可通過UH2/U預測5-FU首輪治療的劑量,再根據5-FU的血藥濃度調整后續劑量。因此,建立一種同時檢測血漿中5-FU、U和UH2濃度的分析方法,對5-FU用藥方案的優化有重要意義。國內的報道多采用HPLC法測定5-FU[6]或UH2和U[7],但由于這類化合物極性大,血漿中其他內源性物質易對分析造成干擾,且有定量下限較高、分析時間較長等缺點。目前國內尚無基于LC-MS/MS法同時測定人血漿中5-FU、U和UH2濃度的報道。本研究建立了LC-MS/MS法同時測定人血漿中這3種物質,并應用于消化道腫瘤患者的治療藥物監測,現報道如下。
1 材 料
1.1 儀器 LC-20A液相色譜儀、8040三重四級桿串聯質譜儀(日本島津公司);MS-X可調式渦旋振蕩儀(美國賽洛捷克公司);Sorvall Legend Micro 21R微量離心機[賽默飛世爾科技(中國)有限公司];CPA225D十萬分之一電子分析天平(德國賽多利斯公司);VapAuto S60 多樣品自動濃縮儀(美國ATR公司)。
1.2 試藥 5-FU對照品(純度>99%,批號M0701AS)、U對照品(純度>99%,批號J0803AS)、UH2對照品(純度>97%,批號D0104A)、溴尿嘧啶(BU)對照品(純度>98%,批號F0129AO)均購于大連美侖生物技術有限公司;甲醇(色譜純)、異丙醇(分析純,德國Merck公司);甲酸、乙酸乙酯(分析純,上海安譜實驗科技有限公司);二氯甲烷(分析純,上海凌峰化學試劑有限公司)。實驗所用去離子水由Research UV超純水機(上海和泰儀器有限公司)制得。
2 方法和結果
2.1 色譜條件 Waters Atlantis T3色譜柱(100 mm×3.0 mm,3 μm),流動相為:0.1%甲酸水溶液(V/V,A相)-甲醇(B相),洗脫梯度(0~2.0 min,5%B;2.0~2.1 min,5%~40%B;2.1~5.0 min,40%B;5.0~5.1 min,40%~5%B;5.1~7.0 min,5%B),流速0.35 ml/min,柱溫35 ℃,進樣量10 μl。
2.2 質譜條件 使用電噴霧離子源,以多反應監測模式(MRM)進行分析,并以正離子模式檢測UH2和U,用負離子模式檢測5-FU和內標BU。表1和圖1分別為化合物的離子對和質譜特征性參數及二級質譜圖。
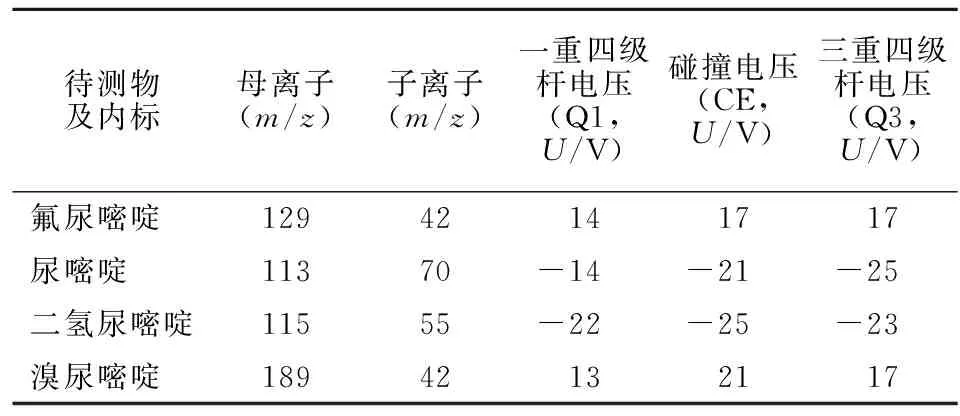
表1 各待測物及內標的離子對和質譜特征性參數Table 1 The characteristic parameters of ion pair and mass spectrum of each analyte and internal standard

圖1 氟尿嘧啶、二氫尿嘧啶、尿嘧啶和內標溴尿嘧啶的二級質譜圖Figure 1 Secondary mass spectrum chromatograms of fluorouracil,dihydrouracil,uracil and internal standard bromouracilA:氟尿嘧啶;B:二氫尿嘧啶;C:尿嘧啶;D:溴尿嘧啶
2.3 溶液配制 分別精密稱取5-FU、UH2、U、BU對照品10.00 mg,置于10 ml容量瓶中,用50%甲醇溶液溶解并定容,得到濃度為1.0 mg/ml的對照品儲備液。其中,5-FU、UH2和U的對照品稱取兩份,分別配制標準曲線和用于質控的對照品儲備液與工作溶液。對照品儲備液用50%甲醇逐級稀釋得系列工作溶液:5-FU和UH2的標準曲線工作液濃度分別為100、200、500、1000、2500、5000、10 000 ng/ml,U的標準曲線工作液濃度分別為50、100、250、500、1250、2500、5000 ng/ml。5-FU和UH2定量下限,低、中、高濃度的質控工作液濃度分別為100、250、2000和8000 ng/ml,U為50、125、1000和4000 ng/ml。內標BU工作液的濃度為3.3 μg/ml。對照品儲備液和工作溶液均置于-20 ℃保存待用。
2.4 血樣前處理 采用液-液萃取的方法對血漿樣品進行前處理。于200 μl血漿樣品中加入10 μl BU內標溶液(3.3 μg/ml),渦旋30 s后,再加入1 ml乙酸乙酯-異丙醇(85∶15,V/V)作為萃取劑,充分渦旋5 min,以1.62×104×g離心10 min(4 ℃)后,取900 μl上層有機溶液轉移入新離心管中,并于35 ℃的溫和氮氣流下吹干濃縮。獲得的干燥殘渣用50 μl 5%(V/V)的甲醇-水溶液和10 μl二氯甲烷復溶,以1.62×104×g離心10 min(4 ℃),將40 μl上清液轉移入進樣小瓶中用于分析。
2.5 樣品采集 分別于化療前和5-FU靜脈滴注后22 h采集患者全血5 ml,收集于乙二胺四乙酸(EDTA)抗凝的采血管中,立即分離血漿。對患者的血藥濃度監測經上海交通大學附屬第一人民醫院倫理委員會審批通過。
2.6 方法學驗證 根據2015版《中華人民共和國藥典》四部“生物樣品定量分析方法驗證指導原則”[8],對本研究建立的分析方法進行方法學驗證。
2.6.1 方法專屬性 選取6批不同來源的空白血漿與定量下限樣品比較以評價方法的專屬性,典型圖譜見圖2,5-FU及內標BU均無內源性干擾。對內源性物質U和UH2專屬性的評估通過配制75 mg/ml牛血清白蛋白溶液作為替代基質以反映定量下限(LLOQ)樣品實際的響應[9]。5-FU、UH2、U和BU在血漿中的保留時間分別為2.70、2.27、2.40和4.90 min,均分離良好。
2.6.2 標準曲線和定量下限 取2.3項下標準曲線工作液與內標溶液,加入空白血漿中,進樣分析。使用峰面積比(分析物/內標,y)相對于濃度(x)作最小二乘法回歸分析得到線性方程,并以1/x2作為權重因子,得到5-FU的標準曲線方程為y1=0.003 430x1-0.001 090(r=0.999);UH2的標準曲線方程為y2=0.009 761x2+0.000 200 1(r=0.997);U的標準曲線方程為y3=0.033 83x3-0.013 77(r=0.999),表明5-FU和UH2在10~1000 ng/ml,U在5~500 ng/ml濃度范圍內線性良好。在計算UH2和U的標準曲線方程時,以空白血漿中UH2或U與內標BU的峰面積比作為本底值,將標準曲線各點的UH2或U與內標的峰面積比減去本底值,從而得到濃度與實際峰面積的對應關系[9]。
圖2 氟尿嘧啶、二氫尿嘧啶、尿嘧啶及內標溴尿嘧啶的LC-MS/MS譜圖Figure 2 LC-MS/MS chromatograms of fluorouracil,dihydrouracil,uracil and internal standard bromouracilA:健康志愿者空白血漿;B:腫瘤患者空白血漿;C:定量下限樣品;D:腫瘤患者實測血樣
2.6.3 準確度和精密度 通過將3批質控樣品與隨行標準曲線進行比較,考察日內和日間精密度和準確度,其中準確度用回代標準曲線后計算得到的理論濃度與實際濃度間的相對誤差(RE)表示,精密度用RSD表示。結果見表2,RE均在88.32%~111.93%,RSD均<8.00%(n=5),表明本方法準確度和精密度均符合要求。

表2 LC-MS/MS法測定人血漿中氟尿嘧啶、尿嘧啶和二氫尿嘧啶的精密度和準確度Table 2 Accuracy and precision of fluorouracil,uracil and dihydrouracil in human plasma (n=5)
2.6.4 穩定性 考察血漿樣品室溫放置2 h、凍融循環3次(-40 ℃)、于-80 ℃放置30 d和于自動進樣盤放置24 h(室溫)的穩定性。將放置后的低、中、高3個濃度(UH2、5-FU濃度分別為25、200、800 ng/ml,U濃度分別為12.5、100、400 ng/ml)的質控樣品進樣分析,并與新鮮配制的標準曲線工作液算得的線性方程進行比較,結果在上述條件下RE均<108.7%(n=5),表明人血漿中的5-FU、UH2和U穩定性良好。
2.6.5 提取回收率和基質效應 將按2.4項下方法提取的低、中、高三個濃度的樣品與對應濃度的純溶液比較,計算提取回收率,結果UH2和U的回收率相對較低,分別為48.10%和60.06%,但在較低的回收率下仍可達到定量下限,并且不降低分析方法的可靠性。BU的回收率>120%,原因可能是基質增強的影響。
在經液-液萃取的空白基質(不同來源的6批樣品)中標準添加純溶液,使濃度與低、高濃度質控樣品相同,并與相應濃度純溶液比較,計算基質效應(MF)。結果5-FU、UH2和U的MF均在100.03%~106.87%,且RSD均≤8.58%(n=3),提示血漿對各化合物沒有明顯的基質效應,且不同批次的基質間無明顯區別。BU的MF為118.88%,顯示微弱的基質增強,可以解釋提取回收率的同步偏大。
2.7 臨床應用 收集本院使用5-FU治療的結直腸癌和胃癌患者共9例,其中男性7例,女性2例,平均年齡65歲。9例患者5-FU的穩態血藥濃度為(402.53±176.33)ng/ml,中位血藥濃度為416.50 ng/ml (174.66~634.95 ng/ml)。化療前患者血漿中U的濃度為(35.03±25.55) ng/ml, UH2的濃度為(211.42±119.64) ng/ml, UH2/U為7.33±3.43。5-FU開始滴注后22 h,U的濃度為(67.41±29.44) ng/ml,UH2的濃度為(300.42±119.64) ng/ml,UH2/U為5.10±2.20。患者的基本信息、用藥劑量及5-FU血藥濃度等見表3和圖3。由圖3可見,5-FU給藥后,U和UH2的血藥濃度均較給藥前上升,其中U的變化具有顯著性差異(P=0.02);UH2/U較給藥前顯著下降(P=0.02),提示U轉化為UH2的過程受5-FU的影響。
3 討 論
3.1 LC-MS/MS法的優化
由于5-FU、UH2、U具有相似的化學結構且極性較大,因此獲得良好的分離度、峰型及色譜柱上的保留是優化分析方法時的難點。選擇可承受高水相條件的色譜柱用于分離,預實驗中比較了Agilent ZORBAX AQ色譜柱和Waters Atlantis T3色譜柱,結果表明后者具有更好的保留性能和峰型。以往文獻常見用負離子模式檢測UH2和U[10],在預實驗過程中則發現,當采用正離子模式電離時,UH2和U的響應相比負離子模式明顯增加;而5-FU和BU則使用負離子模式電離,正負離子通道間快速切換的效率可以保證峰形和響應均不受影響。由于BU為人體內不含有的外源類似物,不會在實測過程中造成干擾,因此選用BU作為內標。

表3 9名患者的基本信息、用藥劑量、氟尿嘧啶血藥濃度及二氫尿嘧啶與尿嘧啶血漿濃度比值Table 3 Basic information,dosage,concentration of fluorouracil and the ratio of plasma concentration of dihydrouracil to uracil in the 9 patients
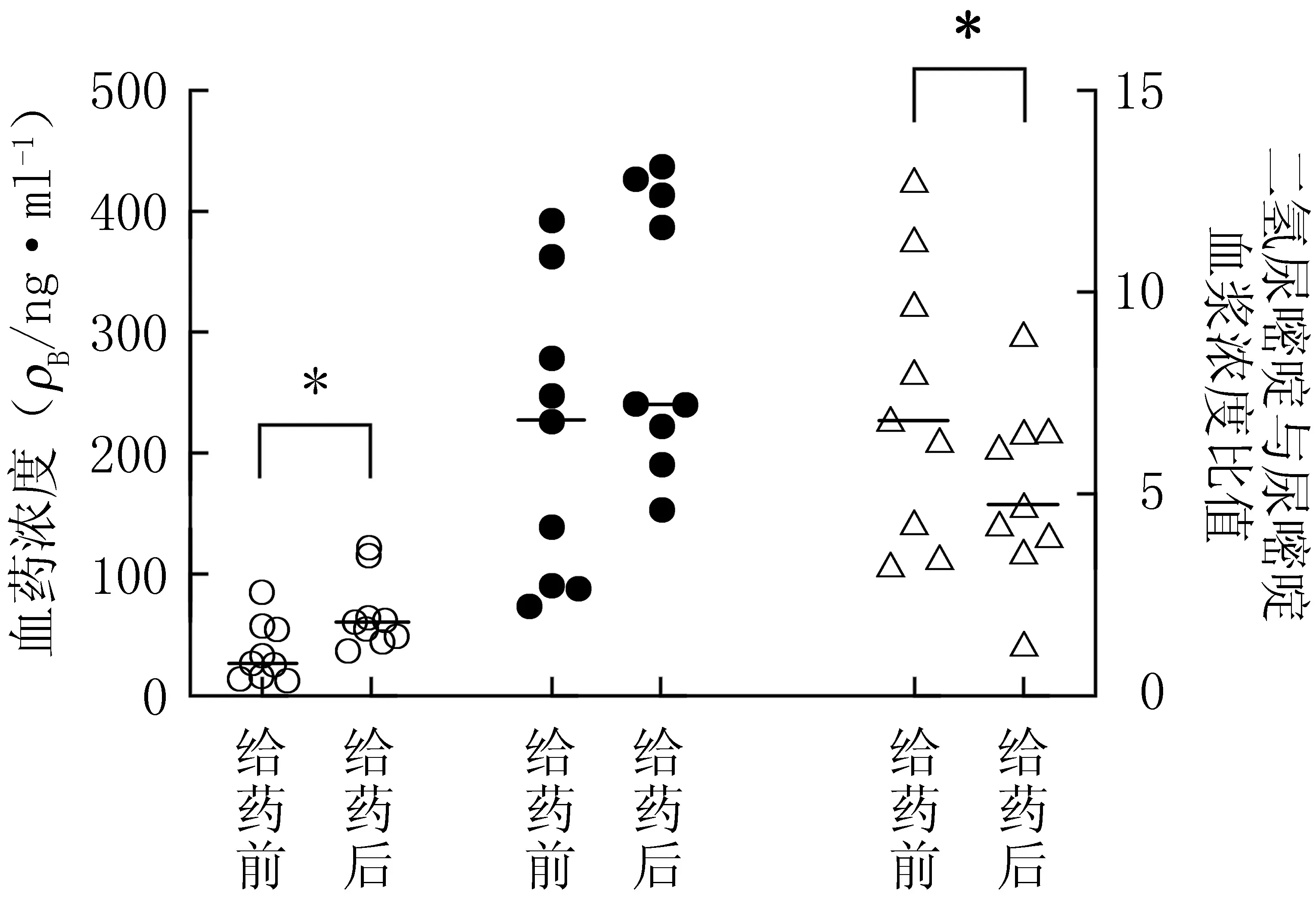
圖3 氟尿嘧啶給藥前后尿嘧啶、二氫尿嘧啶的血漿濃度及二氫尿嘧啶與尿嘧啶血漿濃度比值的變化Figure 3 Changes in plasma concentrations of uracil and dihydrouracil in plasma and the ratio of plasma concentration of dihydrouracil to uracilbefore and after administration of fluorauracil○:尿嘧啶;●:二氫尿嘧啶;△:二氫尿嘧啶與尿嘧啶血漿濃度比值;*P<0.05,給藥前后比較
3.2 血樣前處理方法的優化 在血樣前處理方法的優化中,分別考察了蛋白沉淀、液-液萃取和固相萃取。據文獻中的前處理步驟[11],血漿樣品經甲醇沉淀蛋白,上清吹干后再復溶,但是由于上清中含有一定比例的水,吹干效率較差。由于5-FU相對分子質量小、極性大,在固相載體上難以保留且容易直接被水相洗脫而損失,導致提取回收率低,因此不適合用固相萃取的方法進行前處理。參考文獻報道[10],使用乙酸乙酯-異丙醇(85∶15,V/V)作為液-液萃取劑,可同時提取血漿中的5-FU、UH2和U,操作過程簡便,效率較高,且提取回收率滿足臨床檢測的要求。
3.3 臨床應用 有研究表明,5-FU長時間輸注時,可以用穩態血藥濃度代替血藥濃度曲線下面積(AUC)預測ADRs的發生[12]。5-FU靜脈持續滴注給藥時,2 h左右可達穩態血藥濃度,在22 h后血藥濃度差異較小[2]。因此,本研究取5-FU持續靜脈滴注22 h的血樣檢測5-FU穩態血藥濃度。結果表明,患者間5-FU血藥濃度的差異較大,其原因可能包括藥物代謝酶的基因差異、身體狀況、食物和藥物之間的相互作用等[2]。研究顯示,直接檢測細胞中DPD的活性,其結果與5-FU的血漿水平相關性較弱,且較費時費力[5],因此,化療前測定UH2/U,可作為間接指標幫助判斷DPD活性缺陷,從而預測毒性[13],且UH2/U=4為發生毒性反應的臨界值[3]。在本研究測得的結果中,9例患者間UH2/U差異較大,有2例患者的UH2/U<4,其中1例發生3度腹瀉,可能與5-FU代謝遲緩有關。患者使用5-FU后,UH2/U平均下降約30%,可能是因為5-FU在體內通過DPD代謝為無活性產物,從而產生競爭作用。因此DPD活性較差的患者須注意5-FU在體內消除受阻,易引起蓄積而發生ADRs。也有研究表明,測定5-FU給藥期間的UH2/U可以得到更好的預測結果[14]。本研究發現,一些具有較高UH2/U的患者也有較高的5-FU血藥濃度,提示僅考察DPD活性對于預測5-FU的暴露和代謝情況并不夠,因此需要結合5-FU的血藥濃度檢測結果指導個體化用藥。由于本研究納入的病例數較少,血藥濃度測定結果波動較大,在下一階段應擴大樣本量繼續研究分析。

