五味消毒飲HPLC 指紋圖譜建立及10 種成分同時測定
沈 晗黃玉宇 沈夕坤陳 汀
(1.安徽中醫藥大學,安徽合肥 230012;2.南京中醫藥大學附屬蘇州市中醫醫院,江蘇蘇州 215009)
五味消毒飲出自《醫宗金鑒》,由金銀花、蒲公英、野菊花、紫花地丁、天葵子組成,具有清熱解毒、消癰散結的作用[1],方中各藥藥力專一,均能清熱解毒,為治療癤疔瘡癰的經典方劑。文獻[2-8]報道,這5 種中藥(天葵子除外)均為有機酸、黃酮等抗炎、抗病毒成分,現代臨床上常用于治療外科急性感染,如急性乳腺炎、蜂窩組織炎等。
中藥材質量會直接影響中藥復方制劑質量,從而影響其臨床療效,但單一成分的定量測定無法全面反映中藥材、中藥復方質量。目前,中藥指紋圖譜正成為新興的質量控制手段,它是一種綜合的、可量化的鑒定手段[9],能全面評價中藥材、中藥復方成分信息,對其篩選或控制具有一定的實用價值。因此,本實驗建立五味消毒飲HPLC 指紋圖譜,并同時測定新綠原酸、綠原酸、隱綠原酸、秦皮乙素、咖啡酸、木犀草苷、異綠原酸B、3,5-二咖啡酰奎寧酸、4,5-二咖啡酰奎寧酸、蒙花苷的含量,以期為該制劑質量控制提供依據。
1 材料
1.1 儀器 Agilent 1260 型高效液相色譜儀(美國Agilent 公司);AG285、AX26DR 型電子天平(瑞士梅特勒-托利多公司);KQ-300VDB 型超聲波清洗機(昆山市超聲儀器有限公司);KDC-140R 型超速離心機(安徽中科中佳科學儀器有限公司);Direct-Q3UV 型超純水儀(美國密理博公司)。
1.2 試劑與藥物 綠原酸(批號110753-201415,純度96.2%)、秦皮乙素(批號110741-201708,純度99.9%)、咖啡酸(批號110885-201703,純度99.7%)、木犀草苷(批號111720-201609)、蒙花苷(批號111528-201710,純度96.6%)對照品均購自中國食品藥品研究檢定院;新綠原酸(批號4974,純度≥98.0%)、隱綠原酸(批號3208,純度≥98.0%)、異綠原酸B(批號3089,純度≥98.0%)、3,5-二咖啡酰奎寧酸(批號3089,純度≥98.0%)、4,5-二咖啡酰奎寧酸(批號3001,純度≥98.0%)對照品均購自上海詩丹德生物技術有限公司。金銀花(批號190416,產地山東)、野菊花(批號190401,產地江蘇)均購自蘇州市博源藥業有限公司;蒲公英(批號190721,產地江蘇)、紫花地丁(批號190501,產地江蘇)均購自蘇州市天靈飲片公司;天葵子(批號190318,產地江蘇)購自春暉堂藥業有限公司,上述藥材經南京中醫藥大學附屬蘇州市中醫醫院沈多榮副主任中藥師鑒定為正品。乙腈為色譜純;其他試劑均為分析純;水為超純水。
2 方法與結果
2.1 五味消毒飲制備 按處方比例稱取2 劑藥材量,加18 倍量水浸泡30 min 后煎煮2 次,每次30 min,濾液合并濃縮至500 mL,即得。同法制備10 批樣品(S1~S10),批號分別為20191011、20191012、20191013、20191014、20191015、20191016、20191017、20191018、20191019、20191020。
2.2 溶液制備
2.2.1 對照品溶液 精密稱取新綠原酸、綠原酸、隱綠原酸、秦皮乙素、咖啡酸、木犀草苷、異綠原酸B、3,5-二咖啡酰奎寧酸、4,5-二咖啡酰奎寧酸、蒙花苷對照品適量,置于10 mL 量瓶中,甲醇溶解稀釋,即得(各成分質量濃度分別為0.494 0、0.175 0、0.365 2、0.032 9、0.260 6、0.011 3、0.364 6、0.006 8、0.005 2、0.002 7 mg/mL)。
2.2.2 對照藥材溶液 按“2.1”項下工藝制備金銀花、紫花地丁、野菊花、蒲公英、天葵子溶液,即得。
2.2.3 供試品溶液 精密量取“2.1”項下制劑3 mL,置于10 mL 量瓶中,甲醇定容至刻度,超聲(45 kHz)處理30 min,14 000 r/min 離心5 min,取上清液,0.45 μm 微孔濾膜過濾,即得。
2.2.4 陰性樣品溶液 按“2.1”項下處方比例和制備工藝,分別制備缺金銀花、缺紫花地丁、缺野菊花、缺蒲公英、缺天葵子的陰性樣品,按“2.2.3”項下方法制備,即得。
2.3 色譜條件 Agilent ZORBAX Eclipse XDB-C18色譜柱(4.6 mm×250 mm,5 μm);流動相乙腈(A)-0.1% 磷酸(B),梯度洗脫,程序見表 1;體積流量1.0 mL/min;柱溫25 ℃;檢測波長320 nm,進樣量5 μL。

表1 梯度洗脫程序Tab.1 Gradient elution programs
2.4 HPLC 指紋圖譜建立
2.4.1 精密度試驗 取“2.1”項下樣品(S1),按“2.2.3”項下方法制備供試品溶液,在“2.3”項色譜條件下進樣測定6 次,以11 號峰(綠原酸)為參照,測得各共有峰相對保留時間RSD 為0.032%~0.478%,相對峰面積RSD 為0.144%~2.607%,相似度均大于0.999,表明儀器精密度良好。
2.4.2 重復性試驗 取“2.1”項下樣品(S1),按“2.2.3”項下方法平行制備6 份供試品溶液,在“2.3”項色譜條件下進樣測定,以11 號峰(綠原酸)為參照,測得各共有峰相對保留時間RSD 為0.030%~0.488%,相對峰面積RSD 為0.168%~2.534%,相似度均大于0.997,表明該方法重復性良好。
2.4.3 穩定性試驗 取“2.1”項下樣品(S1),按“2.2.3”項下方法制備供試品溶液,于0、2、4、8、12、24 h 在“2.3”項色譜條件下進樣測定,以11 號峰(綠原酸)為參照,測得各共有峰相對保留時間RSD 為0.040%~1.165%,相對峰面積RSD 為0.150%~2.260%,相似度均大于0.995,表明溶液在24 h 內穩定性良好。
2.4.4 圖譜生成 按“2.2.3”項下方法制備供試品溶液(S1~S10),在“2.3”項色譜條件下進樣測定,將所得數據導入2012 年版《中藥色譜指紋圖譜相似度評價系統》,以S1 為參照,設定時間窗寬度為0.1 min,經多點校正后進行全譜峰匹配,結果見圖1~2。由此可知,10 批樣品中有34個共有峰,其相似度分別為 0.973、0.993、0.998、0.999、0.985、0.995、0.997、0.996、0.999、0.994,均大于0.97,說明樣品之間質量差異較小。
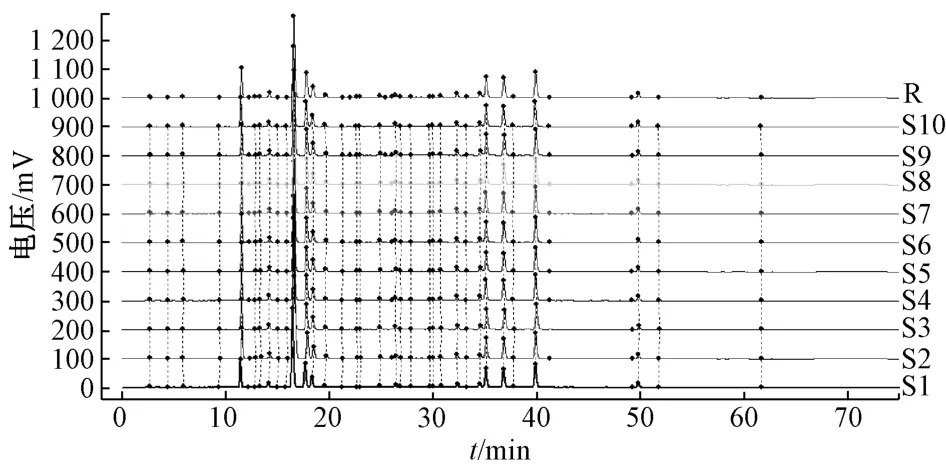
圖1 10 批樣品HPLC 指紋圖譜Fig.1 HPLC fingerprints for ten batches of samples
再選擇分離度好、峰面積高的11 號峰(綠原酸)作為參照,計算共有峰相對保留時間和相對峰面積,見表2~3。由此可知,各批樣品之間共有峰相對保留時間的差異較小(RSD<0.37%),但有些批次之間差異較大(RSD>10%),這是因為峰面積越小,誤差越大,RSD 也會隨之增加。
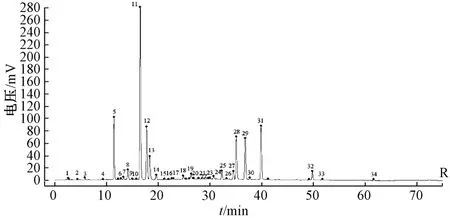
圖2 各成分對照圖譜Fig.2 Reference chromatogram of various constituents
2.4.5 共有峰歸屬及鑒定 根據各藥材HPLC 色譜圖(圖3)及保留時間,可知共有峰來自金銀花的有1、5、7、11、12、14~16、18、25、28~29、31 號峰,來自蒲公英的有1、8、11、14、16、24~25、27~29、34 號峰,來自野菊花的有5、11~12、14、17、19、25~26、28~33 號峰,來自紫花地丁的有6、13、19、23~27、29、32、34 號峰,來自天葵子的只有16 號峰。其中,5、11~14、25、28~29、31~32 號峰通過查閱文獻[10-19]和比對標準品,分別鑒定為新綠原酸、綠原酸、隱綠原酸、秦皮乙素、咖啡酸、木犀草苷、異綠原酸B、3,5-二咖啡酰奎寧酸、4,5-二咖啡酰奎寧酸和蒙花苷,并且13 號峰(秦皮乙素)、32 號峰(蒙花苷)分別是紫花地丁、野菊花特征峰。另外,2~4、9~10、20~22 號峰尚無藥材歸屬,可能它們在煎煮過程中產生了新成分。

圖3 各藥材HPLC 色譜圖Fig.3 HPLC chromatograms of various medicinal materials
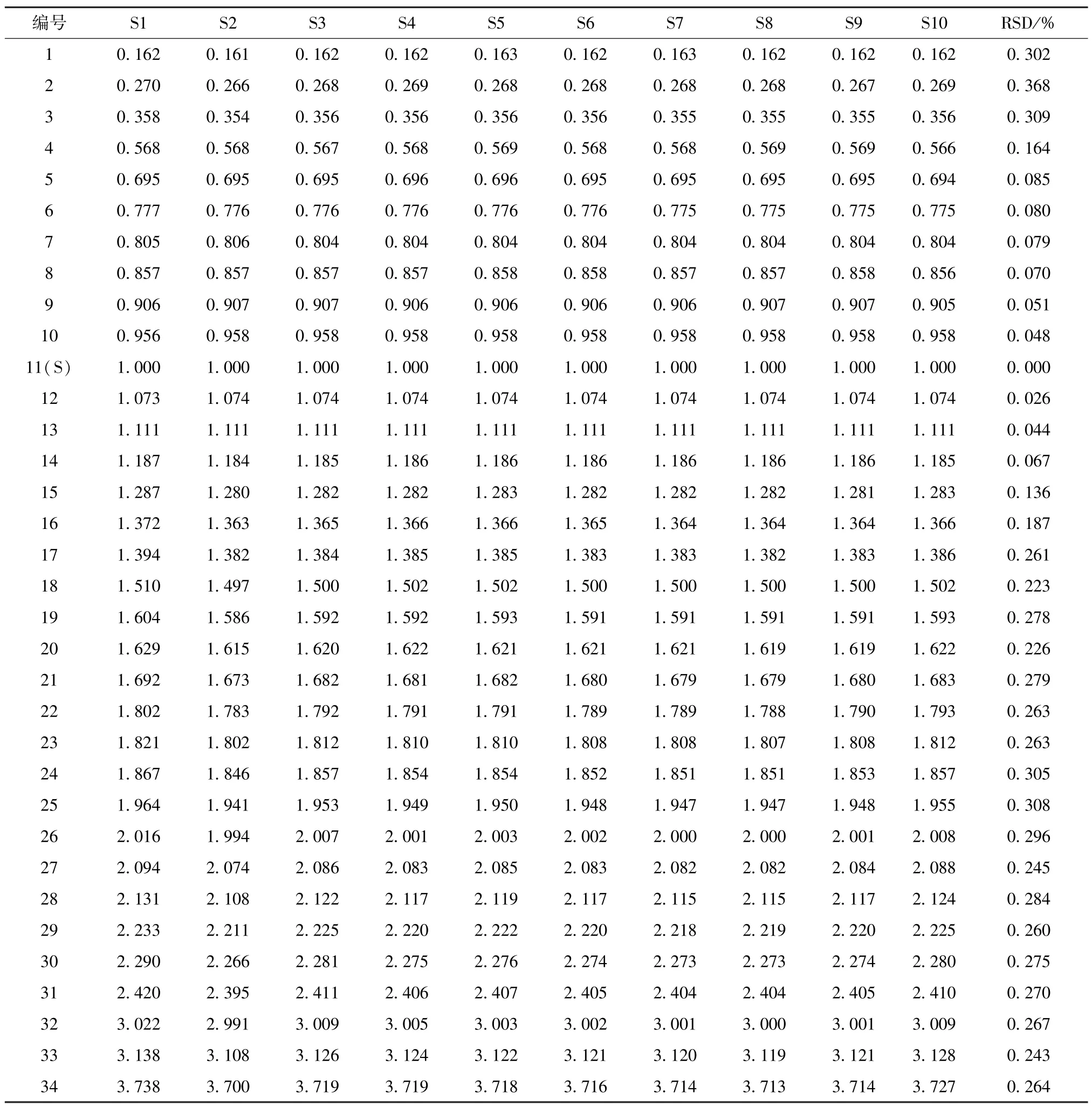
表2 共有峰相對保留時間Tab.2 Relative retention time of common peaks
2.5 各成分含量測定
2.5.1 色譜條件 同“2.3”項。
2.5.2 線性關系考察 取“2.2.1”項下對照品溶液,在“2.5.1”項色譜條件下進樣1.0、2.0、3.0、4.0、5.0 μL 測定,以溶液質量濃度為橫坐標(X),峰面積為縱坐標(Y)進行回歸,結果見表4,可知各成分在各自范圍內線性關系良好。
2.5.3 精密度試驗 取“2.1”項下樣品(S1),按“2.2.3”項下方法制備供試品溶液,在“2.5.1”項色譜條件下進樣測定6 次,測得新綠原酸、綠原酸、隱綠原酸、秦皮乙素、咖啡酸、木犀草苷、異綠原酸B、3,5-二咖啡酰奎寧酸、4,5-二咖啡酰奎寧酸、蒙花苷峰面積RSD 分別為1.19%、0.39%、0.36%、0.40%、0.90%、1.02%、1.23%、1.24%、1.31%、1.39%,表明儀器精密度良好。
2.5.4 重復性實驗 取“2.1”項下樣品(S1),按“2.2.3”項下方法制備供試品溶液,在“2.5.1”項色譜條件下進樣測定6 次,測得新綠原酸、綠原酸、隱綠原酸、秦皮乙素、咖啡酸、木犀草苷、異綠原酸B、3,5-二咖啡酰奎寧酸、4,5-二咖啡酰奎寧酸、蒙花苷峰面積RSD 分別為2.22%、2.13%、2.06%、1.94%、2.25%、2.21%、2.57%、2.69%、3.10%、2.92%,表明該方法重復性良好。
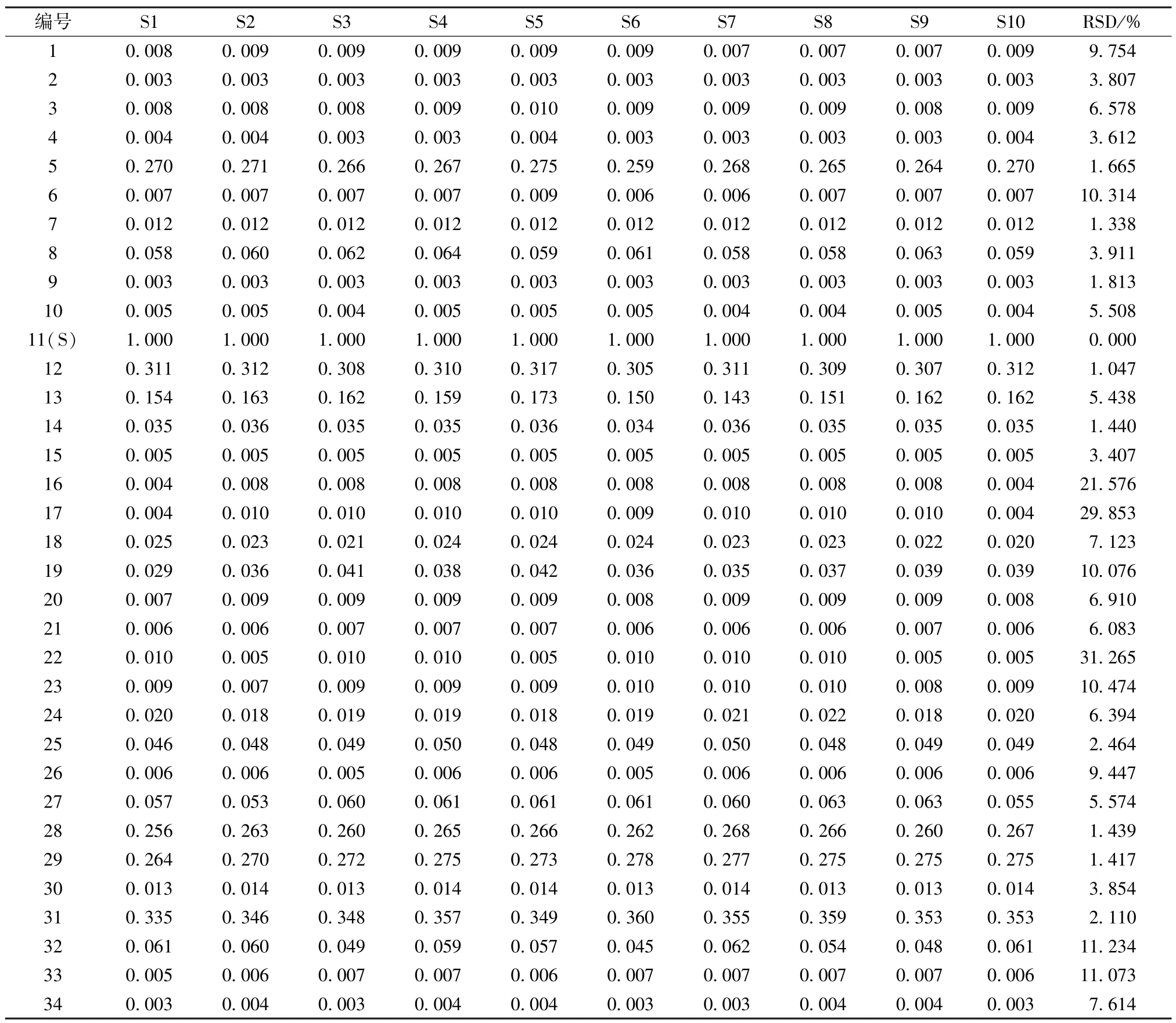
表3 共有峰相對峰面積Fig.3 Relative peak areas of common peaks
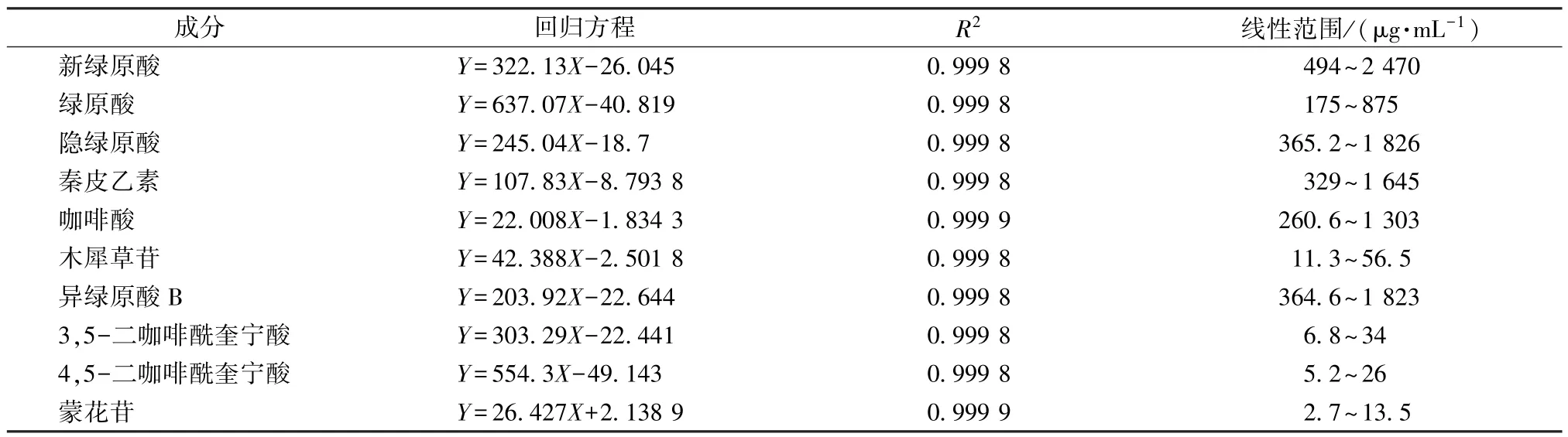
表4 各成分線性關系Tab.4 Linear relationships of various constituents
2.5.5 穩定性試驗 取“2.1”項下樣品(S1),按“2.2.3”項下方法制備供試品溶液,在“2.5.1”項色譜條件下進樣測定6 次,測得新綠原酸、綠原酸、隱綠原酸、秦皮乙素、咖啡酸、木犀草苷、異綠原酸B、3,5-二咖啡酰奎寧酸、4,5-二咖啡酰奎寧酸、蒙花苷峰面積RSD 分別為2.08%、1.65%、1.58%、1.53%、1.73%、2.67%、2.68%、2.78%、3.07%、2.86%,表明溶液在24 h內穩定性良好。
2.5.6 加樣回收率試驗 取“2.1”項下樣品(S1),按“2.2.3”項下方法平行制備6 份供試品溶液,各精密吸取1 mL,置于10 mL 量瓶中,加入對照品溶液,甲醇定容至刻度,在“2.5.1”項下色譜條件進樣測定,計算回收率。結果,新綠原酸、綠原酸、隱綠原酸、秦皮乙素、咖啡酸、木犀草苷、異綠原酸B、3,5-二咖啡酰奎寧酸、4,5-二咖啡酰奎寧酸、蒙花苷平均加樣回收率分別為100.96%、100.37%、99.74%、97.12%、100.33%、97.05%、104.50%、97.43%、103.00%、95.16%,RSD 分別為1.09%、1.79%、1.45%、3.95%、1.94%、1.83%、4.79%、3.68%、2.91%、4.90%。
2.5.7 測定結果 取10 批樣品,按“2.2.3”項下方法制備供試品溶液,在“2.5.1”項色譜條件下進樣測定,計算含量,結果見表5。
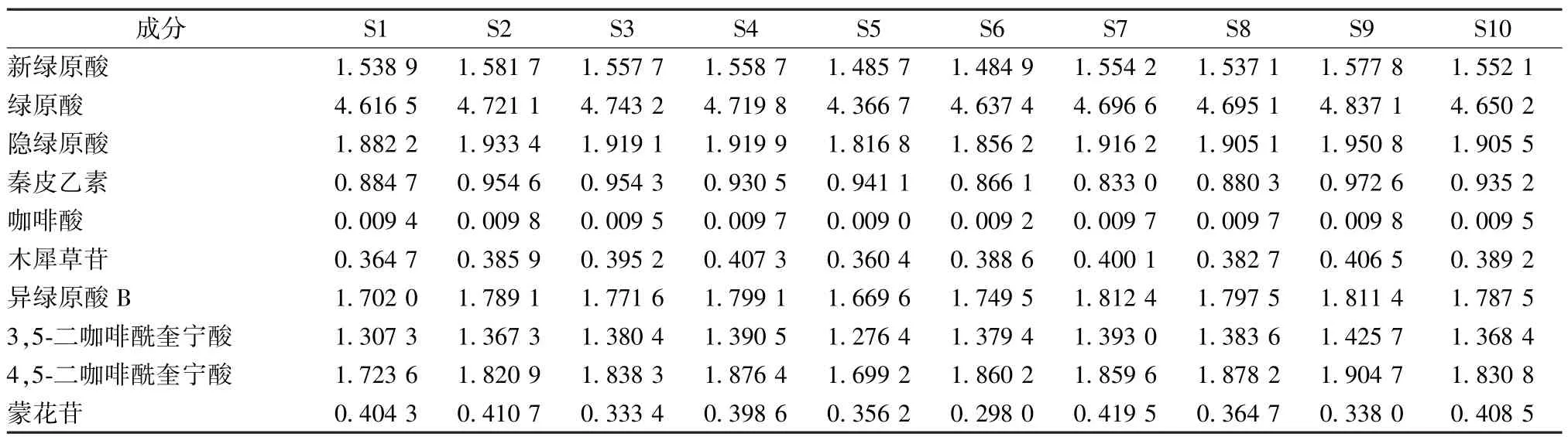
表5 各成分含量測定結果(mg/g)Tab.5 Results of content determination of various constituents(mg/g)
3 討論
3.1 煎煮條件確定 本實驗在進行煎煮前,先對方劑煎煮因素進行了篩選,包括藥材加水量、方劑浸泡時間、煎煮時間,發現在相同的浸泡時間、煎煮時間下隨著加水量增加,指標性成分含量越來越高,在加水量為18 倍時曲線出現拐點,從節能高效的原則出發,選擇18 倍量;《醫療機構中藥煎藥室管理規范》 規定,一般浸泡時間不得低于30 min,而且相關文獻也表明中草藥浸泡時間在20~30 min 即可,故選擇30 min;考察了煎煮時間10、20、30、40、50 min,發現大部分成分的折線圖在30 min 后出現拐點,而且隨著時間延長其含量降低,故選擇30 min。最終確定,煎煮條件為藥材加18 倍量水浸泡30 min 后煎煮2 次,每次30 min。
3.2 流動相確定 本實驗考察了0.05% 磷酸-乙腈、0.1% 磷酸-乙腈、0.05% 磷酸-甲醇、0.1% 磷酸-甲醇,發現0.1%磷酸-乙腈洗脫時各成分色譜峰峰形較好。
3.3 檢測波長確定 本實驗比較了230、260、290、320 nm 波長處各成分色譜信息,發現在320 nm處色譜峰分離度、峰形較好,故選擇其作為檢測波長。
3.4 指標成分確定 對于指標成分的選擇,應從中藥君臣佐使配伍理論、復方臨床功效及成分有效性、可測性、特殊性的角度出發[20]。五味消毒飲中金銀花是君藥,故應首要考慮該藥材;全方功效清熱解毒、消癰散結,故還應針對其有效性進行選擇;特殊性是指能代表某一類藥或某一個藥的化學成分[21],如紫花地丁中秦皮乙素、野菊花中蒙花苷;可測性是指可進行定性鑒別、定量分析的指標成分[22]。金銀花、野菊花、蒲公英均含有酚酸、黃酮類成分,其中金銀花總酚、總環烯醚萜均具有明顯的抗炎作用,以前者最強[15];以咖啡酰基奎寧酸結構單元為主的新綠原酸、綠原酸、隱綠原酸、咖啡酸、異綠原酸B、3,5-二咖啡酰奎寧酸、4,5-二咖啡酰奎寧酸也具有抗氧化、抗菌、抗炎、抗病毒等作用[22];木犀草苷在上述3 種藥材中均存在,具有抗腫瘤、抗炎、抗病毒等作用[23];蒲公英中的酚類成分在抗炎方面也發揮著重要作用[14];蒙花苷[6]是野菊花中特有的黃酮類成分,秦皮乙素[8]是紫花地丁主要活性成分,均有抗炎作用。因此,本實驗選擇上述10 種成分作為指標。
4 結論
本實驗建立五味消毒飲HPLC 指紋圖譜,并同時測定新綠原酸、綠原酸、隱綠原酸、秦皮乙素、咖啡酸、木犀草苷、異綠原酸B、3,5-二咖啡酰奎寧、4,5-二咖啡酰奎寧、蒙花苷的含量,該方法準確可靠,重復性好,可用于該制劑的質量控制。另外,五味消毒飲中黃酮、酚酸、萜類成分等有效物質很多,今后將進一步結合紫外、紅外、質譜對其進行分析。