基于微藻培養的污水凈化與資源化技術研究
馮金東
摘 要:水污染問題從近代以來就一直困擾著人們。為此,人們采用了各種方法試圖克服這個問題。然而,現在世界范圍內所采用的最為廣泛的污水凈化法,活性污泥法,仍然存在著不少的問題,比如過程控制難度大,成本高,污染物去除率低下等等。所以人們試圖使用其他方法替代掉活性污泥法以解決這些缺點。其中最為突出的是微藻法。污水中的主要污染物:總氮,總磷,COD等,都是微藻生長所需要的養料。因此可以以污水作為微藻的“培養基”,讓微藻吸收水中的污染物從而達到凈化污水的目的。同時,成熟后的微藻內的生物質也可以用于副產品的制造。
關鍵詞:微藻;污水凈化;懸浮附著微藻培養法;總氮總磷去除;油脂
一、緒論
時至今日,水污染已經成為了最嚴重的生態問題之一。它在發展中國家和發達國家都存在,只是具體的情況有所差別。在美國,有59%的人們都在擔心他們的飲用水是否被污染(Saad L.,2009)。在馬來西亞,由于污水的大量排放,盡管存在保護水質的立法,在2013年由環境部監測的340條河流中,大約25條河流被列為高度污染(Mariani Ariffin等,2015)。在日本,一組研究人員對當地地下水水質的調查中發現,40個分區中有15個分區的硝酸鹽含量超標(Wang,S等,2015)。同樣,在我國,2017年的全國污水總排放量為6996610萬噸(中國統計出版社,2019),幾乎是2000年污水總排放量(1942405萬噸)的3.6倍(中國統計出版社,2001)。由此可見,水污染問題是全世界所共有的。水污染問題對于環境及生態存在嚴重的危害。比如,當污水被排放到海洋后,便對珊瑚產生了極大的危害,其中高濃度的無機物養分(銨,磷酸,和亞硝酸鹽),不僅會危害到珊瑚的共生生物,同時造成藻類大規模的生長,從而導致珊瑚的數量銳減(Stephanie L. Wear等,2015)。在馬來西亞,污水的排放導致海藻在其海域大量繁殖,并已擴散到了一定數量的島嶼的珊瑚礁中(Mariani Ariffin等,2015)。由此可見,水污染已經成為了全球范圍內亟待解決的問題。
在調研了30多篇文章后,可以得出結論:大多數工廠都在使用物化生連用的方法處理污水,其中生物法是核心。這是因為生物法的好處有很多,其中包括簡單高效易于操作、能夠對污水中的氮磷等化學元素進行快速去除、保證污水的處理效果等優點(鄭昆等,2019)。同時,生態法(其中大部分為人工濕地)的使用量較為低下,是因為人工濕地處理污水的關鍵因素,植物種類和其介質種類可能會影響到人工濕地的污水處理效果,因為它們會隨著時間的推移直接或者間接改變污水的處理效果(Arias C.A.等,2001.Li, J.等,2008.)。此外,人工濕地的處理性能嚴重依賴于合適的操作參數(水深、水力停留時間和負荷、進料方式、設置設計等)(Haiming Wu等,2015)。因此,工廠只能選擇相較于其他方法更為普適,性價比更高的生物法,同時配合物理法和化學法進一步提高污水凈化的質量。
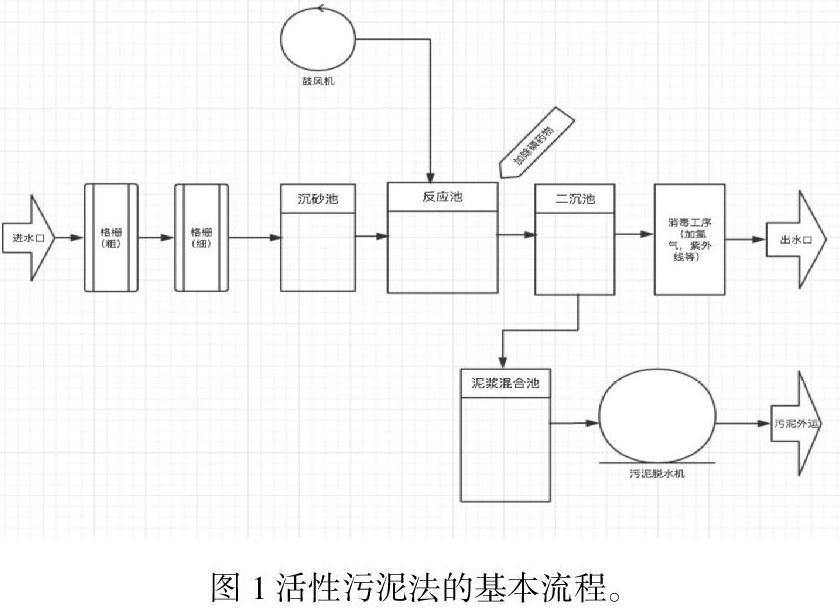
在圖表中可以看到,在生物法中,活性污泥法是目前工廠采取的最為廣泛的方法。圖1是活性污泥法的大致工作流程(葉銳,2017.唐橫,2019.王冰等,2015.)。其處理污水的優點有以下: 1、活性污泥法還能夠有效地清除污水中的臭氣。臭氣中的主要成分NH3是一種易容于水的化合物,而當它溶解到水中后,會轉化成硝酸鹽和亞硝酸鹽。而這兩種物質,可以在微生物的硝化過程中被處理干凈(Fuqiang Fan等,2020)。2、活性污泥對有機物和氮的去除效果較為可觀(田宇等,2014)。然而,活性污泥法同樣存在一些缺陷。一,活性污泥法凈化效果相較于微藻法較為低下。二,活性污泥法中污泥回流所帶來的磷酸鹽會對其中的微生物造成影響,從而影響到其處理污水的效果(田宇等,2014)。此外在該方法中所有的微生物處在同一個反應器,會導致菌種間的競爭,這一點同樣也會造成污水處理效果的降低(田宇等,2014)。三、從活性污泥法的流程圖(圖1)中也可以看到該種方法在凈化污水時的過程冗長。
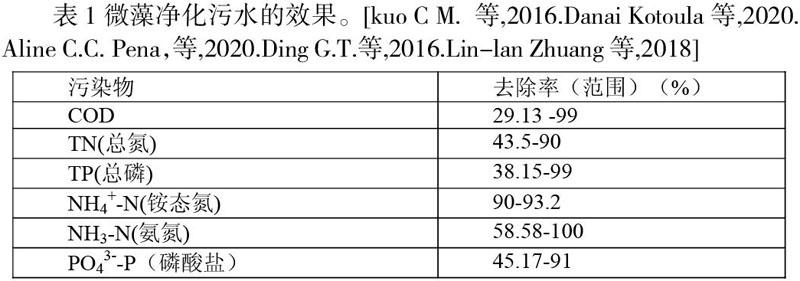
在調研中,同樣可以知道微藻法清理污水的使用范圍較小,運用不大,這是因為以現在的技術,微藻培養、維持等費用太高。但是,微藻處理污水技術仍然具有很大的研究前景。因為,微藻處理污水的優點很明顯:1、微藻能夠在處理污水的同時將太陽能轉化為有用的生物質,可以高效吸收諸如氮、磷等能引起水體富營養化的物質(N. Abdel-Raouf 等,2012.), 致使污水中的污染物能夠以微藻為媒介被再利用,再次創造價值。2、由于微藻能夠大幅度吸收污染物,因此相較于其他的生物法污水凈化方法(如:活性污泥法,氧化溝法)微藻法的性價比會更高。(降低污水處理成本)(Kun Lia等,2019)。其處理效果如圖四。3、微藻能夠將污水中的營養物質去除到一個較低的水平,從而滿足人們日常生活的需要(Whitton R.等,2015.)。4、微藻在凈化污水的同時,也能同時獲得許多有用的副產品:(1).油脂。微藻中的油脂可用于生物柴油的制備。微藻中的油脂可以被轉化成不同的生物柴油, 如生物氫, 生物柴油,生物乙醇和沼氣。同時,微藻油脂在被做成生物柴油時,每公頃所能釋放的能量是土地作物所制成的生物油所能放出能量的30-100倍(Raheem A.等,2015)。由此可見,如果用微藻為原料制造生物柴油,那么能源利用效率將會被極大地提高。
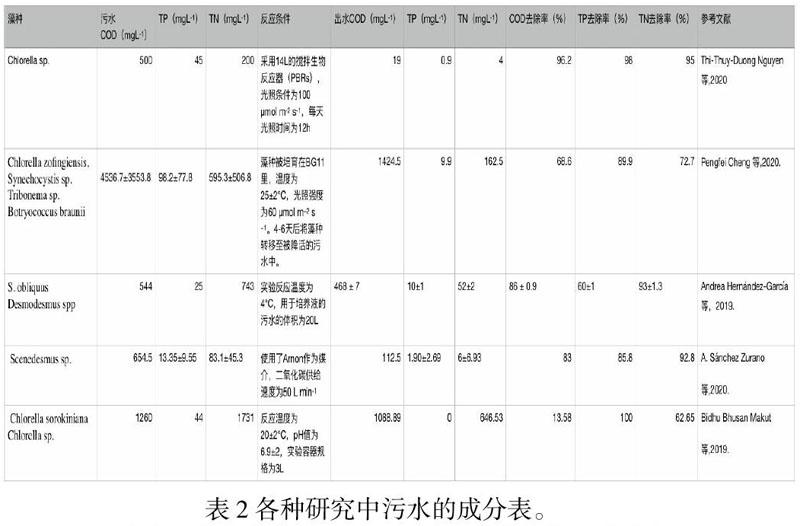
現在,也有很多的學者已經展開了關于微藻凈化污水的研究。圖五是他們所采用的微藻凈化污水實驗(Thi-Thuy-Duong Nguyen等,2020.Pengfei Cheng 等,2020.Andrea Hernández-García等,2019.A. Sánchez Zurano等,2020.Bidhu Bhusan Makut等,2019.)。從他們的實驗可見,微藻培養仍然存在一定的問題。在他們的實驗中,普遍采用的是微藻培養方法是懸浮式微藻培養器,也就是泳道。懸浮式微藻培養方法本身就伴隨著不小的缺陷。1、在懸浮式微藻培養中,水池中微藻藻細胞的密度往往會比較低(Martin Gross等,2015.)。2、懸浮式微藻培養的藻種非常難以收獲。根據調查,在懸浮式微藻培養的水池中,只是收獲培養的微藻的生物質的成本就已占據了總成本的21%(Ryan Davis等,2011)。相較而言,附著式微藻培養會好很多。它有以下優點:1、附著式微藻培養法的反應器上的微藻容易收獲,從而節省成本(Martin Gross等,2015.)。2、附著式培養可以使光照限制最小化(Martin Gross等,2015.)。3、附著式培養可以增強二氧化碳的物質傳遞(Martin Gross等,2015.)。4、附著式培養可以增加微藻細胞的固體滯留時間,從而使它不會被輕易的洗掉(Martin Gross等,2015.)。
二、材料與方法
2.1材料
2.1.1藻種
本次實驗中采用的微藻藻種是柵藻CGMCC 3036,在中國微生物保藏中心購得。微藻的保存方法是將其置于BG11培養基內。
2.1.2實驗原理與反應器構建
實驗中所用的培養方法是懸浮法與附著法結合法。具體的反應器則如圖2所示。反應器的主體是一個透明圓柱型透明薄壁容器,其規格為10 L。容器的頂部有一個燈箱,以便能夠令微藻進行光合作用。本實驗中光暗比為14 h:10 h。在容器的底部,有一個功率為250 W,轉速為1400 轉/分的氣泵,具體效果如下:1.曝氣。氣泵可以使反應器內的微藻有足夠的氧氣和其他種類的氣體進行各種生命活動, 從而保證其中的污水能夠被充分的凈化,微藻也能成長到一定的程度用以萃取生物質用于制造其他副產品。2.增加效率。氣泵可以使培養器中的污水充分流動,循環, 因此懸浮培養的微藻都能充分的進行光合作用。此外,載體也能夠隨著污水的流動而流動。
2.1.3污水配置
本次實驗采用了八組不同的污水配置(Lin-Lan Zhuang等,2018)。其中,前四組被稱為“低濃度組”, 其中的總氮含量都為15 mg/L, 四組的總磷含量各有不同, 分別為5 mg/L,3 mg/L, 1.5 mg/L, 0.5 mg/L. 后四個組被稱為“高濃度組”, 他們的總氮含量都為150 mg/L。 這四個組的總磷含量有所不同, 分別是15 mg/L,10 mg/L,5 mg/L,1.5 mg/L。 其中,高濃度組在測量指標和數據處理時會按照一定的倍數進行稀釋。
2.2計算方法與指標
2.2.1計算公式
懸浮培養的微藻和附著培養的微藻的生物量比例計算公式如下:
單位為個/(ml·天)。c2 為隔了時間t后微藻的密度,單位是個/ml。c1為實驗開始時微藻的密度,單位也是個/ml。t為時間,單位是天。
2.2.2氮磷的檢測方法
2.2.2.1總氮的檢測方法
本實驗中對于總氮的檢測采用的是TOC儀。具體操作步驟如下:將待測水樣注入TOC/TN分析儀的高溫燃燒管中,使得總氮轉化為一氧化氮(以下用NO代替),再將NO導入電化學檢測器中,就可以通過NO氣體的濃度測定出總氮的含量(張媛媛等,2019.)。
2.2.2.2總磷的測定方法
本實驗中對于總磷的測定采用的方法是國標法(鉬酸銨分光光度法,2011)。測定TP所需要的藥品有5%過硫化鉀溶液、10%抗壞血酸溶液、鉬酸鹽溶液、磷儲備液(50.0 μg P / mL)、磷標準液(2.00 μg P / mL)。需要的儀器有比色管、光譜儀。5%過硫化鉀溶液是將5g的過硫化鉀溶解于100ml的去離子水制備而成,10%抗壞血酸溶液是將10 g抗壞血酸溶解至100ml去離子水制備得到。鉬酸鹽溶液的制備過程如下:1、將13 g鉬酸銨((NH4)6Mo7O24 4H2O)溶解至100 ml的去離子水中。2、將0.35 g酒石酸鉀氧銻(K(SbO)C4H4O6 1/2H2O)溶解至100 ml去離子水中。3、將第一步中調配好的鉬酸銨溶液慢慢倒入300 ml(1+1)硫酸溶液,并攪拌。4、往第三步調制好的溶液中加入第二步調制好的酒石酸鉀氧銻溶液,并攪拌均勻。磷儲備液的制備方法如下:1、將磷酸二氫鉀在110 ℃的條件下干燥2 h。2、在干燥器中將其冷卻。3、將0.2197 g KH2PO4轉移至1000 ml容量瓶。4、加入5 ml(1+1)硫酸。5、加入去離子水并定容至1000 ml。磷標準液的制備過程如下:1、吸取10 ml磷儲備液至規格為250 ml的容量瓶中。2、加入去離子水并定容至250 ml。實驗步驟如圖3.
2.3 藻密度檢測方法
藻密度的檢測方法是顯微鏡血球計數板法。具體的操作步驟如圖4 所示。先提取一部分藻液,滴入一滴至血球計數板中,若一小格中的微藻數量不是5-10個,則需要稀釋,直到一小格中有大約5-10個微藻為止。如若一小格中的微藻大約為5-10個,則無需稀釋,直接觀察。本次實驗中采用的是規格為25x16血球計數板,只需要觀察四角還有中央五個中格的的微藻,即80個小格的微藻,并數出微藻的數量。將數出來的微藻數量記為n,稀釋倍數記為x,藻密度記為r, 25x16規格的血球計數板的藻密度計
2.4微藻中三大營養物質(生物質成分)測定方法
本次實驗中用于測定微藻中三大營養物質的測量方法為傅里葉變換紅外光譜法(孟迎迎等,2017.)。主要的測量工具為傅里葉變換紅外光譜儀。測量原理如下:由于該儀器屬于分子光譜,因此它可以同時測定微藻中的多種營養物質的種類和含量
2.5實驗設計
本次實驗階段為10天, 實驗開始前的準備工作為期14天,共計24天。 在準備階段,使用BG11配方(NaNO3 1.5 g/L, K2HPO4 3×10-2 g/L, MgSO4·7H2O 7.5×10-2 g/L, CaCl2·2H2O 36×10-2 g/L, 和鐵結合的檸檬酸 6×10-3 g/L, 檸檬酸銨 6×10-3 g/L, 乙二胺四乙酸? 1×10-3 g/L, Na2CO3 6×10-3 g/L, H3BO3 2.86×10-3 g/L, MnCl2·4H2O? 1.81×10-3 g/L, ZnSO4·7H2O 2.22×10-4 g/L, NaMoO4·5H2O 3.9×10-4 g/L, CuSO4·5H2O 7.9×10-5 g/L, Co(NO2)2·6H2O 4.94×10-4 g/L? (Li Gang等,2017.))將柵藻培育在250 ml的錐形瓶中。 14天后,將柵藻從錐形瓶中移出,轉移至10 L的反應裝置中,同時將污水注入反應裝置, 當作微藻的培養液,還要打開氣泵,以確保柵藻能夠懸浮在污水中, 不會沉積至反應器底部。
四、結論
綜上所述,總氮總磷含量對于微藻的生長和污水凈化效果的影響并不絕對,關鍵在于其比例。過高的氮磷比會抑制微藻的生長速度,同時減弱其對污水的凈化效果。此外懸浮附著混合培養法所培養的微藻的生長情況較為良好,其對于總氮總磷的去除能力也較為可觀,同時微藻中的油脂含量也比較可觀。
參考文獻:
[1]Saad L. Water pollution Americans top green concern.[OL] http://www.gallup.com/poll/ 117079/waterpollution-americans-top-green-concern.aspx,2009.
[2]中國統計年鑒[M],中國統計出版社,2019.
[3]中國統計年鑒[M],中國統計出版社,2001.
(深圳高級中學? ?廣東? 深圳? ?518000)

