谷關假單胞菌脂肪酶基因PgLip1的克隆和表達
張冰玉, 蘇小運
(中國農業科學院飼料研究所,農業農村部飼料生物技術重點開放實驗室,北京 100081)
脂肪酶(lipase, EC3.1.1.3)是指催化三酯酰甘油水解的酶的總稱,是一類特殊的酯鍵水解酶[1]。其天然底物是長鏈脂肪酸酯,既可以在兩相系統(油、水界面)中起作用,也可以在水相中起作用。脂肪酶作為生物催化劑可催化由不同底物出發的水解和合成反應,且反應條件溫和、副產物少。因此,脂肪酶的應用十分廣泛,如生物柴油[2-3]、食品行業[4-5]、醫藥衛生[6-7]、飼料[8]、化學化工[9-11]、環境保護[12]等領域,已成為在生物技術和有機合成方面應用最廣泛的一類酶。
脂肪酶來源十分廣泛,其中動物、植物、微生物都能生產脂肪酶。微生物來源的脂肪酶種類多,與動植物來源脂肪酶相比,有的微生物脂肪酶作用溫度范圍更廣、穩定性更好、活性更高,適合大規模工業化生產,因此在工業領域更具有應用價值。根據作用溫度,脂肪酶可分為高溫、中溫和低溫脂肪酶[13]。與中高溫脂肪酶相比,低溫脂肪酶的作用溫度相對較低,具有低溫高催化活性和對熱敏感等特性,在食品、水產飼料、洗滌、脂類加工、有機合成以及低溫環境修復等方面有著廣泛的應用前景[14]。
雖然已有一些低溫脂肪酶被發現、克隆和表達,但其數目仍然較少,且性質較為單一。目前,假單胞菌是低溫脂肪酶最主要的來源[13],假單胞菌來源的脂肪酶具有反應活性高、穩定性好、反應類型多、有機溶劑耐受性好、應用廣泛等特點,特別是在光學活性化合物的拆分與合成時具有較高的立體選擇性,因此具有巨大的挖掘潛力[15-17]。谷關假單胞菌(Pseudomonasguguanensis)是2013年新發現的一種假單胞菌。據報道,它可利用聚氧乙烯(20)山梨醇酐單月桂酸酯(吐溫-20)和聚氧乙烯脫水山梨醇單油酸酯(吐溫-80)作為單一的碳源生長,因此其基因組可編碼某種酯酶;該菌還能夠耐受高鹽離子濃度(7%)生長且具有豐富的酶系[18],因此它所編碼的酶可能有一定的抗逆性。此外,Devi等[19]從關谷假單胞菌培養篩選出一種生物乳化劑,能乳化石油和柴油等,該菌在生物技術應用上得到越來越多的關注。綜合以上信息,由于谷關假單胞菌也是假單胞菌屬的成員之一,也可能編碼脂肪酶。基于此,本研究嘗試利用已知的門多薩假單胞菌(Pseudomonasmendocina)脂肪酶蛋白序列,本研究通過對谷關假單胞菌的基因組進行同源基因搜索獲得了新的脂肪酶基因,豐富了低溫脂肪酶基因資源。進而通過將該脂肪酶在大腸桿菌中重組表達并進行酶學性質的生化表征研究,發現獲得的脂肪酶在低溫下具有良好活性,表面活性劑對其活性有激活作用,且該酶在部分有機溶劑中高濃度處理時較低濃度下具有更高的酶活,本研究結果可為該脂肪酶在工業中的應用提供有用信息。
1 材料與方法
1.1 儀器和試劑
1.1.1試驗材料 大腸桿菌(Escherichiacoli)Trans T1和Transetta(DE3)菌株均購于北京全式金生物科技有限公司,分別用于基因克隆、質粒擴增以及蛋白的重組表達。
1.1.2主要試劑 限制性內切酶購自TaKaRa公司;T4 DNA連接酶購自New England Biolabs公司;DNA提取試劑盒、質粒小量提取試劑盒和DNA膠回收試劑盒購自OMEGA公司;蛋白定量試劑盒購自北京全式金公司;蛋白Marker購于北京GeneStar生物公司;p-nitrophenyl acetate(pNPA)、p-nitrophenyl butyrate(pNPB)、p-nitrophenyl caprat(pNPC)、p-nitrophenyl laurate(pNPL)、p-nitrophenyl myristate(pNPM)、p-nitrophenyl palmitate(pNPP)和dimethyl sulfoxide(DMSO)購自Sigma-Aldrich公司;其他未列出試劑均為分析純。
1.1.3主要儀器 T100TM普通PCR儀和凝膠成像系統,購自美國Bio-Rad公司;Synergy H1酶標儀購自美國Thermo公司;himac CR-GII高速冷凍離心機購自日本HIMAC公司。
1.2 試驗方法
1.2.1脂肪酶PgLip1基因的篩選、克隆和載體構建 使用RAST在線服務器(http://rast.nmpdr.org/)對谷關假單胞菌的基因組序列(NZ_FNJJ01000004.1)進行自動注釋。因來源于門多薩假單胞菌的脂肪酶性質已經得到較好的表征且已在生產中得到應用[20],將其氨基酸序列在RAST服務器中對谷關假單胞菌的基因組序列進行BlastP分析,得到氨基酸序列一致性為92.6%,將該基因命名為Pseudomonasguguanensislipase1(PgLip1)。采用SignalP(http://www.cbs.dtu.dk/services/SignalP/)預測所編碼脂肪酶的信號肽。PgLip1的理論蛋白質分子量以及等電點采用ExPASy-ProParam(https://web.expasy.org/protparam)來預測。
將PgLip1基因的密碼子根據大腸桿菌的偏好性進行序列優化,送金斯瑞公司合成基因,使用NdeI和XbaI限制性內切酶切割所獲得的基因,與pET-28a(+)質粒進行連接,將連接產物轉化到大腸桿菌Trans T1感受態細胞中,涂布于含有50 μg·mL-1卡那霉素的LB平板上,37 ℃培養過夜,挑取克隆后并進行PCR鑒定。將所獲得的陽性克隆在含50 μg·mL-1卡那霉素的LB培養基中培養,提取質粒并送測序,篩選陽性質粒pET-PgLip1。
1.2.2PgLip1酶的表達和純化 將測序驗證正確的重組質粒pET-PgLip1轉入大腸桿菌表達宿主細胞 Transetta(DE3)中,并將菌液涂布在同時含有50 μg·mL-1卡那霉素和25 μg·mL-1氯霉素的LB平板上,37 ℃過夜培養,待菌落長出后挑取單克隆接種于50 mL LB液體培養基中培養。37 ℃、220 r·min-1振蕩培養12 h,按2% 比例轉接于300 mL LB培養基以擴大培養。37 ℃、220 r·min-1振蕩培養2 h至OD600為0.5時,加入300 μL濃度1 mol·L-1的誘導劑異丙基-β-D-硫代半乳糖苷(IPTG),將培養溫度降低至16 ℃,繼續振蕩培養16 h。誘導后的菌液10 000 r·min-1離心5 min,收集沉淀,將其重懸于pH 8.5的50 mmol·L-1Tris-HCl緩沖液中,使用超聲破碎儀進行細胞破碎。10 000 r·min-1離心5 min,收集上清液。將上清液緩慢流加至預先平衡的鎳柱,用含20~400 mmol·L-1梯度咪唑的50 mmol·L-1Tris-HCl緩沖液清洗非特異結合蛋白,最后用含500 mmol·L-1咪唑的50 mmol·L-1Tris-HCl緩沖液洗脫目的蛋白。將洗脫蛋白用SDS-PAGE凝膠電泳檢驗,并對不含咪唑的50 mmol·L-1Tris-HCl緩沖液進行透析,獲得純化并脫鹽的重組脂肪酶。
1.2.3PgLip1的活性測定 使用牛血清蛋白為標準蛋白,采用Bardford法[21]準確定量PgLip1的蛋白濃度。脂肪酶的活性測定采用比色法,底物采用pNPM,脂肪酶水解pNPM釋放出pNP,通過測定410 nm的吸光度以判定pNP的釋放量。每組試驗設定3個重復。在37 ℃ pH 8.0的條件下以每分鐘釋放出1 μmolpNP所需的酶量為一個酶活力單位(U)。
1.2.4PgLip1的酶學性質研究 ①最適底物。將含有不同鏈長的對硝基苯酚酯類底物pNPA、pNPB、pNPC、pNPL、pNPM和pNPP(脂肪鏈分別含有2、4、8、12、14和16個碳原子)均配置成3 mg·mL-1的底物濃度,與PgLip1在37 ℃、pH 8.5的50 mmol·L-1Tris-HCl緩沖液中孵育15 min,以不加脂肪酶的反應作為陰性對照,通過pNP的釋放,判定該酶的最適底物。
②最適pH和pH穩定性。配制具有不同pH的緩沖液(pH 2.0~3.0:甘氨酸-鹽酸;pH 3.0~8.0:檸檬酸-磷酸氫二鈉;pH 8.0~9.0:Tris-HCl;pH 9.0~12:甘氨酸-氫氧化鈉),設置pH 2、3、4、5、6、7、8、8.5、9、10、11、12共12個處理,濃度均為50 mmol·L-1。將0.4 μmol·L-1的PgLip1和0.084 mmol·L-1的pNPM底物,在上述不同pH的緩沖液中于37 ℃孵育15 min,測定催化底物生成pNP的能力。以酶活最高的pH作為最適pH并將此時的酶活設為100%;將其他pH條件下的酶活除以此酶活作為相對酶活。將0.4 μmol·L-1的PgLip1酶液在不同pH下37 ℃處理1 h,在最適條件下以同樣底物測定剩余酶活。以未孵育處理的酶作為對照并將其酶活設為100%,測定并計算酶在不同pH下的殘余相對活力。
③最適溫度和熱穩定性。設置10、20、30、40、50 ℃共5個溫度,將0.4 μmol·L-1的PgLip1在最適pH(pH 8.5)、不同溫度和0.084 mmol·L-1的pNPM底物孵育反應15 min,測定pNP的釋放,從而判定最適溫度。將酶活最高的反應溫度下的酶活力設定為100%,將其他溫度下酶活除以此酶活獲得相對酶活。
將0.4 μmol·L-1的酶液分別在不同溫度(40~60 ℃)下保溫,在不同時間點取樣,在最適溫度和最適pH條件下同樣以pNPM底物測定殘余酶活。以未進行熱處理的脂肪酶活作為100%,將處理后的殘余酶活除以此酶活獲得不同溫度、不同時間的相對酶活,用以檢測酶的熱穩定性。
1.2.5金屬離子對PgLip1活性的影響 選擇Ca2+、Cu2+、Mg2+、Fe3+、Mn2+、Zn2+、Pb2+、Ag+、Cr3+、K+、Ni+和Co2+12種金屬離子,將0.4 μmol·L-1的PgLip1分別與5 mmol·L-1的不同金屬離子在pH 8.5、37 ℃孵育30 min,在最適pH和最適溫度下將酶和0.084 mmol·L-1pNPM底物孵育測定酶的相對活力。以未加金屬離子的反應作為對照,將該酶活設定為100%,計算不同金屬離子處理的的相對酶活。
1.2.6表面活性劑、變性劑以及EDTA對PgLip1活性影響 選擇1%的Triton X-100、吐溫-20和吐溫-80三種表面活性劑,1%β-巰基乙醇和0.1% SDS兩種變性劑以及5 mmol·L-1EDTA,將0.4 μmol·L-1的PgLip1分別加入到以上不同溶液中,37 ℃孵育1 h,在最適pH 和最適溫度條件下以0.084 mmol·L-1的pNPM作為底物測定酶活。以未用上述任何試劑處理的酶液作為對照,將該反應的酶活力設定為100%,計算判定表面活性劑、變性劑和EDTA對脂肪酶的影響。
1.2.7有機試劑對PgLip1活性影響 選擇丙酮、甲醇、乙醇、異戊醇、乙腈、異丙醇和乙酸乙酯共7種有機溶劑,將0.4 μmol·L-1的PgLip1酶分別加入10%、30%、50%終濃度的上述有機溶劑,在30 ℃下孵育1 h,在最適pH和最佳溫度條件下以0.084 mmol·L-1的pNPM作為底物測定脂肪酶的酶活。以未加有機試劑的反應作為對照,將該反應的酶活力設定為100%,計算不同有機溶劑處理的相對酶活。
1.3 數據統計與分析
根據試驗數據平均值,采用SPSS 19.0軟件中的One-way ANOVA過程進行單因素方差分析,LSD和Duncan氏法進行各組間多重比較。
2 結果與分析
2.1 脂肪酶PgLip1基因的克隆和表達純化
對PgLip1基因分析發現,該基因全長840 bp,預測編碼一個脂肪酶PgLip1,長度為279個氨基酸,與來源于門多薩假單胞菌的脂肪酶有92.6% 的相似性。SignalP分析發現,其N端22 個氨基酸為信號肽序列。去除信號肽的成熟脂肪酶PgLip1由257個氨基酸殘基組成,理論蛋白質分子質量27.4 kDa,理論等電點pI為9.0。重組PgLip1脂肪酶的SDS-PAGE電泳結果(圖1)顯示,其表觀分子量為27.4 kDa,與預期蛋白分子量大小基本一致。
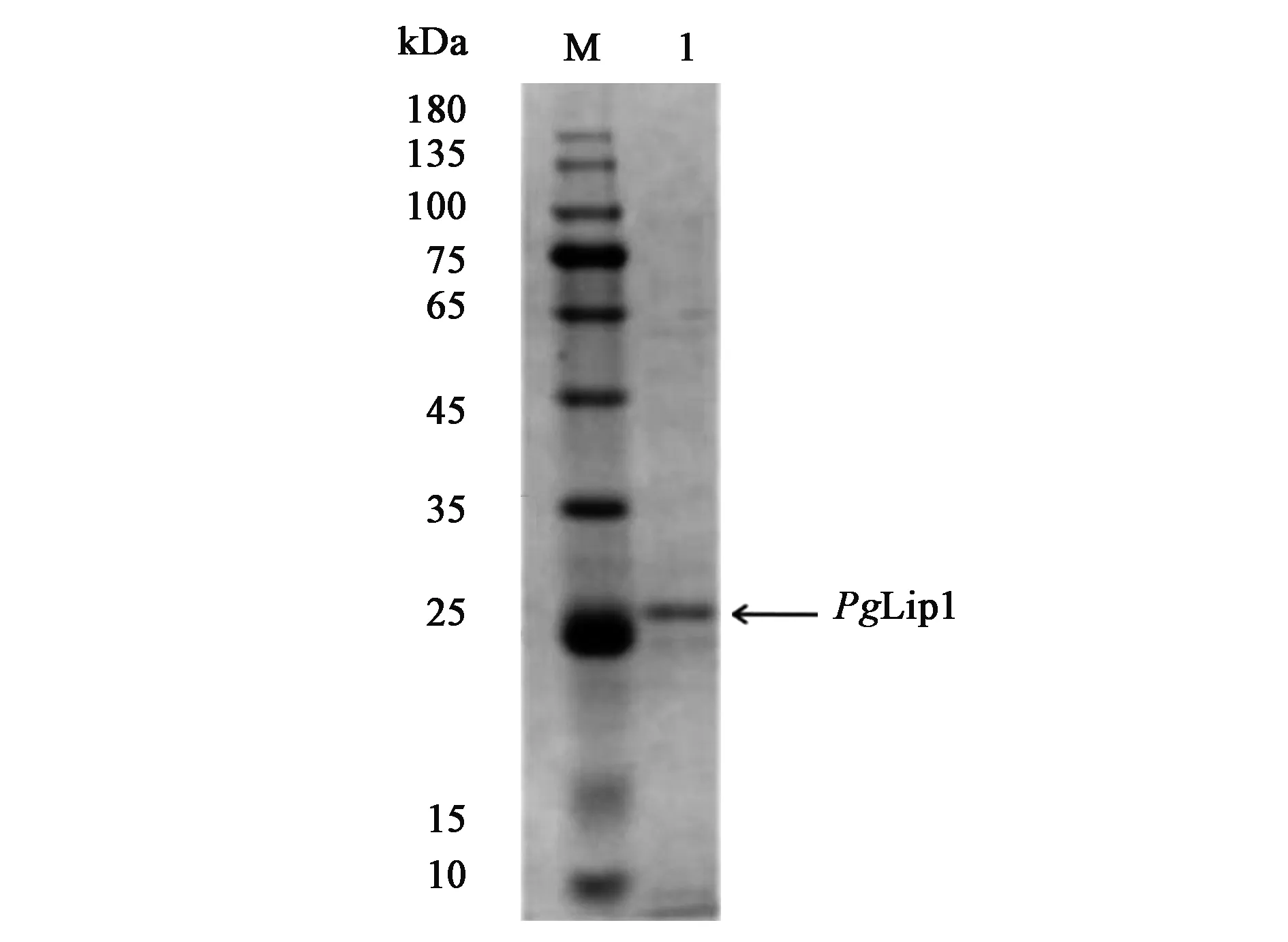
注:M—DNA分子量標準;1—純化PgLip1蛋白。
2.2 PgLip1的酶學性質
2.2.1PgLip1的底物特異性 由圖2可知,谷關假單胞菌來源的重組脂肪酶PgLip1對于具有不同長度脂肪鏈的pNP底物均具有一定活性,能催化本研究選擇的含2~16個不同長度脂肪鏈的對硝基苯酚酯降解。該酶對pNPB的活性最高,比活達到27.5 U·mg-1,而對pNPA、pNPC、pNPL、pNPM和pNPP的比活分別為25.3、13.5、4.4、3.1和1.6 U·mg-1。對pNPB底物的PgLip1脂肪酶相對活力設定為100%,對碳鏈長度為2(pNPA)和8(pNPC)的pNP底物的酶活依次緩慢下降,其相對酶活分別為91.8%和49.1%;對碳鏈長度分別為12(pNPL)、14(pNPM)和16(pNPP)的pNP底物酶活則快速下降,其相對酶活分別為15.8%、11.1%和5.8%。
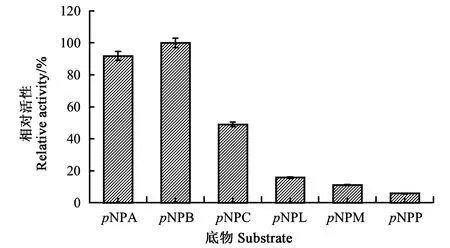
圖2 PgLip1對pNP底物的相對酶活
2.2.2PgLip1的穩定性 以pNPM為底物時,pH對PgLip1脂肪酶活性的影響結果見圖3,可見,在50 mmol·L-1pH為8.5的Tris-HCl緩沖液中,PgLip1的脂肪酶活性最高,其比活達到3.1 U·mg-1。當pH為8.0時,該酶的酶活為71.6%,而在pH為7.0時則迅速下降為4.0%。當pH為9.0時,該酶有84.4%的活性,而在pH為10.0僅剩余3.8%的活性。在pH穩定性方面,當pH為3.0~12時,PgLip1酶的相對活性至少保持在60%以上,說明該脂肪酶具有較寬的pH耐受性。但在pH 3.0以下,該酶的酶活幾乎完全喪失。
由圖3可以看出,以pNPM為底物時脂肪酶PgLip1在10 ℃時的活性最高,因此其催化水解的最適溫度為10 ℃,此時酶活為4.2 U·mg-1,相對酶活為100%;但酶在0 ℃仍然具有60.5%的酶活,說明該酶是一個低溫脂肪酶,能在低溫下較好地降解底物。當孵育溫度高于10 ℃時,該脂肪酶的酶活性開始逐漸下降。在20、30和40 ℃,其相對酶活分別為55.2%、42.1%和3.4%。將PgLip1脂肪酶在不同溫度分別孵育處理,發現該酶在40 ℃處理30 min仍然能保持93.0%相對酶活,繼續孵育至45 min其殘余酶活為72.1%。在50 ℃處理5 min后,殘余酶活為61.1%,繼續延長時間殘余酶活基本不變。60 ℃處理,酶活則迅速下降,30 min后酶活已基本完全喪失(7.1%)。
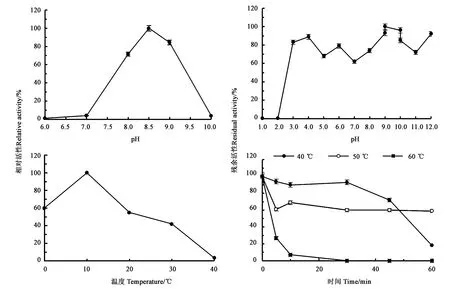
圖3 PgLip1的生化性質分析
2.2.3金屬離子對PgLip1活性的影響 以pNPM為底物時金屬離子對PgLip1的影響結果見表1,可見,在含Pb2+、Co2+、Ca2+、Cu2+和Na+的溶液中,PgLip1相對比較穩定,其活性分別為對照處理(酶活為2.9 U·mg-1,相對酶活100%)的102.8%、91.4%、97.5%、81.5%和78.7%。相反,Mg2+、Fe3+、K+、Cr3+、Zn2+、Ni+和Mn2+對脂肪酶PgLip1有抑制作用,在這些離子溶液中該酶的相對酶活分別為20.0%、48.7%、28.8%、37.5%、8.3%、10.9%和20.6%。
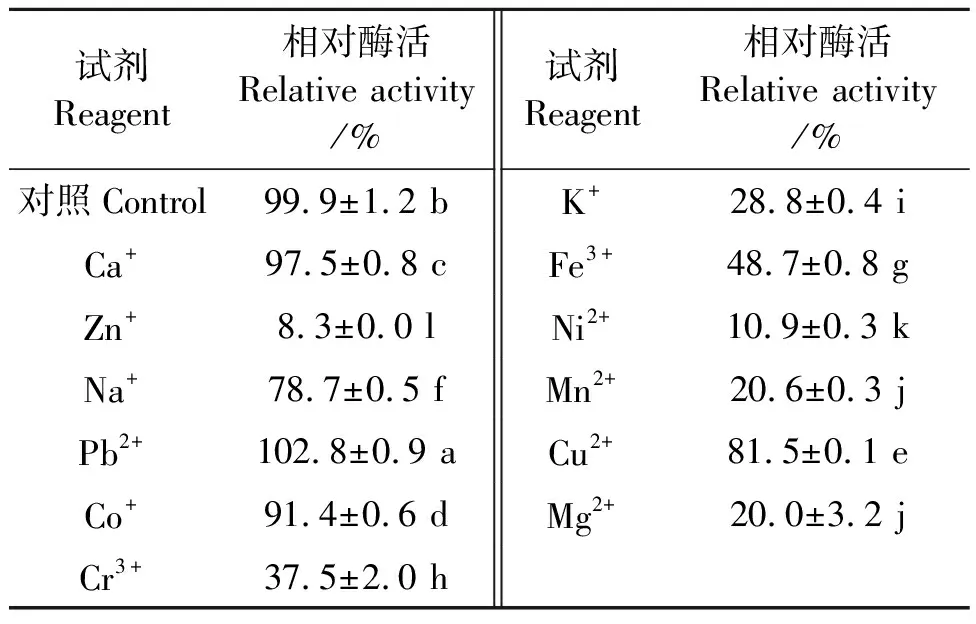
表1 金屬離子對PgLip1活性的影響
2.2.4表面活性劑及EDTA等變性劑對PgLip1活性的影響 以pNPM為底物時表面活性劑及EDTA等變性劑對PgLip1的影響結果見表2,可知,表面活性劑吐溫-20、吐溫-80和Triton X-100對PgLip1都有一定的促進作用。在終濃度1%的表面活性劑吐溫-20、吐溫-80和Triton X-100的溶液中,PgLip1的酶活分別為對照處理(酶活為3.3 U·mg-1,相對酶活為100%)的316.7%、339.7%和589.0%。而當溶液中含有5 mmol·L-1的金屬離子螯合劑EDTA、變性劑SDS和β-巰基乙醇時,PgLip1的相對酶活分別為184.6%、20.2%和102.4%。
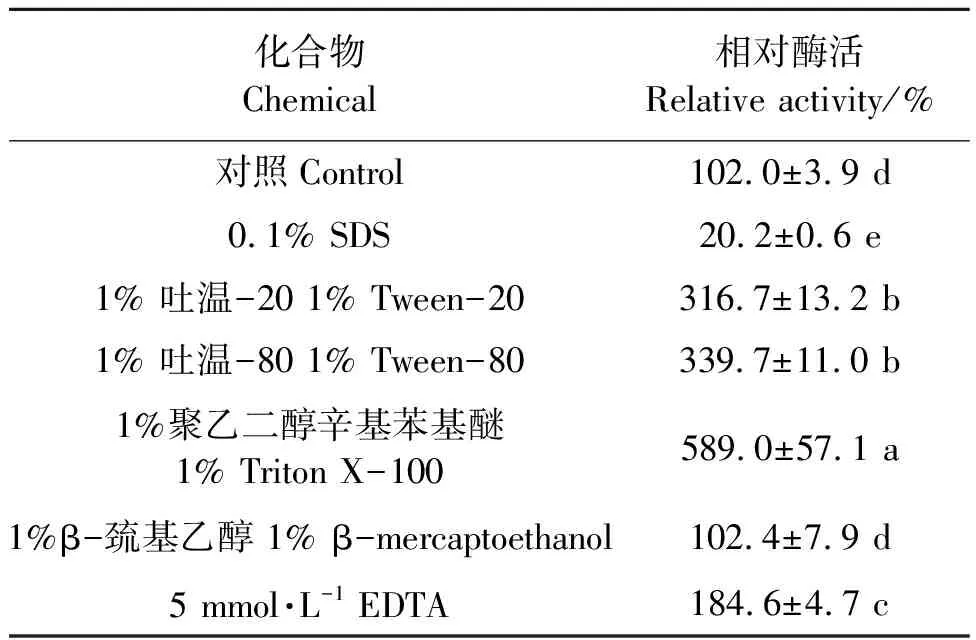
表2 表面活性劑、EDTA等變性劑對PgLip1活性的影響
2.2.5有機試劑對Pglip1活性的影響PgLip1在不同濃度不同有機試劑中的酶活結果見表3。未加有機溶劑的對照酶活為4.7 U·mg-1,相對酶活為100%。可以看出,PgLip1對50%的異丙醇和異戊醇有良好的穩定性。值得注意的是,在這兩種有機試劑中,其剩余酶活分別隨著有機試劑濃度的上升而增加,如在10%的異丙醇中酶活只有7.6%,但在30%的異丙醇中則為175.3%,而當異丙醇的濃度為50%時,酶活增加至240.3%。同樣,在甲醇和乙醇中,雖然PgLip1的酶活均小于對照處理,但該酶的酶活也隨著兩種醇濃度的增加而上升。在丙酮、乙腈和乙酸乙酯中,PgLip1的酶活均有下降,且酶活并沒有隨著有機溶劑濃度的增加而上升。
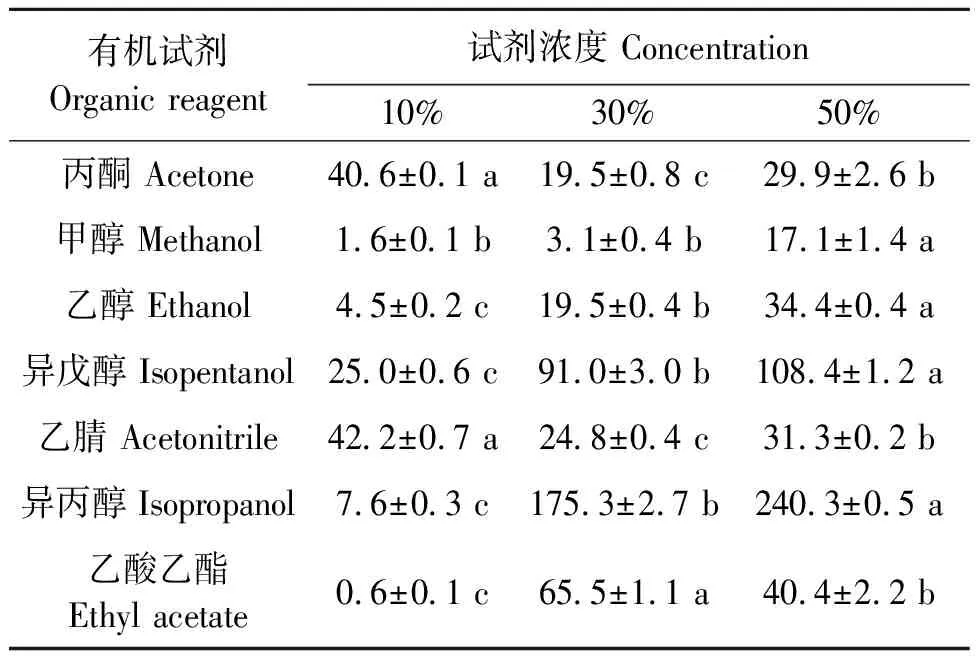
表3 不同濃度不同有機試劑對PgLip1活性的影響
3 討論
本研究從谷關假單胞菌中克隆和重組表達了脂肪酶PgLip1,其最適培養溫度為10 ℃。在0 ℃ 時,相對酶活為60%,當溫度大于10 ℃ 時酶活性急劇下降。劉滔滔等[22]報道的堿性脂肪酶的酶活在35 ℃急劇下降,45 ℃基本喪失;孫苗苗等[23]報道的假單胞菌脂肪酶也具有熱不穩定的性質,40 ℃酶活力快速失活,60 ℃酶活力基本喪失。Zhang等[24]篩選到一株Pseudomonassp.7323低溫脂肪酶,其最適作用溫度為30 ℃,在25 ℃以上顯示出熱不穩定性。PgLip1脂肪酶在40 ℃處理45 min能保持80%~100% 酶活力,50 ℃處理酶活力逐漸下降,60 ℃處理30 min酶活力喪失。可見,PgLip1脂肪酶具有熱敏感特性。當溫度較高時酶活性急劇下降,是低溫酶的一個重要特征;而與中高溫脂肪酶相比,低溫脂肪酶有較低的活化能,在低溫條件下具有高酶活[25],能維持低溫條件下的高催化效率。PgLip脂肪酶具有更低的最適溫度,同時在40、50 ℃仍具有相對較為耐熱的特點。這一特點可能與P.guguanensis是從溫泉中分離得到的有關[18],所以具有一定的耐熱性。
據報道芽孢桿菌來源的脂肪酶在pH 6.0條件下處理60 min剩余50%酶活力[26]。曲威等[27]報道銅綠假單胞菌S8脂肪酶的最適pH為7.0,在pH 6.0~8.0時相對穩定,pH 4.0時剩余酶活力為50%。余瓊[28]報道假單胞菌(Pseudomonassp.)YT34-8脂肪酶在pH 5.0~10.0穩定,但在pH 4.0和11.0條件下,剩余酶活力不足60%。本研究報道的PgLip1的最適pH為8.5,當pH低于8.0或高于9.0時,酶活性明顯降低。在pH 3.0~12.0時,酶相對活性仍然保持在60%以上;在pH 9.0~10.0 時,酶活力較為穩定;而當pH低于3.0的極酸性環境下酶活才出現穩定性的明顯下降。因此,穩定的pH耐受性使PgLip1脂肪酶具有更好的應用價值、更廣的應用范圍。
PgLip1脂肪酶對含2、4和8個碳原子脂肪鏈的對硝基苯酚酯底物具有較高的催化活性,催化短鏈酯的活性高于含12、14和16個碳原子長鏈脂肪酯的活性。雖然部分脂肪酶優先水解14碳以上的長鏈脂肪酸,但是低溫脂肪酶對含有3~10碳鏈甘油脂的催化效率更高,這可能與低溫脂肪酶的催化特性有關[29-31]。有文獻報道圓弧青霉(Penicilliumcyclopium)脂肪酶、PseudomonasfluorescensPf0-1來源脂肪酶對短鏈(8碳以下)對硝基苯酚脂具有較高的特異性[32],而也有報道[22]一株產堿假單胞菌堿性脂肪酶對8碳pNP底物具有較高活性,脂肪酶對短鏈酯的催化能力反映了脂肪酶豐富的生物多樣性。
金屬是影響酶活性的重要因素,對不同的酶,金屬和重金屬離子可能分別具有促進或抑制脂肪酶活力的效果[33]。本研究中,Cu2+、Co2+、Na+、Ca2+和Pb2+金屬離子處理后,PgLip1保持相對穩定性,酶活達到79%以上。在金屬離子中的穩定性,使PgLip1在工業領域可以具有良好的應用前景[34]。
脂肪酶PgLip1在濃度高達50% 的異丙醇和異戊醇有機溶劑中具有良好的穩定性,其剩余酶活分別為240.3%和108.4%。據報道JXJ-54脂肪酶在三氯甲烷和乙醇中,酶活力隨著有機溶劑體積分數的增大而增強,而在甲醇、乙醇、丙酮、異丙醇四種有機試劑中,酶的活性隨著有機試劑濃度的增加而減小,在50%的乙醇和丙酮中,剩余酶活僅有5.3%和15.3%[35]。從有機試劑對脂肪酶PgLip1活性的影響結果來看,不同濃度的有機試劑對PgLip1脂肪酶活性的影響不同,其原因可能與有機溶劑的lgP值有關[35]。脂肪酶的結構通常是整體親水,但其具有疏水的核心和親水的表面,其活性必須由具有一定極性的溶劑來維持,而有機溶劑則可能參與維持了脂肪酶核心的穩定性。當溶劑極性過低時,酶的結構最終會被破壞,導致活性降低甚至失活[36]。脂肪酶PgLip1在有機溶劑中呈現的穩定性,使其在基于非水相的催化反應領域中具有較大的應用潛力,比如食品、油脂、新型材料、精細化工、醫藥、化妝品和生物能源等[37]。
此外,PgLip1在吐溫-20、吐溫-80和Triton X-100等表面活性劑中都被激活,在Triton X-100中激活幅度甚至達到5.9倍。但相同濃度的表面活性劑,Triton X-100激活效果顯著優于吐溫-80和吐溫-20。劉滔滔等[22]報道的假單胞菌脂肪酶受到吐溫-20、吐溫-80和TritionX-100強烈的抑制,而Liu等[32]報道PseudomonasfluorescensPf0-1來源的脂肪酶在TritonX-100、吐溫-20、吐溫-40和吐溫-80中的相對酶活達到110%、170%、160%、150%。因此,PgLip1受表面活性劑的激活程度優于這些報道的脂肪酶。PgLip1受表面活性劑激活的原理在于表面活性劑具有雙親性,一端為親水基團,另一端則為疏水基團,它可以幫助維持酶的穩定性。Carrasco-López等[38]指出,非離子型表面活性劑在低濃度時可以與脂肪酶的疏水活性中心產生相互作用,幫助脂肪酶穩定在開放的構象,有利于底物進入活性中心以及產物的釋放,因此脂肪酶的活力得到提高。但對于陰離子表面活性劑SDS,其為常見的蛋白質變性劑,其分子上的硫酸基團與蛋白質表面的帶正電氨基酸可以緊密結合,而分子上的烷基則可以與蛋白質的疏水部分緊密結合,從而導致蛋白質發生變性[39]。
綜上所述,本研究從谷關假單胞菌中克隆得到一個新的低溫脂肪酶基因PgLip1,該酶具有嗜低溫特性、較好的耐溫性、寬泛的pH耐受性、對有機溶劑的耐受性以及受表面活性劑激活的特殊性質,這豐富了人們對脂肪酶生物多樣性的認識;同時,PgLip1還可能在飼料行業如水產飼料以及工業應用如洗滌劑、有機合成等領域存在著潛在的應用價值。

