ALPPS治療巨大原發性肝癌患者近遠期療效研究*
莫 娟,閆 文,徐紹強
原發性肝癌(PLC)起病隱匿、生長快速,大多數患者就診時腫瘤已為中晚期。在臨床上,直徑>10 cm的巨大PLC非常常見[1]。巨大PLC多并發有門靜脈內癌栓、肝內腫瘤播散、衛星結節,手術難度和危險性均較大,且多發于肝硬化的肝臟,迅速侵犯肝實質,導致肝功能衰竭的發生,患者總體預后較差[2]。近年來,隨著肝膽外科技術的發展,PLC大小和部位不再是限制手術切除的主要因素。有研究表明,術前行經肝動脈化療栓塞術(transcatheter hepatic arterial chemoembolization,TACE) 可提高巨大PLC患者的臨床療效[3]。 然而,對于一些晚期患者來說,正常肝臟組織被過多的破壞,手術中過多地切除正常肝組織,對于有肝硬變背景的患者容易發生肝功能衰竭[4]。聯合肝臟分隔和門靜脈結扎的二步肝切除術(associated liver partition and portal vein ligation for staged hepatectomy,ALPPS)技術的出現為巨塊型PLC患者的手術切除提供了新選擇。ALPPS通過選擇性結扎一側門靜脈主干來調整入肝血流,促進余肝實質(future liver remnant,FLR)再生,增加了手術切除腫瘤的機會[5]。本研究對比分析了單純巨大PLC切除術、TACE后手術切除和ALPPS三種治療方法治療巨大PLC患者近遠期療效的差異,旨在為臨床治療方法的選擇提供參考,現報道如下。
1 資料與方法
1.1 一般資料 2016年1月~2018年2月我院診治的巨大PLC患者98例,男性78例,女性20例;年齡43~76歲,平均年齡為(56.8±5.5)歲;腫瘤直徑為10~20 cm,平均為(14.4±1.4)cm。符合《中國常見惡性腫瘤診治規范》中原發性肝癌的診斷標準[6],腫瘤直徑≥10 cm,術前肝功能Child-Pugh分級為A級,術后組織病理學檢查證實為肝細胞癌(HCC),無肺、骨等遠處轉移。排除標準:(1)合并其他原發性腫瘤;(2)妊娠或哺乳期婦女;(3)在隨訪過程中因非PLC因素導致的死亡。將ALPPS治療的20例患者歸為A組,TACE治療后手術切除的38例患者歸為B組,行巨大PLC直接切除的40例患者歸為C組,三組一般資料比較,無統計學差異(P>0.05),具有可比性。所有患者給出知情同意書,本研究經我院醫學倫理委員會批準。
1.2 治療方法 在A組,采取腹腔鏡輔助下ALPPS治療。患者取仰臥位,全身麻醉,在上腹部行切口,置入腹腔鏡。第1步,結扎門靜脈右支,離斷肝實質。在靠近第一肝門Glisson 鞘內解剖門靜脈右支,夾閉,于鐮狀韌帶右側1.0 cm位置入路使用超聲刀斷肝,分離Ⅳb段肝動脈、切斷,分割肝組織,解剖肝左靜脈分支,止血,沖洗腹腔,置引流管。第2步,在第1步后7 d,再次手術,切除病灶。患者取平臥位,全身麻醉,行上腹部切口,逐層切開腹腔,經原位前入路,切除右側三葉,打開下腔靜脈和尾狀葉覆膜,分離短靜脈,暴露無血管區,分離殘留肝實質,離斷肝中靜脈,游離韌帶,檢查左肝外葉血供,沖洗腹腔,放置引流管;在B組,先行輔助性 TACE治療,即采用 Seldinger法穿刺股動脈,將導管沿股動脈插入腹腔動脈,進入肝動脈。造影明確病灶部位和供血狀態。將導管盡可能接近腫瘤供血動脈支,從動脈支內注入順鉑50~100 mg、5-氟尿嘧啶1000~2000 mg、阿霉素20~40 mg、絲裂霉素10~20 mg,以碘化油或/和明膠海綿栓塞。本組術前接受TACE治療1次者19例 ,2次者13例,3次者5例,4次者1例。在最后一次TACE術后行肝腫瘤切除術,間隔時間為1~3個月,平均為(1.9±0.2)個月。經肋緣下切口進腹,探查腫瘤部位、剝離肝臟粘連、探查肝內外轉移和肝硬化等情況。游離肝臟,采用Pringle法阻斷血流,每次阻斷時間為15~20 min。根據手術情況分2~4次阻斷,間隔時間為5 min。以鉗夾法或者用手術閉合分割器離斷肝臟,用血管縫線縫扎肝切面、止血。對伴有門靜脈癌栓者,則經肝切面門靜脈斷端將癌栓吸出,再用血管縫線連續縫合門靜脈;在C組,僅行肝腫瘤切除術,手術方法同B組。
1.3 肝再生評估 術后,行64排螺旋CT增強掃描,應用IQQA-Liver肝臟CT解讀分析系統進行肝臟三維重建,包括肝臟、腫瘤病灶、肝動脈系統、門靜脈系統和肝靜脈系統,測量全肝體積(total liver volume, TLV)、殘余肝臟體積(remnant liver volume, RLV)、術后3個月肝臟體積(future remnant liver volume, FRLV),計算肝增生體積和肝增生率。肝增生體積(regenerative volume,RV)= FRLV-RLV;肝增生率(regeneration rate,RR)= (FRLV- RLV)/RLV×100%。
1.4 肝功能指標檢測 使用全自動血生化分析儀測定血生化指標,常規檢測凝血功能指標。
1.5 術后隨訪 術后,每3個月通過門診復查血清指標和肝臟B超,每6個月復查腹部CT掃描和(或)MRI檢查,隨訪終點為術后2年或患者死亡,隨訪方法為門診復診或電話隨訪。疾病無進展生存是指受試者在手術至腫瘤惡化或死亡的時間;總生存指受試者在手術至隨訪終點(或死亡)的時間。
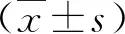
2 結果
2.1 三組術后肝再生情況比較 A組肝增生體積顯著大于B組和C組,肝增生率也顯著高于B組和C組(P<0.05,表1)。
2.2 三組肝功能指標比較 在治療后15 d,A組血清ALT水平顯著低于,而血清ALB水平顯著高于其他兩組(P<0.05,表2)。
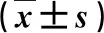
表1 三組術后肝再生情況比較
2.3 三組術后并發癥發生率比較 三組術后并發癥發生率比較,無顯著性差異(P>0.05,表3)。
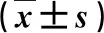
表2 三組肝功能指標比較

表3 三組術后并發癥發生率【n(%)】比較
2.4 三組術后生存率比較 A組2 a總生存率為70.0%,無進展生存率為55.0%,B組分別為55.3%和36.8%,C組分別為52.5%和42.5%,三組生存率比較,無顯著性差異(P>0.05,圖1、圖2)。

圖1 三組術后2a總生存曲線

圖2 三組術后2a無進展生存曲線
3 討論
手術切除巨大肝臟腫瘤是肝臟外科發展的重要標志之一。國內外多項研究表明[7],通過積極的手術切除可改善巨大PLC患者遠期療效,使得部分患者獲得長期生存。然而,由于巨大PLC占據空間較大,腫瘤對毗鄰臟器甚至對重要管道結構造成擠壓,再加上多數患者合并有肝硬化,手術難度大且風險高[8,9]。手術切除仍是治療巨大肝癌的首選方法。ALPPS是近年來較為新穎的一種手術方法,為肝膽外科領域的一次革命性的突破,通過兩次手術治療巨大肝癌,使患者第一期手術后的肝臟在短時間內得到迅速增長,使其在第二期手術時可安全地切除腫瘤,實現二期根治性切除,確保足夠的剩余肝臟體積,有效預防了肝衰竭的發生,確保手術安全和術后康復[10-12]。
肝臟作為體內重要代謝器官,再生潛能強大,受到手術切除等損傷性刺激后,殘余肝臟體積可迅速增大,促進肝功能的恢復[13,14]。研究發現,采用ALPPS 術式可使得患者剩余肝臟體積顯著增加,其肝臟增生時間約為9 d左右[15]。本研究中A組患者術后肝增生體積和肝增生率顯著高于B組或C組。同時,本研究結果顯示A組術后血清ALB水平顯著高于其他兩組。肝臟再生需富含肝臟再生因子的門靜脈血流供應,ALPPS手術通過選擇性結扎患側門靜脈,調整入肝血流,增加剩余肝臟門靜脈供血量,分隔了肝臟組織,促進術后剩余肝組織再生,同時在帶瘤一側肝臟組織缺乏相應的門靜脈血供,但仍然保留了一部分肝動脈血供,有效避免了急性肝衰竭的發生,為不可進行切除的PLC患者贏得了根治性手術的機會[16-20]。本研究對三組患者隨訪2年,結果顯示三組患者生存率比較無顯著性。有人研究發現 ALPPS可減少癌殘留而降低復發,提高巨大肝癌患者術后遠期療效[21],需要認真研究。
在選擇ALPPS術時,需預防術后并發癥的發生,(1)膽瘺預防:對于直徑超過0.5 mm的管道均需用血管縫線縫合,術后對肝創面行持續低負壓引流;(2)腫瘤轉移:盡量減少不必要的手術操作,避免過度游離肝臟;(3)組織粘連:盡量減少止血材料等的置入,于肝臟分隔面和第一肝門等部位噴涂透明質酸鈉凝膠,可預防術后組織粘連,術后盡早拔除引流管;(4)手術損傷:仔細操作,避免組織損傷。

