輕燒粉在氯化銨體系中的萃取實驗研究
吳丹,張琦,王玉琪,張文燕,武海虹,駱碧君,黃西平
(自然資源部天津海水淡化與綜合利用研究所,天津 300192)
近年來,隨著我國純堿產業(yè)的發(fā)展,其副產品NH4Cl 由于在化肥方面的應用受到限制而造成大量積壓,已成為純堿工業(yè)的瓶頸,亟需找到合適的利用方式[1]。如果將NH4Cl 分解成經濟價值較高的NH3和HCl,NH3可在純堿工業(yè)中循環(huán)利用,HCl也可以在有機氯化工等諸多領域得到應用。因此,NH4Cl分解制NH3和HCl是解決純堿工業(yè)瓶頸問題的一個很好的途徑[2-3]。
NH4Cl受熱可分解成NH3和HCl,但同時有大量的NH4Cl升華,而且生成的NH3和HCl 難以分離,極易重新生成很小的NH4Cl 顆粒。為了得到NH4Cl 的分解產物NH3和HCl,一種可行的方法是在反應物NH4Cl中加入可重復使用的酸性或堿性物質,加熱后使NH3先釋放出來,然后在更高的溫度下使HCl釋放出來[4]。
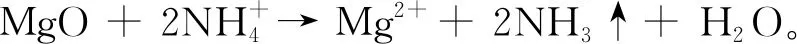

1 實驗部分
1.1 試劑與儀器
輕燒粉(MgO),活性(檸檬酸法)1 min 50 s,工業(yè)級;氯化銨(NH4Cl)、鉻黑T、EDTA、氨水、無水乙醇均為分析純;蒸餾水。
METTLER PL403 精密電子天平;2NCLT10000ML智能恒溫電加熱磁力攪拌器;Rigaku D/max 2500v/pc X-射線自動衍射儀;Philips XL30ESEM場發(fā)射掃描電鏡。
1.2 實驗方法
將調漿后的MgO 和一定濃度的NH4Cl溶液按照一定摩爾比混勻,注入四口燒瓶中,設定溫度和攪拌速度并開始計時。在 MgO 萃取過程中,定時從四口燒瓶中取樣并立即抽濾,測定濾液中Mg2+濃度變化,用來觀測MgO的萃取率。四口燒瓶中產生的NH3用稀硫酸溶液進行吸收。
1.3 分析方法
采用化學滴定法分析MgO的萃取率;采用X-射線自動衍射儀(XRD,Cu Ka 輻射)表征過程中固相組分的晶型;采用場發(fā)射掃描電鏡(SEM)表征過程中固相組分的形貌。
2 結果與討論
2.1 Mg2+初始濃度對MgO萃取率的影響
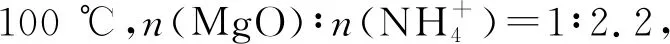
由圖1可知,隨著Mg2+初始濃度的升高,MgO的萃取率逐漸降低。Mg2+初始濃度1 mol/L時MgO的萃取率最高。選取Mg2+初始濃度為1 mol/L開展實驗。
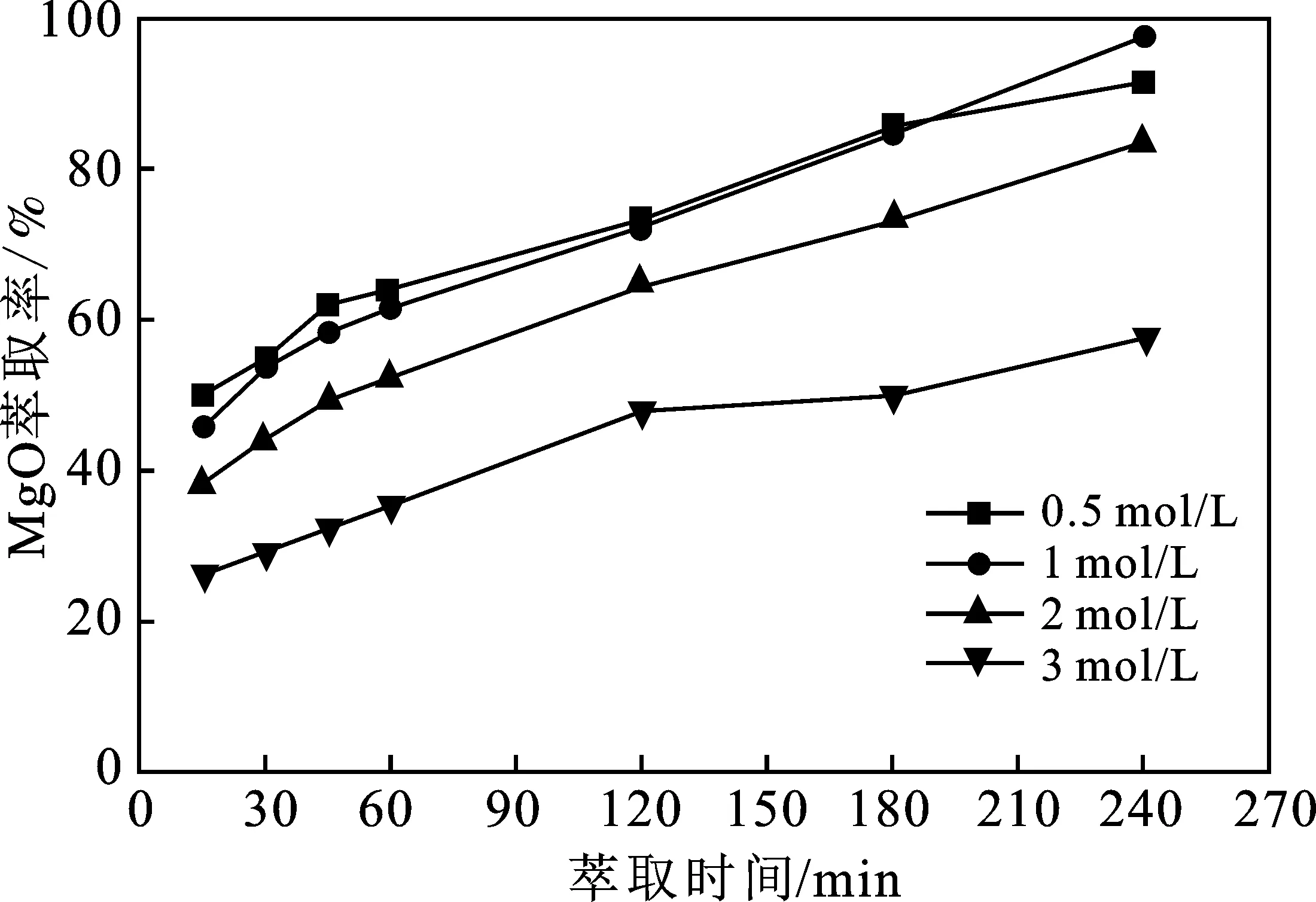
圖1 Mg2+初始濃度對MgO萃取率的影響Fig.1 Effect of Mg2+ initial concentration on MgO extraction rate
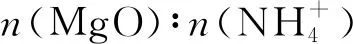
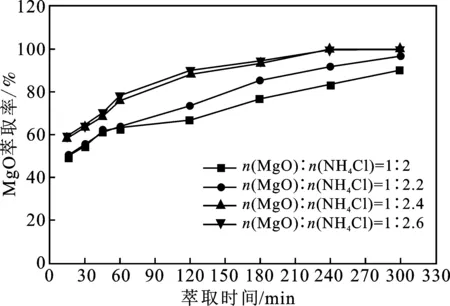
圖對MgO萃取率的影響 MgO extraction rate
2.3 溫度對MgO萃取率的影響

由圖3可知,70~90 ℃萃取,MgO萃取率隨著時間的增加升高幅度較小。當萃取溫度升高至100 ℃,MgO萃取率隨時間的增加升高幅度大幅增加,反應120 min后MgO萃取率接近90%。當萃取溫度繼續(xù)升高至110 ℃,45 min后MgO萃取率即大于80%,僅需90 min MgO萃取率即趨于平衡。隨著反應溫度的升高,NH3在溶液中的溶解度隨之降低,有利于NH3的逸出,反應體系中有更多的MgO轉化為Mg2+溶解于溶液中。選取溫度為110 ℃開展實驗。反應120 min后,MgO萃取率大于98%時,故選取反應時間2 h開展實驗。
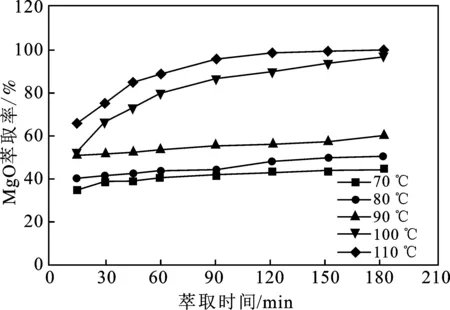
圖3 溫度對MgO萃取率的影響Fig.3 Effect of temperature on MgO extraction rate
2.4 機理研究
由圖4a可知,MgO-NH4Cl-H2O 體系中,反應15 min取樣,MgO已經開始轉化成Mg(OH)2,但是轉化率還很低。由圖4b可知,在反應30 min時已經有接近50%的MgO轉化為Mg(OH)2。由圖4c可知,反應45 min時80%的MgO已經轉化為Mg(OH)2, 且Mg(OH)2衍射峰強度逐漸增強。由圖4d可知,當反應60 min時,大部分MgO已經轉化為Mg(OH)2,僅有一小部分沒有完全轉化。Mg(OH)2衍射峰的位置與標準PDF卡(07-0239)上的Mg(OH)2結構完全一致,屬六方晶系。
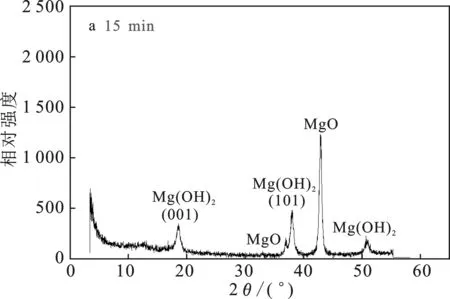
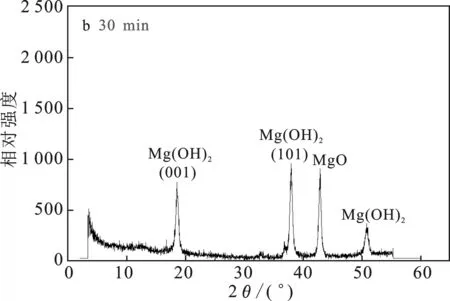
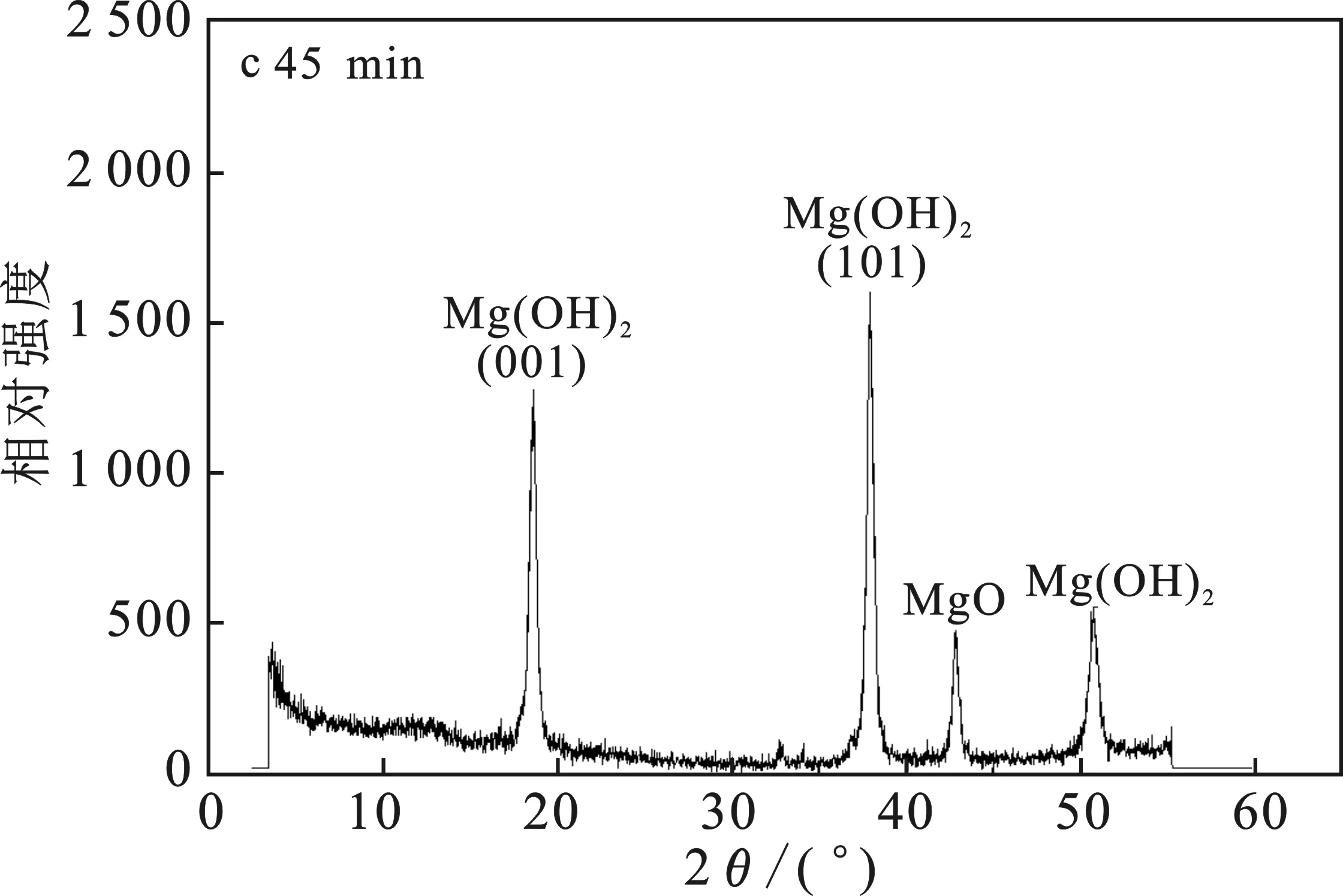
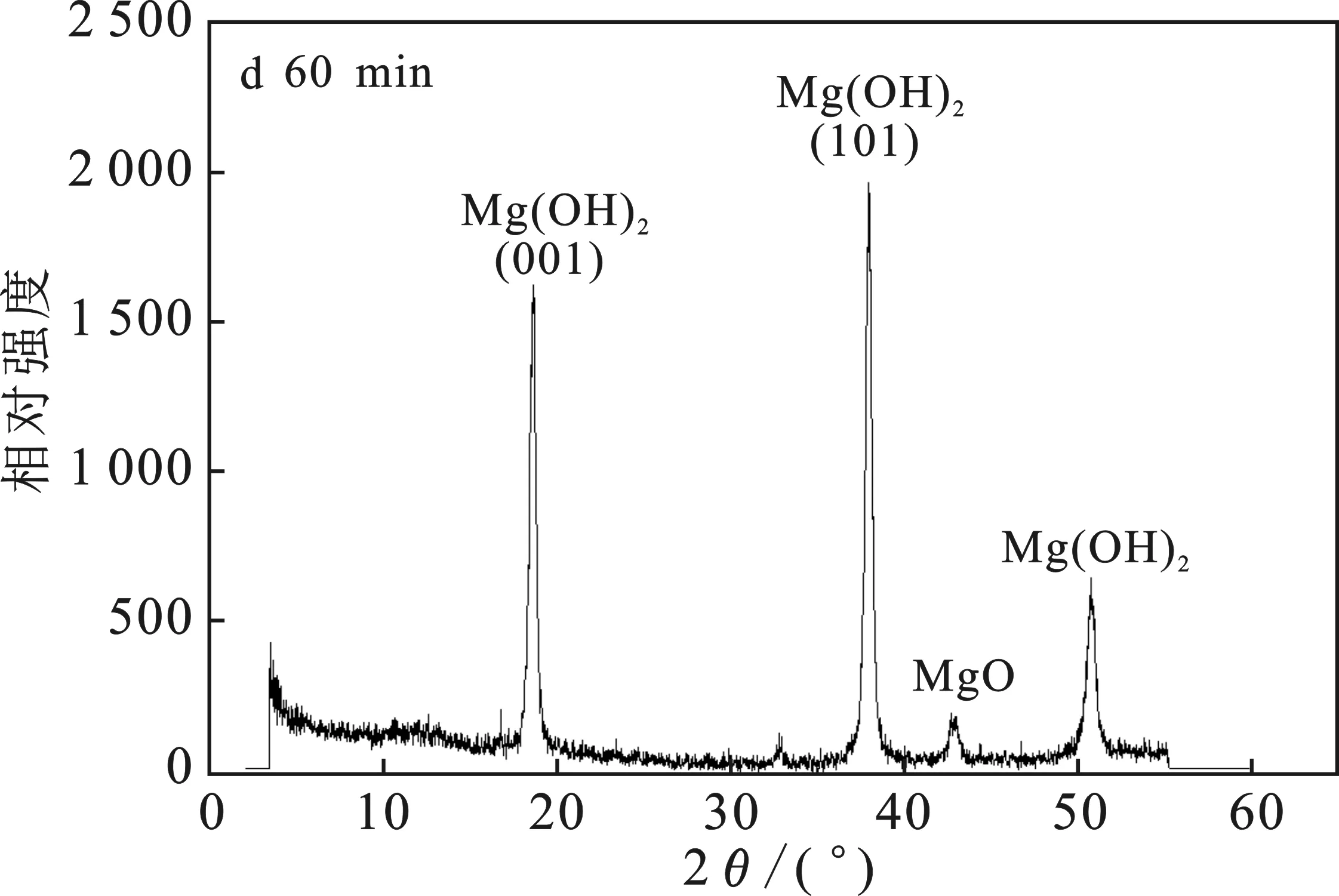
圖4 不同時間點的固相XRD譜圖Fig.4 XRD patterns of the solid phase at different time
原料MgO和60 min時固相的電鏡照片見圖5。
由圖5a可知,原料MgO為大小不均的塊狀物,而60 min固相為六方片狀產物,進一步驗證了MgO在NH4Cl體系中的萃取過程分兩步進行,第1步是MgO水化成Mg(OH)2;第2步是Mg(OH)2的溶解。這與文獻[7]的結論一致。


圖5 原料MgO和60 min固相的電鏡照片Fig.5 SEM of MgO raw material and 60 min solid phase
銨鹽在MgO-H2O懸浮體系中形成了緩沖體系,能夠顯著加速MgO溶解和Mg(OH)2沉淀的形成。銨鹽溶液環(huán)境下,MgO在水化過程中未與銨鹽形成中間產物,其過程符合“溶解-沉淀-溶解”機理。整個過程的反應方程式可表示為[7-8]:

Mg2+(aq) +2OH-(aq)
Mg2+(aq) + 2OH-(aq) → Mg(OH)2(s)

從反應過程可知,MgO在銨鹽體系中先快速水化為Mg(OH)2,再與銨鹽反應轉化成Mg2+,產生大量NH4OH,隨著溫度的升高和反應時間的延長,大量NH3溢出,促進了MgO的水化和Mg(OH)2的溶解。
3 結論與展望
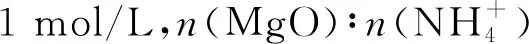
(2)MgO在NH4Cl體系中的萃取過程分兩步,第1步是MgO水化成Mg(OH)2;第2步是Mg(OH)2溶解轉變?yōu)镸g2+,其過程符合“溶解-沉淀-溶解”機理。
(3)對于不同的含鎂原料,用氨作為沉淀鎂離子的堿性物時有兩大類工藝流程,以可溶性鎂鹽為原料時可以采用開放式流程,以活性MgO為原料時則可以采用封閉式流程[9]。活性MgO可溶解于銨鹽溶液,形成富含鎂離子的溶液,釋放出氨氣。鎂鹽溶液除去水不溶物和帶色離子后,再與蒸出的氨氣反應生成Mg(OH)2沉淀。Mg(OH)2可作為制備高品質MgO的前驅體,母液返回蒸氨系統(tǒng)繼續(xù)作為溶劑進行蒸氨反應。整個反應過程中銨鹽溶液與氨氣全部循環(huán),沒有廢銨渣產生,適宜于規(guī)模性連續(xù)生產。
(4)MgO在NH4Cl體系中萃取制備Mg(OH)2為低品位鎂礦應用提供了一條新思路[10]。充分利用低品位鎂礦制備高附加值的鎂系物,有助于降低生產成本,完善海水化學資源產業(yè)鏈條,改變鎂系低端初級型產品大量低價出口、高端高附加值產品大量進口的不利局面,提升企業(yè)盈利與國際市場競爭能力,助力我國化學資源綜合利用產業(yè)發(fā)展。

