射頻消融術聯合阿帕替尼治療肝細胞癌復發患者的療效及預后因素研究*
高福洋 沈太偉 張宏偉 米 超 季世強 張化玉 許新征
河北省承德市中心醫院(承德醫學院第二臨床學院)普外科 (河北 承德, 067000)
肝細胞癌(HCC)在全球惡性腫瘤患病率中位居第6位,每年新發HCC患者高達46.6萬。患者行根治性切除術治療后,5年內復發率仍高達70%,預后欠佳[1]。現階段臨床針對復發性HCC已有多種治療策略,包括再次手術切除、肝移植、射頻消融術(RFA)、藥物治療等,其中肝移植、手術切除是治療該病的根治性方案,但部分患者因多發性腫瘤、肝臟儲備能力低下、肝硬化等因素,不宜再行手術治療。因此,大部分患者選擇RFA與藥物治療。RFA可以利用熱能使局部組織達到高溫,將癌細胞殺死,且不會致周圍正常組織受損,但對于腫瘤形態不規則或體積過大的HCC患者而言,消融范圍比較局限,可能致治療效果不理想。阿帕替尼是抗血管生成藥物,可對血管生成進行調節,減少腫瘤供血促進癌細胞凋亡,抑制腫瘤的侵襲[2]。基于此,本研究采用RFA聯合阿帕替尼治療復發性HCC患者,分析該方案對患者預后的影響,報告如下。
1 資料與方法
1.1 一般資料 將本院2017年9月至2019年5月收治的復發性HCC患者98例,根據隨機數字表法分為兩組各49例。觀察組男26例,女23例;平均年齡(60.58±10.64)歲;Child-Pugh分級:A級25例,B級24例;腫瘤平均直徑(4.23±1.31)cm;腫瘤部位:左肝上12例,右肝上32例,雙側肝上5例;BCLC分期:0期6例,A期33例,B期10例。對照組男29例,女20例;平均年齡(63.57±8.35)歲;Child-Pugh分級:A級22例,B級27例;腫瘤平均直徑(4.34±1.57)cm;腫瘤部位:左肝上14例,右肝上27例,雙側肝上8例;BCLC分期:0期4例,A期31例,B期14例。兩組患者在一 般資料方面比較,差異均無顯著性意義,均P>0.05,具有可比性。
1.2 納入、排除標準 納入標準:①診斷符合中華人民共和國衛生和計劃生育委員會醫政醫管局制定的原發性肝癌診斷規范中的標準[3],確診為肝癌術后復發者,未見遠處轉移;②癌結節數量≤3個;③Child-Pugh分級為A、B級;④無法行外科手術治療;⑤精神狀態、認知功能正常;⑥簽訂知情同意書。排除標準:①同時患有其他原發性腫瘤者;②頑固性腹水者;③腎、心等主要臟器嚴重損害者;④近1個月內使用過對凝血功能有影響的藥物者;⑤治療前消化道出血者;⑥病例資料不全者。
1.3 治療方法 對照組患者單純行RFA治療,儀器為上海涵飛醫療GY-8100射頻消融治療儀。治療前患者需進行常規的肝腎功能、血常規、心功能、凝血功能等檢查,利用腹部彩超確定肝臟腫瘤的數量、位置以及大小,治療前8 h禁食,取100 mg鹽酸哌替啶注射液(國藥準字H63020022,青海制藥廠有限公司,規格:1 ml∶50 mg)肌肉注射,術前根據情況給予維生素、保肝等處理。患者選擇仰臥位,常規消毒、鋪巾,行局部麻醉,經手術刀于進針點部位切開,長度約0.3 cm,在CT或彩超引導下,插入射頻消融針,使其達腫瘤部位,若腫瘤直徑≤3 cm,則需將針尖穿刺至病灶對側緣0.5~1.0 cm,如果病灶直徑在3~5 cm間,則需將針尖放置在病灶中心附近。必須確保進針點與進針路徑的準確性,避免因多次穿刺促進腫瘤播散或引起組織損傷。待穿刺成功,將冷循環系統啟動,輸出功率調整為100 w左右,根據病灶大小確定消融時間,通常選擇單針單點消融,首先深部消融,然后淺部消融,若病灶邊緣不規則,或病灶直徑為3~5 cm,則選擇一針多點模式,重疊進行消融。在RFA治療完畢前,再次接受CT或超聲檢查,確保消融完全,邊界超過病灶邊緣的0.5~1.0 cm,待治療完畢,則將冷循環系統關閉,實施針道消融,最終用紗布覆蓋穿刺點并固定。術后常規進行心電監護,臥床休息約6 h,行抗感染、保肝等治療。術后鼓勵患者盡早下床活動,飲食主要為高纖維、高蛋白食物。觀察組患者采用RFA聯合阿帕替尼治療。在RFA治療前2周觀察組患者口服阿帕替尼(國藥準字H20140103,江蘇恒瑞醫藥股份有限公司,規格:0.25 g/片),以500 mg作為起始劑量,1次/d,餐后30 min服用,在RFA前2 d停藥,在RFA治療后3~7 d,患者肝功能為A、B級,未見嚴重并發癥,則再次口服阿帕替尼,劑量、方法同前。
1.4 觀察指標
1.4.1 療效評估 在首次消融后1個月,評估患者的短期療效。療效評估標準[3]。完全緩解:瘤體完全消失;部分緩解:瘤體至少比原體積縮小50%;穩定:瘤體縮小不足原體積50%或增加不足25%;進展:瘤體增加>原體積25%。總緩解率=(完全緩解+部分緩解)/總例數×100%。
1.4.2 血清指標檢測 分別在治療前、首次消融后1個月檢測患者血清血管內皮生長因子(VEGF)、E-鈣黏蛋白(EC)、基質金屬蛋白酶(MMP)以及血清總膽紅素(TBil)、丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)水平。采集3 ml空腹靜脈血,離心20 min,轉速3 000r/min,分離血清,存放-80℃冰箱待測。經酶聯免疫吸附法(試劑盒由上海生工生物工程股份有限公司提供)測定血清VEGF、EC、MMP、TBil、ALT、AST水平。
1.4.3 不良事件發生情況 記錄兩組患者消融綜合征、血象改變及胃腸道反應發生情況。
1.4.4 預后評估 隨訪18個月,分析患者的生存、死亡率。
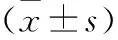
2 結果
2.1 兩組患者臨床療效 見表1。

表1 兩組患者臨床療效比較 [例(%)]
2.2 兩組患者治療前后血清VEGF、EC、MMP水平檢測結果見表2。

表2 兩組患者治療前后3項指標結果比較
2.3 兩組患者治療前后肝功能檢測結果 見表3。

表3 兩組患者治療前后肝功能檢測結果比較
2.4 兩組患者預后情況 隨訪18個月觀察組患者的總生存率為85.71%(42/49),死亡率為14.29%(7/49),對照組則分別為67.35%(33/49),32.65%(16/49)。兩組患者總生存率、死亡率比較,差異均有顯著性意義(P<0.05)。
2.5 兩組患者不良事件發生情況 觀察組有10(20.41%)例患者發生不良事件,其中消融綜合征4例,血液不良反應3例,胃腸道反應3例;對照組有8(16.33%)例患者發生不良事件,消融綜合征3例,血液不良反應2例,胃腸道反應3例。兩組患者不良事件發生率比較,差異無顯著性意義(χ2=0.272,P=0.602)。
2.6 影響復發性HCC患者預后的單因素分析 見表4。

表4 影響患者預后的單因素分析
2.7 影響患者預后因素的COX多因素分析 經COX多因素分析模型對相關變量行量化賦值,以門靜脈側支循環、使用阿帕替尼為自變量X,以復發性HCC患者預后為因變量Y(生存=0,死亡=1),結果提示,門靜脈側支循環與使用阿帕替尼是預后的影響因素(P<0.05),見表5。

表5 影響患者預后的COX多因素分析
3 討論
肝癌術后復發與多種因素有關,如腫瘤浸潤程度、腫瘤大小、手術方式、手術切緣等,若未能及時治療,隨著病情進展,可導致病灶進一步擴大,增加死亡率。目前,RFA在復發性HCC治療中應用越來越廣泛,其具有方便、創傷小、安全性高等特點,在復發、多發性肝癌中均適用[4]。但也有研究認為,即便肝癌患者經RFA干預后,病灶轉移微環境仍未能完全改善,再次復發風險仍較高[5]。鑒于此,臨床主張在RFA治療基礎上給予靶向藥物治療,提升療效。有學者認為,惡性腫瘤的轉移、復發與血管生成密切相關,使用抗血管生成藥物,可能對提高臨床療效有益,阿帕替尼作為新型抗血管生成藥,在腫瘤治療中也有較多應用,它在濃度較低的情況下便能對癌細胞進行抑制[6]。
VEGF是一種促血管新生因子,對血管內皮功能有調節作用,能提升血管通透性[7]。MMP在肝癌侵襲、轉移中有重要作用,能促進細胞外基質多個成分降解,增加癌細胞轉移風險[8]。EC能調節細胞遷移以及組織分化過程,一旦其表達下調,則可致細胞黏附強度下降,提升其活動性,促進腫瘤侵襲、轉移[9]。TBil、ALT、AST是常用的評估肝功能的指標,復發性HCC患者因癌細胞對組織的侵害,導致肝功能下降[10]。本研究發現應用RFA聯合阿帕替尼,能進一步抑制血管因子生成與癌細胞分化,改善患者肝功能。分析原因可能一方面RFA用物理方法將癌細胞殺滅,使癌細胞凝固壞死,而且具備微創特征,不會對肝功能產生太多影響[11];另一方面,阿帕替尼對腫瘤血管生成有較強抑制作用,可下調血清VEGF水平,調節抗凋亡基因與促凋亡基因,抑制腫瘤細胞增殖促使癌細胞凋亡[12]。曾廣源等[13]也發現,阿帕替尼能抑制肝癌細胞遷移、增殖能力,為本次結論提供了支持。兩種治療方案的近期總緩解率未見差異,表明RFA聯合阿帕替尼方案未能提升近期療效,這可能是由于觀察時間較短,尚未體現出聯合治療的優勢。結果還提示在RFA基礎上加用阿帕替尼治療的安全性較高。郎豐平等[14]研究結果也提示,阿帕替尼的耐受性良好,進一步證實該藥安全、可靠。
既往雖然有關于阿帕替尼治療肝癌的報道,但大多將肝動脈化療栓塞術與其聯用,而有研究認為肝動脈栓塞可能致肝功能損害加重[15]。本研究創新點在于將RFA與阿帕替尼聯用,發現該方案能更有效地改善患者肝功能,中期療效也比較理想。本研究最終證實,門靜脈側支循環與使用阿帕替尼是預后的影響因素。門靜脈側支循環會增加死亡風險,原因在于其能引起肝硬化門脈高壓,使靜脈回流受阻,易誘發肝衰竭、消化道出血等嚴重并發癥,導致死亡[16]。阿帕替尼則是改善預后的保護性因素,其能通過調節血管生成因子,抑制癌細胞生長,促進其壞死、凋亡。因此,臨床在復發性HCC治療中,要綜合考慮上述因素,積極給予對癥處理,改善患者預后。
但該方案的近期療效未體現出明顯優勢,研究樣本量偏少,且在分析預后影響因素時,納入的變量較少,未來還需增加樣本量,并納入更多變量對此進行分析。

