硫化氫化學反應循環(huán)制氫工藝的流程模擬
李杉杉,趙文星,王 輝,常麗萍,任秀蓉
(1. 太原理工大學 煤科學與技術教育部和山西省重點實驗室,山西 太原 030024;2. 薩斯喀徹溫大學 化學和生物工程系,薩斯卡通 S7N 5A9)
作為世界能源供應的主體,煤炭、石油等化石能源的過度開采利用是溫室效應和環(huán)境污染問題的主要誘因。 氫氣因其儲量豐富、清潔、燃燒熱值高、儲存方式與利用形式多樣等優(yōu)點,被認為是一種理想的能源載體,氫能的開發(fā)與利用已經(jīng)成為新一輪世界能源技術變革的關注熱點[1-3]。 現(xiàn)有的制氫技術以化石能源制氫為主, 但不可避免溫室氣體CO2地排放。 從可持續(xù)發(fā)展和環(huán)保的角度出發(fā),王輝[4]提出硫化氫(H2S)化學反應循環(huán)制氫技術路線,包含以下四步反應:①H2S氧化反應:H2S + H2SO4→2H2O+SO2+S;②S氧化反應:S + O2→SO2;③Bunsen反應:2SO2+ 2I2+ 4H2O→4HI + 2H2SO4;④氫碘酸分解反應:4HI→2H2+2I2;總反應為:H2S+2H2O+O2→2H2+ H2SO4。 硫化氫化學反應循環(huán)通過四個互相關聯(lián)的熱化學反應在脫除硫化氫和SO2的同時制備氫氣和H2SO4,實現(xiàn)了硫化氫資源化利用。 整個循環(huán)如果與核能或太陽能等清潔能源耦合,可以實現(xiàn)整個過程的無碳排放。
Bunsen反應是硫化氫化學反應循環(huán)中銜接硫化氫氧化與氫碘酸分解制氫的關鍵步驟,但近40年來研究者們對Bunsen反應進行了深入的研究,仍無法徹底解決反應物過量、反應溫度高、產(chǎn)物氫碘酸硫酸混酸分離困難、副反應、碘蒸氣揮發(fā)再沉積及嚴重腐蝕等技術難題,針對以上難題,王輝[5]提出將碘(I2)溶解在甲苯中以提供流動態(tài)的碘至Bunsen反應,使反應可在室溫或常溫下進行。
在進一步工業(yè)化應用之前,硫化氫化學反應循環(huán)制氫工藝流程的設計和模擬是必要的。 該工藝流程的模擬研究可以避免實際的工藝操作耗費大量時間和資金。 高路等[6]在Aspen Plus輔助下進行了10 L/h硫碘循環(huán)的物料平衡研究, 優(yōu)化了關鍵物流的供料速率。 本文借助Aspen Plus對引入以I2-甲苯為碘源的Bunsen反應的硫化氫化學反應循環(huán)進行設計模擬, 建立硫化氫化學反應循環(huán)模擬流程,計算系統(tǒng)的質(zhì)量平衡,對S氧化單元進行熱量回收,并通過靈敏度分析考察壓力對H2SO4精餾提濃、 溫度和壓力對HI分解反應的影響,為硫化氫化學反應制氫循環(huán)的閉合和放大提供參考。
1 單元操作模型和物性方法的選擇
1.1 單元操作模型的選擇
硫化氫化學反應循環(huán)主要包含反應、 精餾、混合、換熱、壓力變換、分離等工藝過程,可以利用Aspen Plus軟件中的RSTOIC、RGIBBS、RADFRAC、MIXER、HEATER、PUMP、SEP等單元操作模型模擬循環(huán)中的工藝過程。 本文中選用的單元操作模型如表1所示。
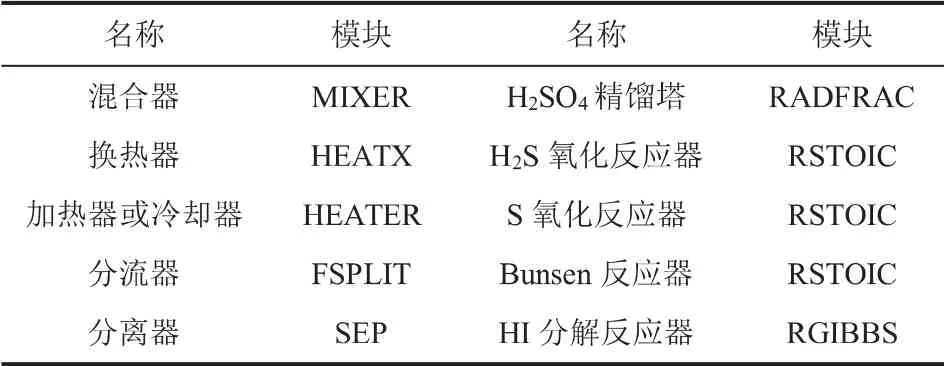
表1 單元操作模型
1.2 物性方法的選擇
在模擬計算中運用的方法和模型的集合被稱為物性方法[7],可靠的模擬依賴于正確的物性方法和可靠的物性參數(shù)[8]。 Aspen Plus提供了多種物性方法, 可以計算熱力學性質(zhì)和傳遞性質(zhì)。 其中,ELECNRTL是基于NRTL活度系數(shù)模型的電解質(zhì)物性方法,能夠處理任何濃度下的混合溶劑系統(tǒng)[8],是最通用的電解質(zhì)物性方法。 NRTL方法能處理任何極性和非極性組分的混合物,甚至是強非理想性混合物,也可用于描述VLE和LLE應用中,適用于中低壓(最大壓力1 MPa)范圍,適用亨利定律處理超臨界組分,不適用于電解質(zhì)體系[8]。 硫化氫化學反應循環(huán)是極性非理想體系,根據(jù)各流程段的工藝操作和物系,選取適合各個流程段的物性方法:H2S氧化反應和Bunsen反應與硫酸精餾提濃采用ELECNRTL電解質(zhì)方法[9];HI分解選用NRTL方法。
2 流程模擬
硫化氫化學反應循環(huán)流程可以分為三個部分:H2S氧化、Bunsen反應與硫酸精餾提濃和HI分解。
2.1 H2S氧化反應模擬
硫化氫化學反應循環(huán)的第一部分包括H2S被濃硫酸氧化生成S和SO2,S繼續(xù)燃燒氧化生成SO2。參考王輝[4,10-12]和王珺煒等[13]對H2S氧化反應的研究,H2S氧化反應模擬的壓力設定為0.1 MPa, 溫度設定為120 ℃,使用化學計量反應器RSTOIC1。
H2S氧化反應模擬流程如圖1所示。 流股1是w=96%的硫酸,流股2是H2S產(chǎn)品氣,兩股物流混合形成流股3,經(jīng)E101換熱進入H2S氧化反應器(RSTOIC1),充分反應得到單質(zhì)S(流股6)、SO2(流股7)和w= 79%的硫酸(流股8)。空氣(AIR)經(jīng)過空氣分離器(SEP2)之后,N2作為產(chǎn)品氣回收利用,單質(zhì)S(流股6)在S氧化反應器(RSTOIC2)中被O2氧化生成SO2(流股10),之后在換熱器(HEATX)中與4.0 MPa、104 ℃的軟水換熱,與流股7混合形成流股14,作為下一步Bunsen反應的SO2原料氣。w= 79%的硫酸(流股8)進入精餾塔(T101)進行精餾提濃。
2.2 Bunsen反應與硫酸精餾提濃模擬
Bunsen反應主要由反應器和分離器組成,溶于甲苯的I2與SO2、H2O在Bunsen反應器中發(fā)生反應,生成氫碘酸和硫酸并分層為有機相和水相,經(jīng)分離得到HI/H2SO4混酸, 混酸分離后,H2SO4進入精餾提濃系統(tǒng),HI進入HI分解階段。參考劉廣義[14]對Bunsen反應熱力學平衡的研究,Bunsen反應模擬的壓力設定為0.1 MPa,溫度設定為25 ℃。
如圖2所示, 在化學計量反應器RSTOIC3進行Bunsen反應,硫酸的精餾提濃在精餾塔(T301)中進行。 SO2產(chǎn)品氣(流股14)、來自H2S氧化系統(tǒng)硫酸提濃的水(流股11)、額外補充的水(流股27)、I2-甲苯溶液 (流股24) 經(jīng)混合換熱后進入Bunsen反應器(RSTOIC3)進行Bunsen反應,反應產(chǎn)物經(jīng)SEP3分離后,I2/甲苯混合物(流股21)可返回混合器(MIX3)繼續(xù)參與Bunsen反應,HI/H2SO4/H2O混合物 (流股19)再經(jīng)過分離器(SEP4)得到HI溶液(流股22)和w=23%的硫酸(流股23),流股23經(jīng)過E301換熱之后進入硫酸精餾塔(T301)精餾提濃,塔底產(chǎn)出的w= 96%的硫酸(流股30)通過E302換熱之后部分作為循環(huán)副產(chǎn)品回收利用,剩余部分返回H2S氧化反應系統(tǒng),塔頂產(chǎn)出的水(流股29)經(jīng)過E303換熱得到的流股35返回Bunsen反應系統(tǒng)作為反應物繼續(xù)參與反應。
2.3 HI分解系統(tǒng)模擬
Bunsen反應產(chǎn)生的氫碘酸相經(jīng)分離、換熱送入HI分解反應器, 反應生成的I2循環(huán)回收至Bunsen反應階段繼續(xù)參與反應,H2則作為循環(huán)的主要目標產(chǎn)物被收集。 參考Kasahara S等[15]的實驗數(shù)據(jù),HI分解反應模擬的條件設定為1.2 MPa、450 ℃。
HI分解反應模擬流程如圖3所示。HI/H2SO4/H2O混合物(流股19)經(jīng)過分離器(SEP4)得到HI溶液(流股22), 再 經(jīng) 由E401 換 熱 后 進 入HI 分 解 反 應 器(RGIBBS),反應生成的HI/H2/I2/H2O混合氣(流股15)經(jīng)過分離器(SEP5)得到目標產(chǎn)物H2和HI/I2/H2O混合氣(流股26),經(jīng)換熱分離后,HI溶液(流股32)返回HI分解反應器(RGIBBS)繼續(xù)分解,I2(流股28)作為Bunsen反應原料返回Bunsen反應器(RSTOIC3)。
3 模擬結果與分析
3.1 H2S化學反應循環(huán)質(zhì)量平衡
3.1.1 H2S氧化反應系統(tǒng)
H2S氧化反應質(zhì)量平衡數(shù)據(jù)如表2所示。 流股AIR經(jīng)分離單元(SEP2)得到的流股N2流量為333 kmol/h,純度為97.1%。 流股2為H2S產(chǎn)品氣,流量為97 kmol/h,其中H2S純度為68.9%。 在H2S氧化反應器RSTOIC1中與流股1反應得到的流股5流量為1209 kmol/h, 其中SO2、S和H2SO4的物質(zhì)的量分數(shù)之比為2.3:6.9:63.7。流股2經(jīng)H2S氧化和S氧化反應得到的氣相流股14中SO2的純度為80.9%。 根據(jù)模擬數(shù)據(jù)計算得到H2S氧化反應系統(tǒng)H2S的處理量為2268 kg/h,空氣的消耗量為12165 kg/h,該反應階段可產(chǎn)出SO27130 kg/h,副產(chǎn)N29059 kg/h。
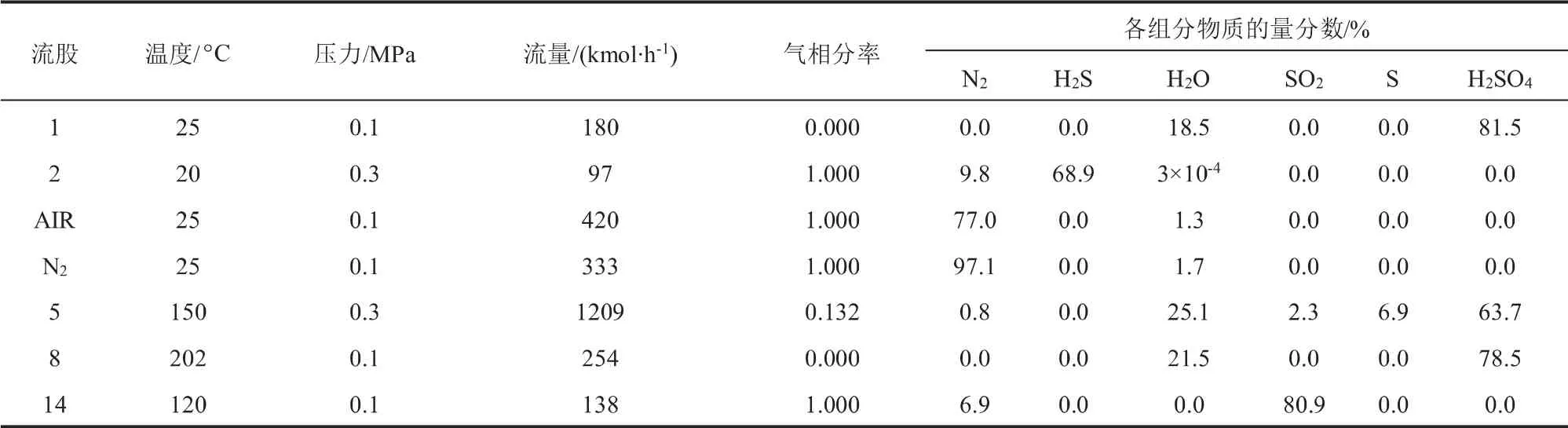
表2 H2S氧化反應質(zhì)量平衡
在H2S氧化反應系統(tǒng)設置HEATX模塊回收S氧化反應產(chǎn)生的熱量以降低系統(tǒng)能耗, 減少投資費用。表3為換熱系統(tǒng)質(zhì)量平衡表。流股6為H2S氧化反應生成的單質(zhì)S, 在S氧化反應器RSTOIC2與流股O2充分反應得到的氣相流股10溫度為1278 ℃,SO2純度為98%,之后在換熱單元(HEATX)中與流股H2O換熱得到的氣相流股13溫度為110 ℃, 在模擬過程中通過調(diào)整流股9的氣相分率得到4.0 MPa、104 ℃的流股H2O經(jīng)過換熱之后,可以產(chǎn)生4.0 MPa、250 ℃的水蒸氣118 kmol/h,即2124 kg/h。
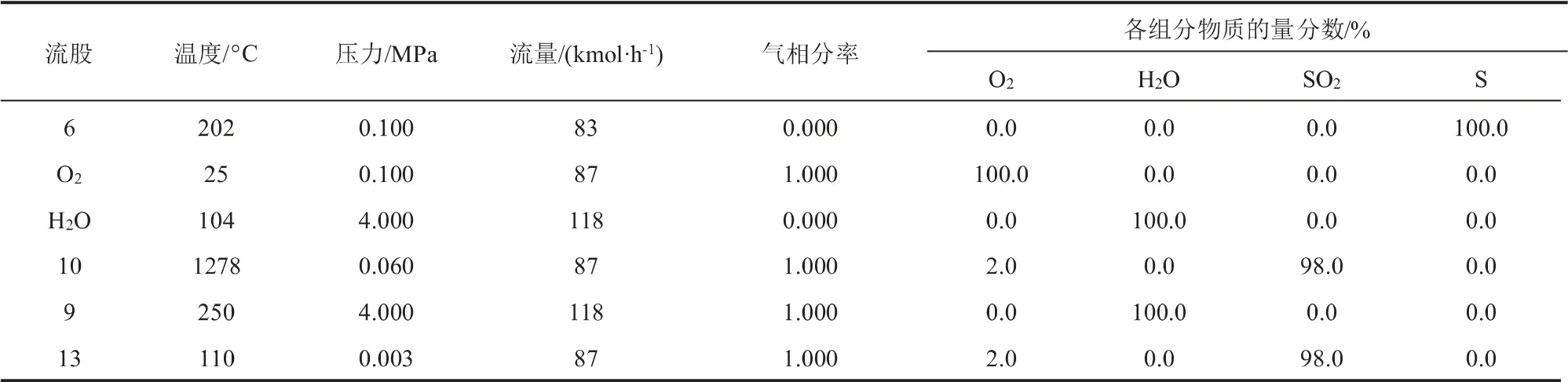
表3 換熱系統(tǒng)質(zhì)量平衡
3.1.2 Bunsen反應與硫酸精餾提濃系統(tǒng)
Bunsen反應與硫酸精餾提濃系統(tǒng)的質(zhì)量平衡數(shù)據(jù)如表4和表5所示。 流股24為I2-甲苯溶液,流量為3011 kmol/h, 其中I2的物質(zhì)的量分數(shù)為28.6%,流股27為額外補充的水,流量為2151 kmol/h。 流股11、14、24、27經(jīng)混合換熱后在Bunsen反應器(RSTOIC3)中反應得到的流股18流量為5318 kmol/h,其中I2、甲苯、H2O、HI 和H2SO4的物質(zhì)的量分數(shù)之比為14.1:40.4:38.7:4.2:2.1。流股21為未反應完的I2-甲苯溶液,其中I2的物質(zhì)的量分數(shù)為25.8%,可循環(huán)使用繼續(xù)參與Bunsen反應。 流股18經(jīng)過SEP3、SEP4兩次分離得到的流股23經(jīng)過E301換熱之后進入硫酸精餾塔(T301)精餾提濃,塔底產(chǎn)出的流股30為w= 96%的硫酸,流量為137 kmol/h。該階段甲苯與I2循環(huán)使用,假定循環(huán)損失率為0.1%, 經(jīng)計算甲苯和I2的循環(huán)損失量分別為2.145 kg/h和0.856 kg/h。
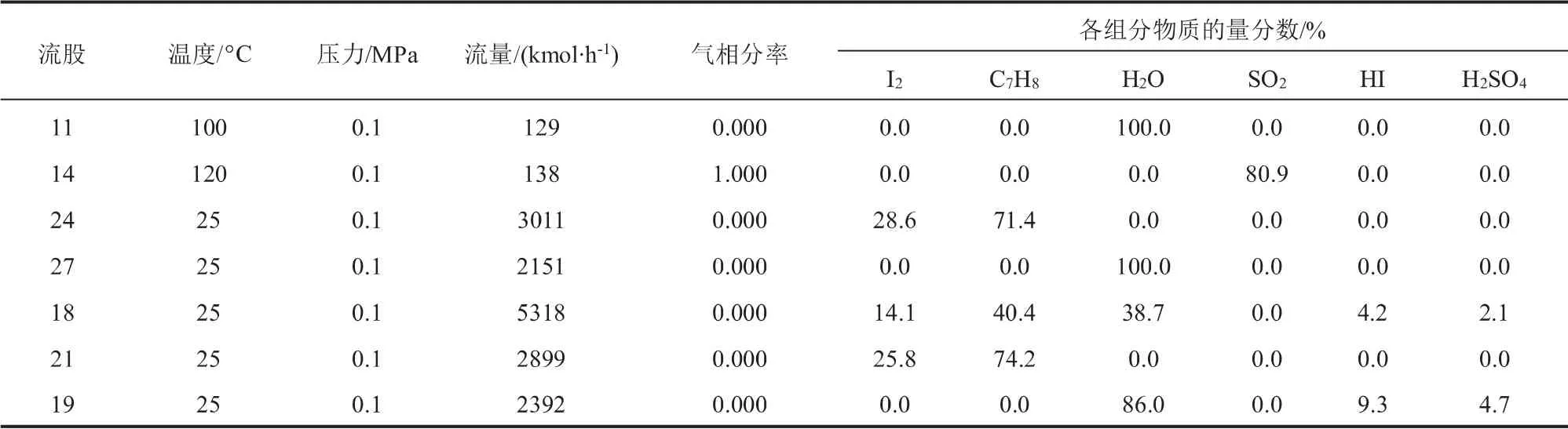
表4 Bunsen反應質(zhì)量平衡
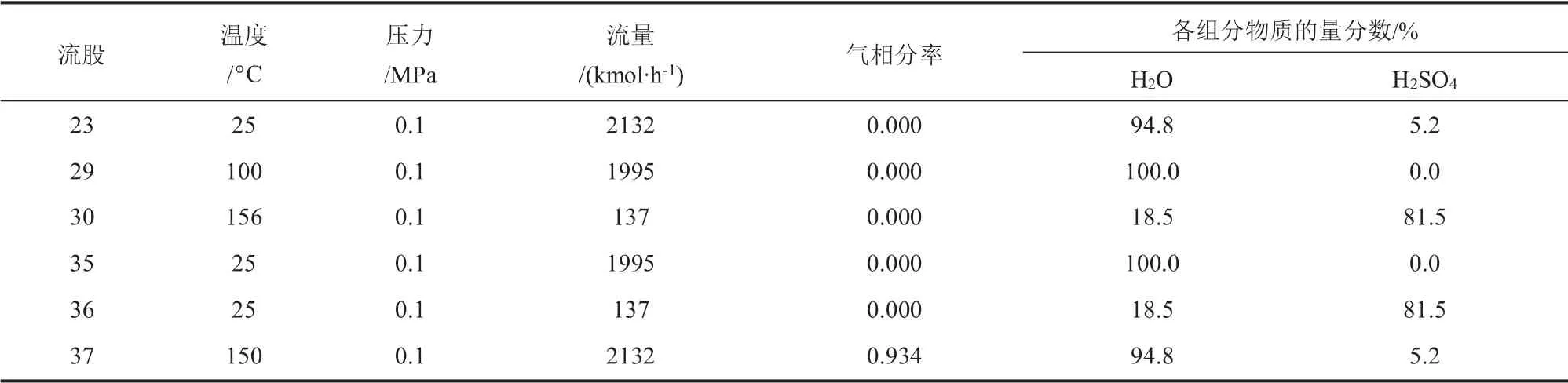
表5 硫酸精餾提濃系統(tǒng)質(zhì)量平衡
3.1.3 HI分解系統(tǒng)
HI分解反應質(zhì)量平衡如表6所示。 流股19經(jīng)過分離單元(SEP4)得到的流股22為HI溶液,流量為260 kmol/h,其中HI純度為85.7%,經(jīng)過HI分解反應后得到的氣相流股15中H2、I2、H2O和HI的物質(zhì)的量分數(shù)之比為0.9:0.9:1.4:6.7。 流股15經(jīng)過分離單元(SEP5)得到流股H2為循環(huán)目標產(chǎn)物,流量為24 kmol/h;流股26則經(jīng)換熱分離后得到流股32和流股28,流股32為HI溶液,流量為211 kmol/h,可繼續(xù)參與HI分解反應, 流股28為單質(zhì)I2, 流量為24 kmol/h, 可返回Bunsen反應階段繼續(xù)反應。 根據(jù)模擬數(shù)據(jù)計算得到在溫度為450 ℃、 壓力為1.2 MPa時,HI的分解率為21.88%。
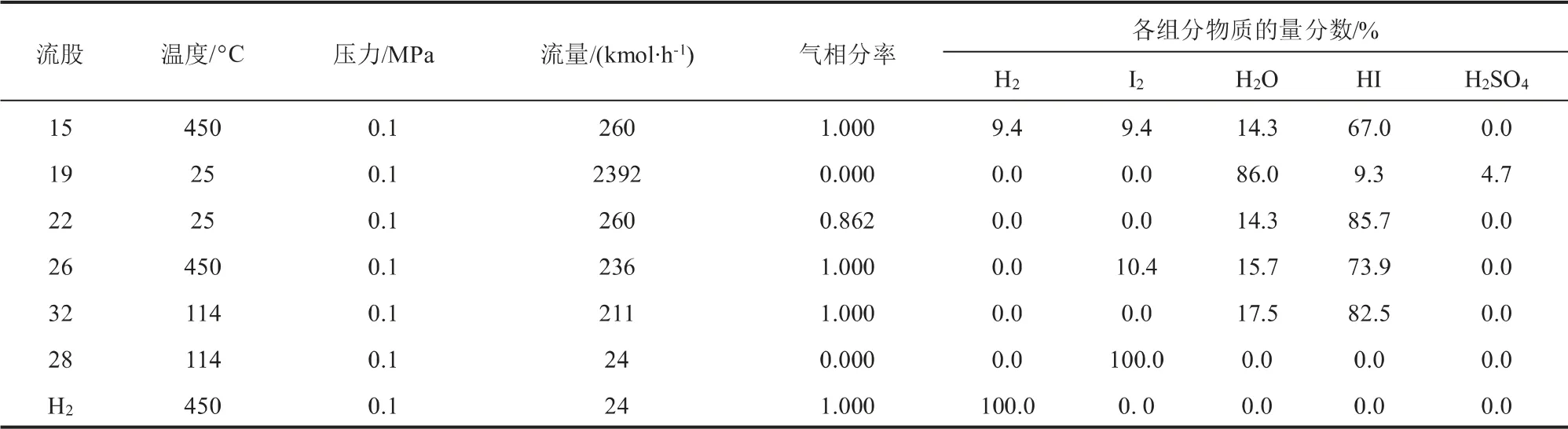
表6 HI分解反應質(zhì)量平衡
3.2 靈敏度分析
3.2.1 壓力對硫酸精餾提濃過程的影響
硫酸精餾提濃過程主要包括3個換熱器(E301-E303),表7匯總了5個壓力等級下3個換熱器的熱負荷W以及總能耗。 當壓力增加時,E301的能耗不變,這是因為硫酸精餾塔的進料物流的溫度和壓力沒有變化,精餾塔操作壓力的改變對E301的能耗沒有影響,而隨著硫酸精餾塔操作壓力的增加,精餾塔塔底和塔頂物料的溫度升高,從而導致E302和E303的能耗逐漸減小。 因此硫酸精餾提濃過程總能耗由23507.5 kW(0.10 MPa)降低到21811.7 kW(0.30 MPa)。但考慮到加壓精餾會增加投資成本,一般選擇常壓精餾實現(xiàn)硫酸的精餾提濃。
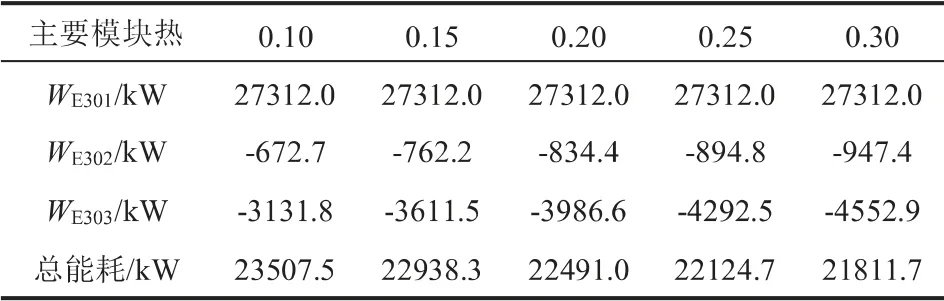
表7 壓力對硫酸精餾提濃熱負荷的影響
3.2.2 溫度和壓力對HI分解反應的影響
保持壓力為0.1 MPa不變,在200~750 ℃的溫度范圍內(nèi)HI分解率的變化趨勢如圖4(a)所示。 HI分解率隨反應溫度的升高而增大, 兩者基本呈線性關系, 但是在200~750 ℃溫度范圍內(nèi)HI分解率均較低(溫度為750 ℃時,HI分解率僅為27.68%)。在實際工藝過程中, 大幅升溫會增加投資成本和操作難度,因此通過溫度變化提高HI分解率不可行,需要通過膜分離或催化技術等方式促進HI分解。 保持溫度為450 ℃不變,在0.1~1.2 MPa的壓力范圍內(nèi)HI分解率的變化趨勢如圖4(b)所示。 結果顯示,壓力從0.1 MPa提升到1.2 MPa,HI分解率僅提高了0.02%, 壓力對HI分解反應幾乎無影響,通過調(diào)節(jié)壓力來促進HI分解不可行。
4 結論
(1)質(zhì)量平衡模擬結果顯示,循環(huán)系統(tǒng)輸入H2S原料氣2268 kg/h,空氣12165 kg/h,可得到H248.8 kg/h,w= 96%的硫酸653.3 kg/h,并副產(chǎn)N29059 kg/h,其中甲苯和I2的循環(huán)損失量分別為2.145 kg/h和0.858 kg/h。
(2)在H2S氧化反應系統(tǒng)設置HEATX模塊,通過4.0 MPa、104 ℃的水對S氧化反應進行熱量回收產(chǎn)生4.0 MPa、250 ℃的水蒸氣2124 kg/h, 供系統(tǒng)其它部分使用。
(3)壓力對H2SO4精餾提濃、溫度和壓力對HI分解反應的影響結果顯示,硫酸精餾所需要的熱量隨著壓力的降低而增加;氫碘酸分解率隨反應溫度的升高而增大,壓力對氫碘酸分解率的影響很小。

