去分化脂肪肉瘤潛在核心基因的生物信息學預測及分析
胡美娟,周燕燕,彭 冉,邱 琰,周永杰,楊李波,包 驥,步 宏
去分化脂肪肉瘤作為惡性間葉組織腫瘤的一員,臨床表現具有侵襲性,局部復發率達80%[1]。該病發生遠處轉移較少,轉移率約20%。原發于腹膜后的腫瘤相比其它部位預后明顯較差[1],且易與腹膜后脂肪肉瘤相關多原發惡性腫瘤(multiple primary malignant neoplasms, MPMN)混淆[2]。目前治療主要依賴手術切除,因為其對放、化療均不敏感,所以需要尋找有效的分子標志物作為診斷標志物和潛在的治療靶點。目前關于分子標志物和治療靶點在低分化脂肪肉瘤中的報道較少。本文通過獲取基因表達數據庫(gene expression omnibus,GEO)的去分化脂肪肉瘤和正常脂肪組織的芯片數據,基于生物信息學分析篩選差異表達基因,對探究潛在核心基因在去分化脂肪肉瘤的惡性生物學行為中的作用提供理論依據,為分析去分化脂肪肉瘤的分子機制和治療靶點奠定基礎。
1 材料與方法
1.1 材料通過GEO數據庫(https:www.ncbi.nlm.nih.gov/geo/)獲得GSE21122和GSE52390的芯片數據,GSE21122數據集中包括9例正常脂肪樣本(樣本編號GSM528425-528433),46例去分化脂肪肉瘤樣本(樣本編號GSM528276-528321);GSE52390數據集中包括2例正常脂肪樣本(樣本編號GSM1264449-1264450),12例去分化脂肪肉瘤樣本(樣本編號GSM1264437-1264448)。
1.2 差異表達基因的篩選通過GEO2R(http://www.ncbi.nlm.nih.gov/geo/geo2r/)分析,對去分化脂肪肉瘤和正常脂肪組織之間的差異表達基因進行篩選,篩選條件:矯正后P<0.05和|LogFC|≥2,用R包進行差異表達基因的火山圖繪制。分別輸入GSE21122和GSE52390中上調和下調的差異表達基因到https://bioinfogp.cnb.csic.es/tools/venny/index.html,對差異表達基因取交集。
1.3 差異表達基因的基因本體(gene ontology, GO)功能富集分析GO主要包括以下三個部分:分子功能(molecular function, MF)、細胞成分(cellular component, CC)、生物過程(biological process)。提交差異表達基因到Funrich 3.1.3軟件(http://funrich.org/)中進行GO功能富集分析。
1.4 差異表達基因的京東基因和基因組百科全書(Kyoto Encyclopedia of genes and genomes, KEGG)通路富集分析KEGG是一個從分子水平注釋基因功能的數據庫。將差異表達基因輸入KOBAS 3.0數據庫(http://kobas.cbi.pku.edu.cn/kobas3)進行KEGG通路富集分析,篩選條件為P<0.01,FDR<0.01。
1.5 差異表達基因的蛋白互作分析將差異表達基因輸入String11.0在線網站(https://string-db.org/cgi/input.pl)進行蛋白互作分析,參數設置為:互作分值低度可信(low confidence:0.15),隱藏網絡中的不相關節點。
1.6 潛在核心基因的篩選將蛋白互作分析中的數據導入到Cytoscape 3.8.0軟件(https://cytoscape.org/)中,用cytoHubba插件按照節點數篩選出前10個基因作為潛在核心基因。
2 結果
2.1 差異表達基因的篩選通過對差異表達基因進行篩選,分別得到GSE21122的差異表達基因220個,64個基因表達上調,156個基因表達下調;GSE52390的差異表達基因173個,28個基因表達上調,145個基因表達下調。通過韋恩圖取交集,最后得到差異表達基因68個,10個共上調基因,58個共下調基因(圖1、2)。
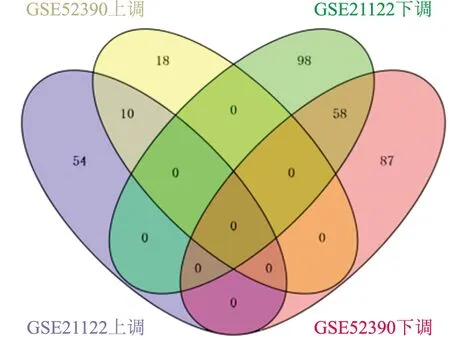
圖1 差異表達基因的韋恩圖:10個共上調差異表達基因,58個共下調差異表達基因
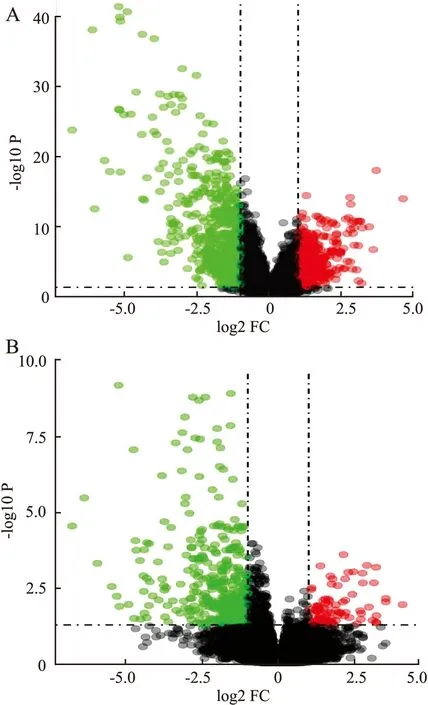
圖2 A.GSE21122的差異表達基因火山圖;B.GSE52360的差異表達基因火山圖;紅色代表上調基因,綠色代表下調基因,黑色代表基因變化不顯著
2.2 GO功能富集分析GO功能富集分析結果表明,差異表達基因顯著富集:(1)代謝和能量通路的生物過程,分別有23個和22個基因參與;(2)細胞外基質和線粒體的細胞組分,分別有7個和12個基因參與;(3)細胞外基質結構成分和催化活性的分子功能,分別有6個和8個基因參與(圖3)。

圖3 差異表達基因的GO功能富集分析:A.生物過程;B.細胞組分;C.分子功能
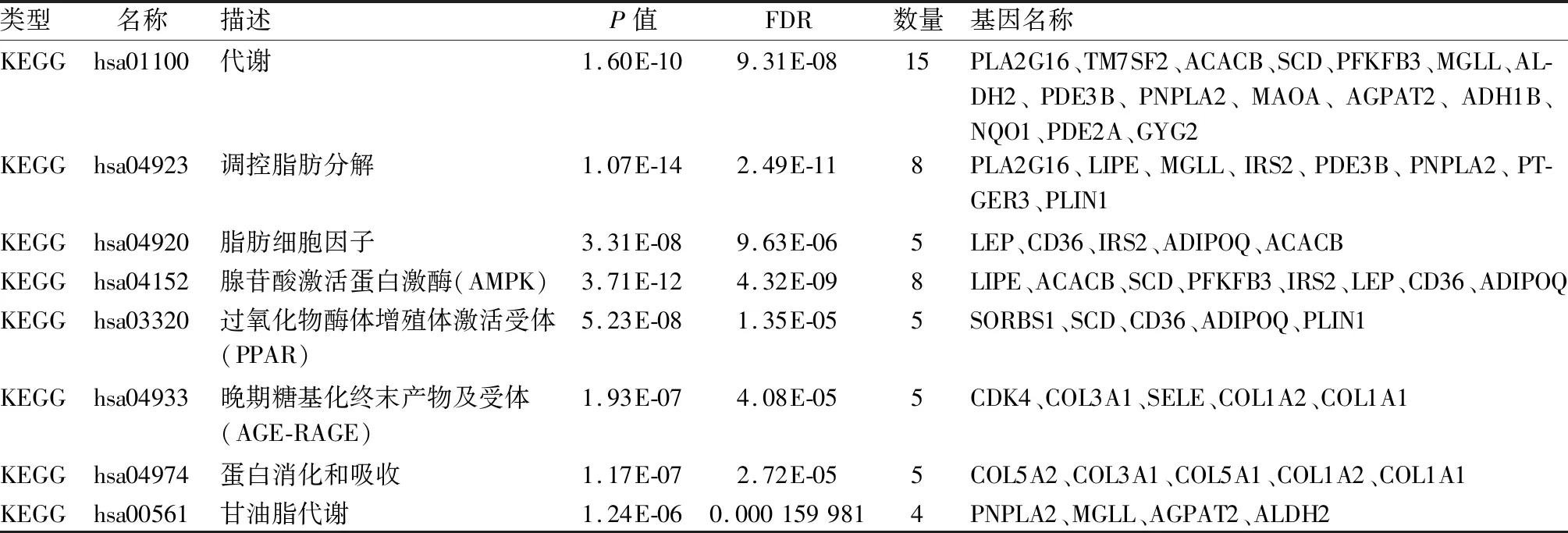
表1 差異表達基因的KEGG通路富集分析
2.3 KEGG通路富集分析KEGG富集分析結果表明上調差異表達基因顯著富集在蛋白消化、吸收信號通路和AGE-RAGE信號通路,參與的基因主要有COL1A1、COL1A2和COL3A1;下調差異表達基因顯著富集在脂肪細胞因子、AMPK信號通路、PPAR信號通路和調控脂肪分解信號通路,參與的基因主要有PNPLA2、LIPE、ADIPOQ、SCD、PLIN1和LEP(表1)。
2.4 蛋白互作分析輸入68個差異表達基因到String11.0在線網站后,合計得到68個節點,445條連線,去除不相關的節點后構建蛋白互作網絡。
2.5 潛在核心基因的篩選用Cytoscape 3.8.0軟件將蛋白互作分析中的數據可視化,分別用紅色和綠色代表上調和下調的差異表達基因(圖4A)。通過CytoHubba插件篩選出前10個潛在核心基因分別為LEP、ADIPOQ、SCD、PLIN1、LPL、CAV1、PNPLA2、LIPE、CEBPA和CIDEA,且均在去分化脂肪肉瘤中表達下調,其中ADIPOQ、PNPLA2和LIPE富集的信號通路較多,包括脂肪細胞因子、AMPK信號通路、代謝、PPAR信號通路和調控脂肪分解信號通路(圖4B)。
3 討論
去分化脂肪肉瘤是成人脂肪肉瘤中較常見的亞型之一,局部復發率較高。目前關于去分化脂肪肉瘤的研究為在12q13-15區域上發現MDM2、CDK4等[3]基因的高水平擴增及在1p32、6q23區域上[4]發現JUN、ASK1等基因的共同擴增[5]。但已有研究表明MDM2的擴增并非僅見于去分化脂肪肉瘤,MDM2的抑制劑Nutlin-3也只能有限抑制去分化脂肪肉瘤的生長,因此需要進一步分析去分化脂肪肉瘤發生過程中的其它關鍵基因。從GEO數據庫(www.ncbi.nlm.nih.gov/geo/)中下載GSE21122和GSE52390的表達譜芯片數據,使用GEO在線分析工具GEO2R(http://www.ncbi.nlm.nih.gov/geo/geo2r/)將樣本分為正常脂肪組和去分化脂肪肉瘤組,按照矯正后P<0.05和|LogFC|≥2的條件進行篩選,得到220個GSE21122的差異表達基因和173個GSE52390的差異表達基因,用在線網站VENNY2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html)取交集后得到共差異表達基因68個,然后對差異表達基因進行GO功能、KEGG通路富集分析和蛋白互作分析,結果發現在篩選的10個潛在核心基因中,PNPLA2、LIPE、ADIPOQ、SCD、PLIN1和LEP基因的富集通路較多,可以在去分化脂肪肉瘤的下游通路機制研究中重點關注。
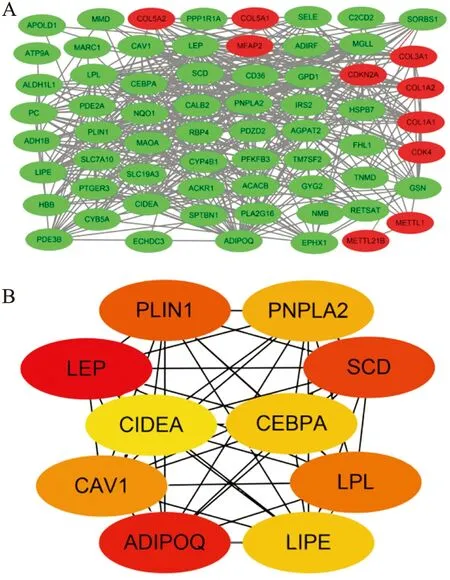
圖4 A.Cytoscape中的可視化蛋白互作網絡圖:紅色代表上調差異表達基因對應的蛋白質,綠色代表下調差異表達基因對應的蛋白質;B.篩選的前10個潛在核心基因:顏色越深,代表評分越高
篩選出的68個差異表達基因中,按照矯正后P排名上調最顯著的是COL1A2,下調最顯著的是LEP。有研究發現COL1A2和COL1A1這兩條I型膠原在多種類型的腫瘤中均表達異常,可以作為腫瘤治療的新型分子標志物[6-7]。Omar等[6]研究表明TBX3結合并激活COL1A2啟動子,分別在軟骨肉瘤和纖維肉瘤細胞中介導TBX3的促遷移和抗遷移作用。Fang等[7]研究提示COL1A1和COL1A2在肺癌和食管癌中的mRNA表達水平高于正常組織,但與腫瘤結節轉移無關,I型膠原的低表達與總生存期差和癌細胞分化顯著相關。Italiano等[8]研究通過人類基因組芯片和實時熒光定量PCR發現LEP是乳腺癌的顯著差異表達基因之一,可以作為腫瘤的新型治療靶點。Kroll等[9]研究表明脂肪蛋白(ADIPOQ)和瘦素(LEP)基因變異與能量攝入存在關聯,表明LEP-rs7799039多態性與能量攝入之間存在正相關。但是關于COL1A2和LEP在去分化脂肪肉瘤中的功能缺乏報道,仍需進一步探討。
將差異表達基因進行GO功能富集分析及KEGG通路富集分析,結果發現這些基因主要參與代謝和細胞通訊等生物學過程,并且主要涉及脂肪細胞因子通路、AMPK信號通路、PPAR信號通路和調控脂肪細胞分解信號通路。有研究發現AMPK-mTOR通路是平衡細胞代謝過程和調節細胞生長的重要開關,通過激活AMPK可以抑制mTOR通路[10]。Kikuchi等[11]研究發現SCD通過單不飽和脂肪酸調控AMPK信號通路,促進了癌癥中的代謝重編程,可作為癌癥的潛在治療靶點。Samovski等[12]研究發現CD36的表達會抑制AMPK信號通路,但同時CD36與脂肪酸的結合會激活AMPK信號通路。在去分化脂肪肉瘤組織中,AMPK通路對于其促進或抑制腫瘤的雙重功能需要結合腫瘤的不同發展階段來考慮。Zhao等[13]研究表明AMPK信號通路的磷酸化底物ULK1是自噬的核心基因之一,可以誘導細胞自噬而發揮抗腫瘤作用。有研究發現鐵死亡在多數腫瘤的病理生理過程中發揮著重要作用[14],通過激活AMPK可降低多不飽和脂肪酸的合成,從而抑制鐵死亡,促進腫瘤發生[15]。Sultan等[16]研究表明在PPAR-γ信號通路中顯著富集的基因PLIN1在乳腺癌中低表達,可以作為乳腺癌早期診斷的新靶點。Lu等[17]研究發現奧利多寧在體外和體內通過激活PPAR-γ通路和抑制Nrf2通路來促進骨肉瘤細胞凋亡,可以作為骨肉瘤的靶向藥物。在去分化脂肪肉瘤中,Horvai等[18]研究表明PPAR-γ的免疫表型再結合其他標志物可以方便診斷去分化脂肪肉瘤和其它分化良好的脂肪肉瘤。Kim等[19]研究發現ADIPOQ通過激活AMPK來增加PPAR-α的表達,進而激活PPAR-γ核受體共激活因子PGC-1α,從而調節脂肪代謝和誘導抗癌作用。以上研究結果表明AMPK、PPAR和脂肪細胞因子等信號通路在去分化脂肪肉瘤的發生中可能存在相互作用,仍需要進一步探究。
利用String對差異表達基因構建蛋白互作網絡,再通過Cytoscape篩選的10個潛在核心基因,均在去分化脂肪肉瘤中下調表達。Codenotti等[20]研究發現通過一致的脂肪生成分化特征,可將CAV1作為脂肪肉瘤的分子標志物。Taylor等[21]研究發現通過去甲基化能恢復去分化脂肪肉瘤細胞中的CEBPA表達,發揮體外抗增殖、促凋亡及體內抑制腫瘤生長的作用。Straub等[22]研究發現PLIN1可作為脂肪肉瘤與其他軟組織肉瘤診斷的潛在治療靶點。Cytoscape軟件預測的潛在核心基因與上述研究中報道的基因比較一致,結果表明這些基因可能是去分化脂肪肉瘤惡性生物學行為中的潛在核心基因。
綜上所述,本實驗發現了去分化脂肪肉瘤的潛在核心基因均表達下調,并初步分析其相關的生物過程和信號通路,為未來去分化脂肪肉瘤的發病機制和靶向研究提供理論依據。

