高活性陽極制備及阿莫西林降解中的毒性效應
李曉良,王 雪,邱曉鵬,路思佳,辛鳳丹,鄭 興 (.西安理工大學,西北旱區生態水利國家重點實驗室,陜西 西安 70048;.西安交通大學環境科學與工程系,陜西 西安 70049)
我國作為抗生素生產與消費大國,抗生素的濫用與無序排放現象非常普遍,導致水環境中抗生素污染日益嚴重[1-2].傳統的水處理方法(生物、混凝、過濾等)無法將水體中抗生素有效去除,導致大量抗生素進入水環境,對人體健康與生態安全造成嚴重威脅[3-4].阿莫西林(AMX)作為一種常見廣譜抗生素類藥物,被廣泛用于人體與動物疾病治療[5].但AMX在水相中極易形成性質更加穩定的聚合物,進一步增強了其被降解的難度.由于AMX 的大量使用以及其生物代謝能力較差等原因,某些水體中(比如醫療廢水、制藥廢水等)AMX 濃度甚至高達μg/L~mg/L級別[6-8].而如何實現這些水體中高濃度AMX 的有效去除至關重要.
電催化氧化(EO)作為一種環境友好型水處理技術,無需化學藥劑添加,高效、簡便,適用于難生物降解的污染物去除,并且在AMX 的去除方面已有相關研究[9-12].AMX 在電催化初期過程中可能產生毒性更高的中間體,增強該類廢水的毒性風險水平,因此電催化降解過程中需要保障AMX 的高效降解,并掌握AMX 在電催化降解過程中的毒性演變規律.陽極材料作為該技術的核心,對整個電催化處理過程起到重要作用[13-15].而高活性的電極更有利于AMX 的深度降解與礦化,可避免高毒性中間體的積累.Ti/PbO2屬于“非活性電極”,耐腐蝕性強,催化性能較高,且材料經濟易得,已被廣泛用于難降解有機廢水處理當中[16-18].然而,Ti/PbO2電極催化層表面粗糙度與比表面積較小,導致其催化涂層的活性位點與伏安電荷總量較少,不利于污染物催化降解效果提升.
基于此,本文采用電流梯級調控方式制備多催化位點的高效Ti/PbO2陽極,對模擬AMX 廢水進行電催化降解,并以斜生柵藻作為受試體,結合量化毒理基因組學技術對AMX 在降解過程中的生態毒性與毒理進行評價與分析,以保障電催化降解過程中抗生素廢水的安全排放.
1 材料與方法
1.1 試劑與材料
本實驗所用化學試劑購自國藥集團化學試劑有限公司(除阿莫西林、乙腈為色譜純外,其它藥品均為分析純),斜生柵藻購自中國科學院武漢水生生物研究所淡水藻種庫, 編號為 FACHB-416 Scenedesmus obiliquus,去離子水由實驗室級超純水器(UPD-II-10T,西安優普儀器設備有限公司)制備,高純(>99.6%)鈦片購自寶雞鈦業股份有限公司.
1.2 電極制備
將鈦片裁剪為5cm×6cm 尺寸,并進行打磨、除油、刻蝕等基體預處理,隨后采用傳統刷涂熱分解法添加Sb-SnO2中間層制得Ti/Sb-SnO2電極,具體操作步驟可參考文獻[19].
以Ti/Sb-SnO2為陽極,相同尺寸的銅片為陰極,控制沉積液溫度在65℃,首先在0.01A/cm2的電流密度下電沉積1h,并按設定程序立即調控電流密度大小為(0.01, 0.05, 0.1, 0.2, 0.3, 0.5, 0.7 與1.0A/cm2),保持5min,取出并用去離子水洗凈,備用.電催化液組成:0.5mol/L Pb(NO3)2, 0.2mol/L Cu(NO3)2, 0.01mol/L NaF 與0.01g/L 十二烷基苯磺酸鈉,采用濃HNO3將沉積液pH 值調至2.
1.3 電極表征及性能測試
制備電極的微觀形貌采用掃描電鏡(SEM,JEOL, JSM-6390A)進行觀察;晶相結構采用X 射線衍射儀(XRD,德國布魯克,D8ADVANCE)進行分析,掃描角度(2θ)為10°~80°.采用VersaSTAT4 型電化學工作站(德國,普林斯頓)對制備電極進行電化學性能測試,Ag/AgCl(飽和KCl)與鉑片分別作為參比電極及對電極,電催化液為0.5mol/L H2SO4.循環伏安(CV)掃描范圍為0~2.5V,掃速為50mV/s.交流阻抗(EIS)測試頻率掃描范圍為105~0.01Hz,振幅為5mV,測試電位為0V.以直流穩壓電源控制電流水平(0.5A/cm2),在3mol/L H2SO4溶液中進行制備電極的強化壽命測試,控制電催化液溫度在(35±2)℃,實時監控系統槽電壓變化,當槽電壓到達10V 時,即認為電極壽命結束.
1.4 斜生柵藻培養與藻密度及葉綠素a 含量測定
將斜生柵藻無菌轉移至BG11 培養液中[20],并放入培養箱中馴化.培養條件:光照強度3000lx,光暗比12h:12h,溫度(25±1)℃ ,每天搖勻4~5 次,其余時間靜置培養.采用血球計數板對藻細胞進行顯微計數,用紫外分光光度計進行OD 值測定,設置單波長為680nm.對OD 值和藻密度進行擬合,獲得二者之間的函數關系.葉綠素a 含量測試采用乙醇萃取-分光光度法,具體步驟參考文獻[21].
1.5 AMX 濃度測定
取水樣,進行0.22μm 有機濾膜過濾,采用高效液相色譜儀(Aglient1100)進行AMX 濃度分析.色譜條件:C18 色譜柱,紫外檢測器波長為228nm,流動相為90%超純水+10%乙腈,停留時間為8min.
1.6 AMX 對斜生柵藻的生長抑制效果
取100mL 經高溫滅菌的BG11 培養液,添加AMX 實現不同AMX 暴露濃度(1, 5, 50, 100, 300,500mg/L),加入生長對數期(藻密度2×105cells/mL)的斜生柵藻液10mL,放入培養箱內進行毒性測試.分別于24, 48, 72, 96h 取藻液進行OD680值和葉綠素a含量測定,按照公式1 計算AMX 對斜生柵藻藻密度與葉綠素a 抑制率.實驗過程中設置無AMX 的空白對照組,并分別設置3 個平行樣,整個測試過程中保持無菌環境.

式中:φ 表示藻密度或葉綠素a 的抑制率;A0與An分別表示空白對照組的藻密度或葉綠素含量與AMX暴露后的藻密度或葉綠素含量.
1.7 AMX 在電催化降解過程中毒理分析
為了使得實驗效果更加顯著,本研究中采取了高濃度的AMX 作為處理目標.采取超純水配制300mg/L 的AMX 溶液,并加入0.1mol/L Na2SO4作為電解質.采取優選制備電極為陽極,相同尺寸銅片為陰極,電極有效面積為30cm2,電極間距為1.5cm,由直流穩壓電源提供0.01A/cm2的電流密度,對體積為100mL 的AMX 溶液進行電催化,在150min內所設定時間間隔取樣,并進行冷凍干燥提取有機成分,添加至100mL 經高溫滅菌的BG11 培養液,加入10mL 對數期的斜生柵藻,以96h 培養為限,觀測斜生柵藻生長抑制情況.同時,對不同電催化時間后提取的有機成分進行量化毒理基因組學測定,借助110 種帶有不同啟動子的E.coli K12MG1655(含低拷貝質粒、卡那抗性基因及綠色熒光標記基因)活細胞陣列的實時基因表達譜檢測方法,通過顯微細胞微孔成像系統對暴露于有毒物質的菌株測定其光密度(OD)及熒光強度(GFP),對所測得數據進行生物信息學分析,以每個基因及其綜合轉錄效應指數(TELI)為量化依據,完成對環境污染物的毒性評估,具體步驟可參考文獻[22-23]. TELI 是以110種帶有特定啟動子的E.coli 作為受體,通過檢測有毒物質對不同類型基因應激表達的刺激程度,經過系列積分公式(2-3)計算得出的一個毒性水平量化指數.

式中:TELIgenei與TELItotal分別表示單基因與綜合轉錄效應指數;I 表示誘導因子.
2 結果與討論
2.1 電極表層形貌

表1 制備PbO2 電極的不同參數Table 1 The different parameters of selected PbO2 electrodes

圖1 不同沉積電流密度下PbO2 電極的SEM 照片Fig.1 SEM images of PbO2 electrodes under different deposition current densities
由圖1 可以看出,電極制備過程中沉積電流密度由0.01A/cm2增加至1.0A/cm2時,涂層顆粒由小變大,并且電極表層形貌由“四棱錐型”向“菜花狀”轉變.當沉積電流密度增加至0.7A/cm2時,涂層顆粒發生坍塌,形成粒徑較小的均勻顆粒,經測試電極穩定性極差,因此后續未進行0.7 與1.0A/cm2電流密度下電極的相關研究.同時研究發現,在0.5A/cm2電流密度下制備的電極材料涂層較為疏松,結合力較弱,并存在涂層剝離的現象,容易導致電催化液向涂層內部的侵入,不利于電極材料的穩定性.造成這一現象的原因是因為PbO2晶粒隨電沉積時間與電流強度而發育長大,電流強度過大會造成沉積過程加劇,PbO2顆粒在短時間內迅速堆疊、長大,造成涂層負載量增加,但同時也會降低涂層對沉積面的結合力,造成涂層剝離現象發生.經過精密天平稱重,電流密度0.01~1.0A/cm2下制備的電極涂層總負載量分別為86.3, 90.1, 96.3, 92.1, 89.7, 82.5mg/cm2(表1).而較大的涂層負載量也有利于催化位點的增加以及電極壽命的延長.
2.2 電極表層晶型結構
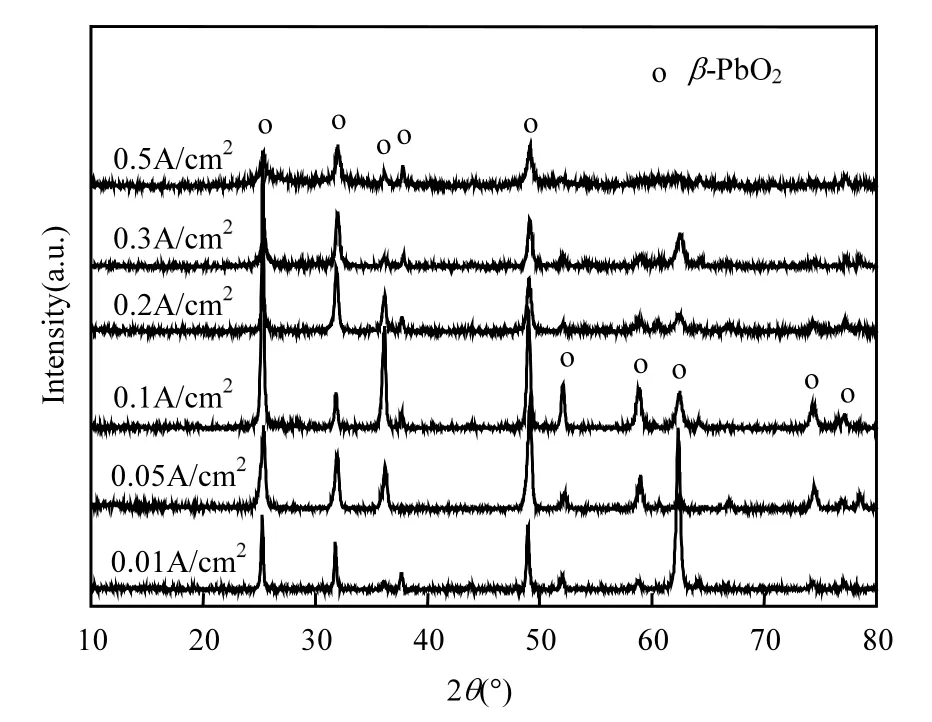
圖2 不同沉積電流密度下PbO2 電極的XRD 譜圖Fig.2 XRD patterns of PbO2 electrodes under different deposition current densities
經XRD 分析(圖2),不同沉積電流密度下PbO2電極的主要衍射峰位于25.4°, 31.8°, 36.2°, 49.0°,52.1°, 58.9°, 62.5°,分別對應β-PbO2的(110),(101),(200),(211),(220),(310)及(301)晶面,說明隨電流密度的增加,電極表層晶型結構未發生改變,仍為β-PbO2.但可以明顯地看到0.1A/cm2下的電極表層晶型發育最為良好,隨沉積電流密度的繼續增加,涂層晶型衍射峰強度降低,峰寬增大,結晶程度變差.推其原因是因為過大的電流強度影響到β-PbO2的結晶過程,晶體發育受阻,結晶度變差,而良好的晶型更有利于材料催化性能的提升.
2.3 循環伏安測試
圖3 為不同PbO2電極在0.5mol/L H2SO4溶液中的循環伏安曲線.電極的催化活性與其催化活性位點多少有密切的聯系,而循環伏安電量(q*)可以從一定程度上反映電極涂層本身活性位點的多少[24-26].通過對0.01~1.0A/cm2電流密度下制備的電極循環伏安曲線進行積分求得q*分別為0.079,0.094, 0.087, 0.216, 0.235, 0.103C/cm2.但0.3A/cm2電流密度下制備的電極穩定性較差,經過第二圈掃描后有部分涂層脫落,同時循環伏安最高電流密度由95mA/cm2降至17mA/cm2,曲線所包圍的封閉面積(即伏安電量)極大減小.相比較而言,0.2A/cm2電流密度下制備的電極在進行多次掃描后仍具有較高的穩定性,同時也呈現較大的伏安電量,更有利于電極對污染物的電催化過程.推其原因是因為0.2A/cm2電流密度下制備的電極形貌成三維“菜花狀”,同時具備較高的涂層負載量,二者綜合提高了電極的催化位點數量與伏安電量.

圖3 不同沉積電流密度下PbO2 電極的循環伏安曲線Fig.3 Cyclic voltammograms curves of PbO2 electrodes under different deposition current densities
2.4 交流阻抗測試
圖4 為制備PbO2電極在0.5mol/L H2SO4溶液中的 Nyquist 圖及擬合的等效電路(插圖).經ZSimpWin 軟件擬合發現,所有的測試電極均很好的符合了R1(C(R2W))模型(R1為溶液電阻;R2為傳輸電阻;C為雙電層電容;W為擴散阻抗),其擬合數據列于表2.從圖4 中可以看出,隨著沉積電流密度的提高,電極的容抗弧明顯減小.其中R2的大小可以反映出電荷傳輸的快慢,一般而言,R2數值越小,電極涂層上的電化學反應越容易進行,意味著電極的催化活性越高.測試過程中,0.5A/cm2電流密度下制備的電極容抗弧最小,但此電極性能不穩定.由表2 可知,0.2A/cm2電流密度下制備的電極R2僅為27.27ohm/cm2,同時具有最大的電容值(3.48×10-4F/cm2),說明此電極涂層具有較多的活性位點[27],與循環伏安結果相一致.

圖4 不同PbO2 電極的Nyquist 圖及等效電路示意Fig.4 The fitted curves of the different PbO2 electrodes in EIS and equivalent circuit model
除催化活性外,電極的穩定性也是評價電極質量的一個重要指標.對于PbO2電極,它在實際工作中使用壽命可達幾年,甚至十幾年.因此,為減少其測試時間,本文分別對不同電流密度制備的PbO2電極進行強化壽命測試,以評價電極的穩定性能(表1).由表1 可知,當沉積電流密度在0.01~0.2A/cm2時,電極強化壽命基本保持在90~100h 左右,但當沉積電流密度繼續增加,電極強化壽命將發生急劇縮短,當沉積電流密度達到0.5A/cm2時,電極強化壽命降至15h左右.通過經驗公式(式4)對電極在正常條件下的使用壽命進行評估.經推算,0.01~0.2A/cm2電流密度下制備電極在正常條件下(0.05A/cm2)的使用壽命約為9000h,已滿足實際應用要求.

式中:SL 表示電極使用壽命;i 表示施加電流密度;n表示系數(一般在1.4~2 之間,此處取平均值1.7).
基于以上測試分析,綜合考慮電化學性能與穩定性,優選出0.2A/cm2電流密度下制備的PbO2電極用于后續AMX 電催化降解,并對降解過程中的水質毒性演變過程進行分析.

表2 不同參數的擬合數據(EIS)Table 2 Simulated data of each parameter (EIS)
2.5 AMX 對斜生柵藻的生長影響
經origin 8.0 對斜生柵藻的藻密度(Y)與680nm處紫外吸收值(OD680,X)數據進行擬合,得到函數關系:Y=7.04×106X,R2=0.99029. 后續藻密度通過檢測680nm 處的光密度按此公式進行轉換獲得.
圖5 為不同濃度AMX 對斜生柵藻的生長抑制情況.由圖5(a)可知,隨著AMX 暴露濃度的升高,斜生柵藻的細胞生長受抑制程度隨之增加,96h 的藻密度抑制率從1mg/L AMX 的31.6%提升至500mg/L AMX的53.9%.同時,隨暴露時間延長,藻類生長抑制效應越明顯,但在48h 的暴露時間下藻密度抑制率均有下降趨勢.推其原因是因為斜生柵藻經初期暴露,在48h時對AMX刺激產生暫時性適應,藻細胞產生“自我防御”機制,但隨暴露時間延長,AMX 藥物被藻細胞大量吸收,引起“自我防御”機制崩潰,導致藻類抑制效果重新增強[28].由圖5(b)可知,AMX 對斜生柵藻葉綠素合成抑制效果與藻密度抑制趨勢大致相同,隨著AMX 暴露濃度的增加,斜生柵藻葉綠素合成抑制率也呈現增強趨勢,但葉綠素抑制率最高值為500mg/L AMX 的47.3%,略低于對藻密度的抑制程度.同時,隨暴露時間延長,葉綠素合成受抑制程度逐漸增強.此外,研究發現AMX 對葉綠素合成表現為“低濃度促進,高濃度抑制”效果,與前人研究結果相一致[29-30].
有研究表明[31-32],抗生素在低濃度下可對藻類產生毒性刺激作用,進一步激活相關蛋白酶合成與合成基因表達,促進葉綠素的生成,同時降低藻細胞中葉綠素酶的活性以減緩葉綠素的降解,而藻細胞中葉綠素a 受抗生素的刺激反應更為敏感.

圖5 不同濃度阿莫西林對斜生柵藻生長的影響Fig.5 Effects on the growth of Scenedesmus obliquus under amoxicillin with different concentrations
2.6 AMX 電催化降解效果與毒理分析
圖6 為AMX 采用優選電極的電催化降解效果(插圖:降解過程中的高效液相色譜圖變化)及對斜生柵藻的生長抑制情況.由圖6(a)可知,隨電催化時間延長,水體中AMX 濃度逐漸下降,在150min 電催化時間內,AMX 的濃度從初始的300mg/L 降至136mg/L,去除率達到54.7%.該效果優于之前報道的Ti/RuO2電極在0.7A 較高電流條件下降解所呈現的51.6% AMX 去除率(本文中為0.3A),同時AMX在電催化過程中高效液相色譜圖吸收峰強度降低,并且數量增加,原因是因為AMX 電催化過程中眾多中間體的產生導致,這一現象與Ti/RuO2電極處理結果相一致[33].提取不同電催化時間內水樣的有機成分進行斜生柵藻的生長抑制測試(圖6(b)),結果表明,在150min 的電催化時間內,水樣對斜生柵藻的生長抑制程度先升高后降低,在120min 時藻密度與葉綠素抑制率達到最高值,分別為56.8%與44.2%.推其原因是因為AMX 在電催化過程中濃度雖降低,但產生了某些高毒性中間體,導致其對斜生柵藻的抑制率增大.隨著制備電極對AMX 的持續高效電催化,AMX與其中間體均不斷被消除或轉化為低毒性物質,從而引起水樣對斜生柵藻的生長抑制程度減輕.
為進一步探究AMX 在電催化降解過程中的毒性機理,本文采用TELI 法對電催化過程中收集的有機成分進行毒理基因組學分析(圖7).由圖7(a)可知,AMX 電催化過程中的TELItotal值隨電解進行先增大后減小,并在120min 電催化條件下達到最高值(2.61),其變化趨勢與圖6 中斜生柵藻的生長抑制情況一致.通常認為TELItotal值在1.5 以上所測試的物質具有顯著毒性[34],通過AMX 降解過程中TELItotal值數據說明電催化過程中產生了毒性更高的中間體,并經150min 的持續降解,AMX 或中間體的濃度與毒性水平降低.對110 種基因應激表達熱圖進行分析(圖7(b)),發現AMX 在降解過程中對細胞的氧化應激與蛋白質應激反應較為強烈,而膜應激、DNA應激與一般應激相應基因表達較溫和. AMX 作為一種β-內酰胺類抗生素,主要通過作用于細胞壁上結合蛋白,激活機體內相關酶的表達,干擾細胞壁的合成,并對細胞內氧化還原反應產生強烈刺激[35]. 因此,AMX 在電催化過程中對細胞的氧化應激與蛋白質應激的基因表達最為強烈.此外,通過對比110 種基因表達強弱變化,也可反映出AMX 電催化降解過程中毒性先升高后降低的趨勢,與前文結果一致.


圖6 AMX 電催化降解效果及對斜生柵藻的生長抑制Fig.6 Degradation effect of AMX in electrocatalysis and its inhibition on growth of Scenedesmus obliquus

圖7 AMX 電催化降解中的轉錄效應毒性及110 種基因表達應激效果Fig.7 Transcriptional toxicity during AMX electrocatalytic degradation and heat map of 110gene stress effects紅:應激強烈;黑:應激溫和
3 結論
3.1 電沉積電流密度對活性涂層形貌具有較大影響,隨電流密度的升高,電極表層形貌由“四棱錐型”向“菜花狀”轉變,但晶相仍為β-PbO2,而具有三維結構的“菜花狀”涂層形貌更有利于電極伏安電荷量提高以及膜阻抗的降低.
3.2 綜合電化學性能與穩定性,優選出0.2A/cm2電流密度下制備的PbO2電極用于后續AMX電催化降解.隨水體中AMX 濃度升高,斜生柵藻的藻細胞生長受到抑制,但對于葉綠素的合成呈現“低濃度促進,高濃度抑制”效果.
3.3 AMX 電催化降解過程中,斜生柵藻的生長受抑制程度(96h)先升高后降低,TELItotal值由最初1.54升至2.61,并經150min的持續電催化降為1.63.AMX在電催化降解中造成的細胞氧化應激與蛋白質應激最為明顯,推測AMX 電催化降解產生的中間體對細胞中相關蛋白酶與氧化還原反應產生較大刺激所致.

