利巴韋林抗酪氨酸酶活性及其在貢梨中的保鮮應(yīng)用
鄧維良,柴緯明,羅麟霜
(江西師范大學(xué) 生命科學(xué)學(xué)院,功能有機(jī)小分子教育部重點(diǎn)實(shí)驗(yàn)室,江西 南昌,330022)
酪氨酸酶(EC 1.14.18.1),又稱為多酚氧化酶,廣泛存在于植物、動(dòng)物和微生物當(dāng)中[1-2]。在植物當(dāng)中,酪氨酸酶可催化酚類物質(zhì)氧化生成醌類物質(zhì),再經(jīng)過聚合作用形成引起褐變的色素物質(zhì)[3-4]。在許多食品(如水果、果汁、蔬菜等)中,這一過程直接影響產(chǎn)品的自然外觀和營養(yǎng)價(jià)值,進(jìn)而降低產(chǎn)品的經(jīng)濟(jì)價(jià)值。因此,抑制酪氨酸酶活性,可有效減緩酶促褐變的發(fā)生,高效安全的酪氨酸酶抑制劑可以維持果蔬品質(zhì)并延長其貨架期。迄今為止,已有文獻(xiàn)報(bào)道了部分酪氨酸酶抑制劑,但不論是天然的還是有機(jī)合成的化合物,安全性差、活性低、溶解性差等諸多原因限制了其在食品工業(yè)中的應(yīng)用[5-6]。因此,尋找新型的酪氨酸酶抑制劑仍是當(dāng)下食品領(lǐng)域的研究熱點(diǎn)。
1,2,4-三唑是含有3個(gè)氮原子的五元芳香雜環(huán)化合物,其獨(dú)特的富電結(jié)構(gòu)使得其衍生物能夠很好地與酶和生物受體相結(jié)合,從而表現(xiàn)出廣泛的生物活性。研究表明1,2,4-三唑的衍生物能夠有效地抑制酪氨酸酶活性,并且在芒果的保鮮過程中表現(xiàn)出良好的效果[7-9]。利巴韋林又稱三氮唑核苷,化學(xué)名為1-β-D-呋喃核糖基-1H-1,2,4-三氮唑-3-羧酰胺,具有廣譜的抗病毒活性,可用于治療人的呼吸系統(tǒng)疾病[10]。然而,利巴韋林的抗酪氨酸酶活性及保鮮作用卻從未被研究過。因此,在本研究中使用酶動(dòng)力學(xué)實(shí)驗(yàn)、熒光淬滅實(shí)驗(yàn)、非輻射能量轉(zhuǎn)移和分子對接等手段,探究利巴韋林對酪氨酸酶的抑制作用和抑制機(jī)理。此外,我們還對利巴韋林對貢梨的保鮮效果進(jìn)行了初步研究。本論文的研究結(jié)果可為開發(fā)新型的果蔬保鮮劑提供理論依據(jù)和實(shí)踐基礎(chǔ)。
1 材料和方法
1.1 材料與儀器
蘑菇酪氨酸酶(比酶活力為6 680 U/mg)、L-3,4′-二羥基苯丙氨酸(L-3,4′-dihydroxyphenglalanine,L-DOPA),美國sigma公司;利巴韋林、人血清白蛋白(human serum albumin,HSA)、二甲基亞砜(dimethyl sulfoxide,DMSO),上海阿拉丁試劑公司;貢梨,超市;蒸餾水均為去離子重蒸水;其他試劑均為分析純。
UD-730紫外分光光度計(jì),美國Beckman公司;FluoroMax PLUS 熒光光譜儀,日本Horiba公司;VGT—1860Q超聲波清潔儀,寧波新芝公司;NICO超純水機(jī),中國尼珂公司。
1.2 實(shí)驗(yàn)方法
1.2.1 利巴韋林對酪氨酸酶活性的抑制效果分析
以L-DOPA作為底物,研究利巴韋林對酪氨酸酶活性的抑制效果[11-12]。將利巴韋林溶解于DMSO,初始濃度為3 mmol/L,實(shí)驗(yàn)時(shí)分別稀釋至0.15、0.2、0.25、0.3、0.35 mmol/L。在3 mL的反應(yīng)體系中依次加入0.75 mL 0.1 mol/L磷酸鈉緩沖液(pH 6.8)、0.3 mL 2 mmol/LL-DOPA、0.1 mL利巴韋林溶液和1.8 mL H2O,最后加入0.2 mg/L酪氨酸酶溶液,混勻后立即在475 nm波長下測定初始反應(yīng)速率。以動(dòng)力學(xué)曲線的初始斜率來表示酪氨酸酶的活性,按照公式(1)計(jì)算酪氨酸酶的相對活性。IC50為酶活性被抑制一半(酶的相對活性為50%)時(shí)的抑制劑濃度,IC50越低表明抑制劑對酶的抑制作用越強(qiáng)。

(1)
式中:Us,實(shí)驗(yàn)組(含有不同濃度的利巴韋林)的酶活性;Uc,對照組(不含利巴韋林)的酶活性。
1.2.2 利巴韋林對酪氨酸酶的抑制動(dòng)力學(xué)分析
在以上抑酶效果測定體系中,保持底物L(fēng)-DOPA的濃度不變,改變酪氨酸酶的加入量。通過酶促反應(yīng)速率對酪氨酸酶質(zhì)量濃度作圖來判斷利巴韋林對酪氨酸酶活性的抑制機(jī)制。
在同樣的測定體系中維持酪氨酸酶的濃度不變,改變體系中L-DOPA的濃度,測定酶促反應(yīng)速率。利用Lineweaver-Burk方程進(jìn)行雙倒數(shù)作圖,根據(jù)直線交點(diǎn)的位置來判斷利巴韋林對酪氨酸酶活性的抑制類型[13]。用不同直線的斜率對利巴韋林濃度進(jìn)行二次作圖,可求得利巴韋林對游離酶的抑制常數(shù)KI。
1.2.3 熒光淬滅實(shí)驗(yàn)
利巴韋林對酪氨酸酶的熒光淬滅實(shí)驗(yàn)參照CHAI等[14]的方法。采用Stern-Volmer方程[15]對熒光淬滅的數(shù)據(jù)進(jìn)行分析,如公式(2)所示:
(2)
式中:F和F0分別是酪氨酸酶在有無利巴韋林存在時(shí)的熒光強(qiáng)度;Ksv,Stern-Volmer淬滅常數(shù);Kq,生物分子淬滅速率常數(shù);[c],利巴韋林的濃度;τ0為熒光分子的平均壽命,約為10-8s。此外,對于靜態(tài)淬滅過程,結(jié)合位點(diǎn)的數(shù)量n和表觀結(jié)合常數(shù)KA可以通過公式(3)進(jìn)行計(jì)算[16]:
(3)
1.2.4 非輻射能量轉(zhuǎn)移分析
參照HUANG等[17]的方法,以HSA為標(biāo)準(zhǔn)測量酪氨酸酶的熒光量子產(chǎn)率。利用紫外分光光度計(jì)測定利巴韋林(0.4 mol/L)在300~500 nm的紫外吸收光譜,根據(jù)利巴韋林的紫外吸收光譜和酪氨酸酶的熒光發(fā)射光譜的重疊面積,可計(jì)算出利巴韋林與酪氨酸酶作用過程中的能量轉(zhuǎn)移效率E和結(jié)合距離r,按照公式(4)~(6)[18]進(jìn)行計(jì)算:
(4)
R6=8.79×10-25N-4K2Jφ
(5)
(6)
式中:R0,F(xiàn)?rster距離;F和F0分別為有無利巴韋林存在時(shí)酪氨酸酶的熒光強(qiáng)度,F(xiàn)(λ),在波長λ處的熒光強(qiáng)度;N,介質(zhì)的平均折射率,值為1.336;K2,空間取向因子,值為2/3;ε(λ)是利巴韋林在波長λ處的摩爾吸光系數(shù);φ,酪氨酸酶的熒光量子產(chǎn)率;J,酪氨酸酶的熒光光譜和利巴韋林紫外吸收光譜的重疊積分。
1.2.5 分子對接
從RCSB蛋白數(shù)據(jù)庫(http://www.rcsb.org/)和Pubchem(https://pubchem.ncbi.nlm.nih gov/)中獲得蘑菇酪氨酸酶(PDB entry 2Y9W)和利巴韋林(CID 37542)的晶體結(jié)構(gòu)。對接前除去酪氨酸酶中的溶劑水分子和銅原子,使用 Autodock 4.2進(jìn)行分子對接,選擇結(jié)合能量最低的構(gòu)象作為最終結(jié)果[14]。
1.2.6 利巴韋林對貢梨的保鮮效果
選擇形狀、顏色、大小和成熟度均相同,無任何損傷的貢梨。將其經(jīng)去皮處理后,切成形狀和大小相同、厚度5 mm左右的梨塊,在不同濃度的利巴韋林溶液中浸泡10 min后裝入聚乙烯袋中,置于15 ℃、相對濕度為80%的培養(yǎng)箱中貯藏[19]。每天稱量梨塊的質(zhì)量,并按照公式(7)計(jì)算失重率:
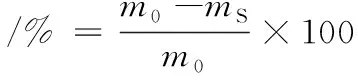
(7)
式中:m0為初始梨塊質(zhì)量,g;ms為每天測量的梨塊質(zhì)量,g。
參照LIU等[20]的方法,使用貢梨梨汁來研究利巴韋林的抗褐變效果。將貢梨去皮處理后切成質(zhì)量為10 g的梨塊,用不同濃度的利巴韋林溶液浸泡10 min后研磨成勻漿,4 ℃下8 000 r/min離心5 min,收集上清液3 mL。梨汁置于15 ℃、相對濕度為80%的培養(yǎng)箱中貯藏。用紫外分光光度計(jì)每天測量梨汁在420 nm處的吸光度值,每次測量重復(fù)3次。
1.2.7 數(shù)據(jù)統(tǒng)計(jì)
所有實(shí)驗(yàn)平行重復(fù)3次,實(shí)驗(yàn)數(shù)據(jù)以平均值±標(biāo)準(zhǔn)差的形式表示。使用Duncan多重比較法檢驗(yàn)數(shù)據(jù)之間的差異顯著性(P<0.05)。采用Origin 2017軟件進(jìn)行數(shù)據(jù)處理、繪圖和曲線擬合。
2 結(jié)果與討論
2.1 利巴韋林對酪氨酸酶的抑制效果
如圖1所示,隨著利巴韋林濃度的增加,酪氨酸酶的相對活性逐漸降低,其導(dǎo)致酪氨酸酶活力下降至一半的濃度(IC50)為(0.3±0.05)mmol/L;當(dāng)利巴韋林濃度達(dá)到0.4 mmol/L時(shí),酶的相對活力下降到26.8%。以上結(jié)果說明利巴韋林能夠有效抑制酪氨酸酶的活性,與目前已經(jīng)報(bào)道的酪氨酸酶抑制劑,如阿莫西林[12](IC50= 0.9 mmol/L)、熊果苷[21](IC50= 2.7 mmol/L)相比,利巴韋林是一種相對高效的酪氨酸酶抑制劑。

圖1 利巴韋林對酪氨酸酶的抑制效果Fig.1 Inhibitory effect of ribavirin on tyrosinase
2.2 利巴韋林對酪氨酸酶的抑制機(jī)理分析
抑制機(jī)理分析的結(jié)果表明:在不同濃度利巴韋林存在下,酪氨酸酶活性對酶質(zhì)量濃度作圖得到一組過坐標(biāo)原點(diǎn)的直線(圖2)。隨著利巴韋林濃度的增加,直線1~6的斜率逐漸下降,這說明利巴韋林對酪氨酸酶的抑制作用是一個(gè)可逆的過程,并沒有降低酪氨酸酶的總量,而僅僅是抑制了酪氨酸酶的催化活性。
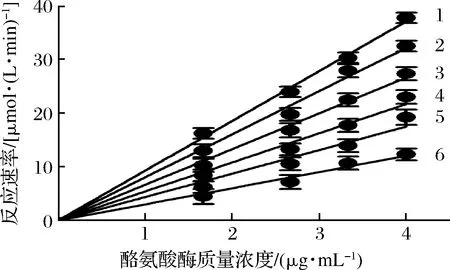
圖2 利巴韋林對酪氨酸酶的抑制機(jī)制Fig.2 Inhibitory mechanism of ribavirin on tyrosinase注:直線1~6利巴韋林濃度分別為0、0.15、0.2、0.25、0.3、0.35 mmol/L
2.3 抑制類型和抑制常數(shù)分析
采用Lineweaver-Burk方程來判斷利巴韋林對酪氨酸的抑制類型。以酶促反應(yīng)速率倒數(shù)1/v對底物濃度倒數(shù)1/S作圖,其結(jié)果如圖3-a所示。隨著利巴韋林濃度的增大,直線斜率逐漸增大,且所有直線均相交于縱軸,這表明利巴韋林是一種競爭型的酪氨酸酶抑制劑,可以與底物L(fēng)-DOPA競爭酶的活性中心。此外,以直線斜率對利巴韋林濃度進(jìn)行二次作圖,得到一條具有良好線性關(guān)系的直線(圖3-b),這表明利巴韋林在酪氨酸酶上只有一個(gè)或者一類結(jié)合位點(diǎn),通過計(jì)算得到抑制常數(shù)KI為(0.144±0.02) mmol/L。
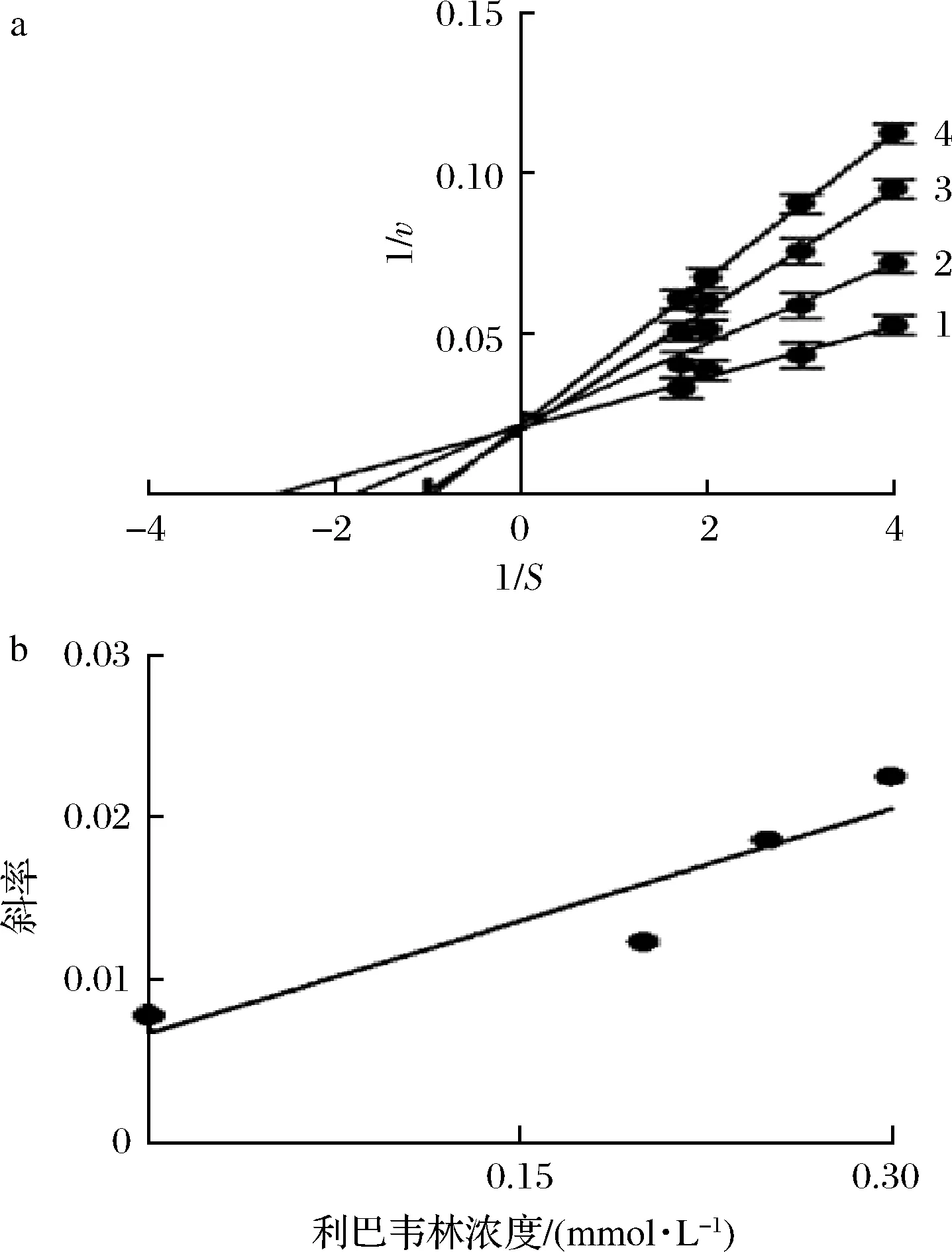
a-抑制類型;b-抑制常數(shù)圖3 利巴韋林對酪氨酸酶的抑制類型和抑制常數(shù)Fig.3 Inhibitory type and inhibition constant of ribavirin on tyrosinase注:直線1~4的利巴韋林濃度分別為0、0.15、0.2、0.3 mmol/L
2.4 熒光淬滅分析
如圖4-a所示,曲線7代表5 μmol/L利巴韋林的熒光發(fā)射光譜,曲線1~6對應(yīng)的利巴韋林濃度分別為0、0.5、1、2、3和5 μmol/L,以及酪氨酸酶的熒光發(fā)射光譜。結(jié)果表明,隨著利巴韋林濃度的增加,酪氨酸酶的熒光強(qiáng)度顯著下降(P<0.05),當(dāng)利巴韋林的濃度為5 μmol/L時(shí),酪氨酸酶熒光發(fā)射光譜的峰值降低到59.8%(圖4-b),這說明利巴韋林可有效淬滅酪氨酸酶的內(nèi)源熒光。KIM等[22]的研究發(fā)現(xiàn),抑制劑中的羥基是淬滅酶內(nèi)源熒光的主要基團(tuán),進(jìn)而推測利巴韋林主要通過其呋喃環(huán)上的羥基與酪氨酸酶發(fā)生作用從而淬滅酶的熒光。此外,隨著利巴韋林濃度的增加,酪氨酸酶發(fā)射熒光光譜的峰值發(fā)生了明顯的紅移(由325 nm變?yōu)?35 nm),這表明利巴韋林可通過與酪氨酸酶的相互作用導(dǎo)致酶構(gòu)象的改變[23]。
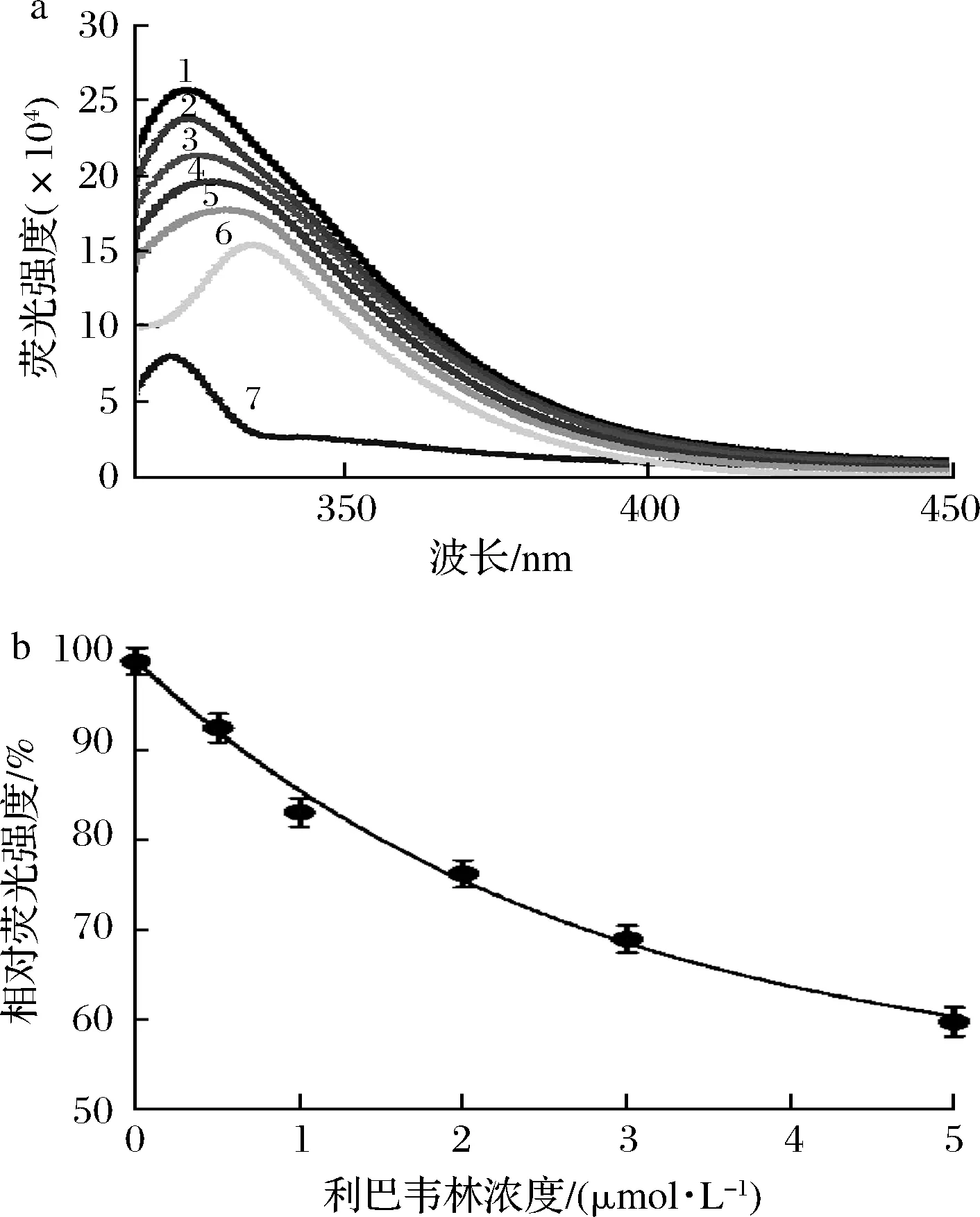
a-酪氨酸酶熒光光譜圖;b-酪氨酸酶相對熒光強(qiáng)度變化圖4 熒光淬滅實(shí)驗(yàn)結(jié)果Fig.4 Results of fluorescence quenching experiment注:曲線1~6的利巴韋林濃度分別為0、0.5、1、2、3、5 μmol/L,曲線7為5 μmol/L利巴韋林溶液的熒光光譜
本研究采用Stern-Volmer方程對淬滅結(jié)果進(jìn)行分析,如圖5-a所示,F0/F對利巴韋林濃度[c]作圖得到了一條具有良好線性關(guān)系的直線,這表明利巴韋林對酪氨酸酶的淬滅機(jī)制只有1種[24]。根據(jù)公式(2)可進(jìn)一步計(jì)算出淬滅速率常數(shù)Kq的值為1.27×1013L/(mol·s),這比最大散射碰撞淬滅常數(shù)2.0×1010L/(mol·s)高出3個(gè)數(shù)量級[25]。以上結(jié)果表明利巴韋林淬滅酶熒光的機(jī)制為靜態(tài)淬滅。
對于靜態(tài)淬滅,可根據(jù)公式(3)計(jì)算出表觀結(jié)合常數(shù)KA和結(jié)合位點(diǎn)數(shù)n。以lg[(F0-F)/F]對lg[c]作圖,根據(jù)所得直線(圖5-b)的斜率和截距,計(jì)算得到KA和n分別為(16.29±0.94)×104L/mol和0.92±0.04。其中,結(jié)合位點(diǎn)數(shù)n約等于1,表明利巴韋林在酪氨酸酶只存在1個(gè)結(jié)合位點(diǎn)。
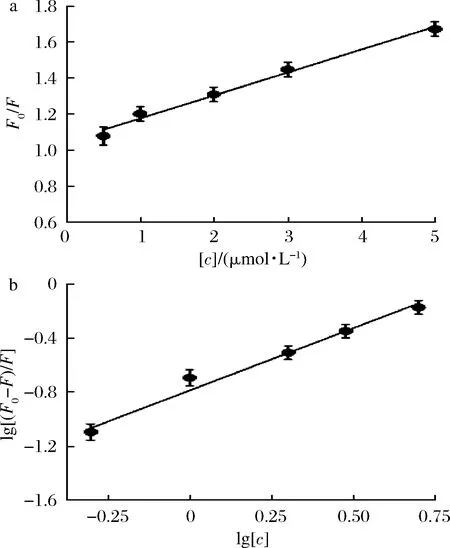
a-Stern-Volmer 方程繪圖曲線;b-lg[(F0-F)/F]對lg [c]線性回歸曲線圖5 Stern-Volmer 方程繪圖曲線和lg [(F0-F)/F] 對lg [c]線性回歸曲線Fig.5 Stem-Volmer plot of fluorescence quenching and the plot of lg[(F0-F)/F] against lg [c]
2.5 非輻射能量轉(zhuǎn)移分析
以HSA為對照,測得酪氨酸酶的熒光量子產(chǎn)率為0.06。酪氨酸酶熒光發(fā)射光譜與利巴韋林紫外吸收光譜重疊如圖6所示。通過公式(6)計(jì)算出重疊積分J為4.96×10-19(cm3·L)/ mol。根據(jù)公式(4)和(5)分別計(jì)算出能量轉(zhuǎn)移效率E等于0.4,結(jié)合距離r和臨界距離R0分別為1.15 nm和1.08 nm,其中0.5R0 1-酪氨酸酶熒光光譜;2-利巴韋林吸收光譜圖6 酪氨酸酶熒光光譜和利巴韋林吸收光譜的重疊面積Fig.6 The overlap of fluorescence spectrum of tyrosinase and the absorption spectrum of ribavirin 對接結(jié)果如圖7所示,圖7-a顯示了利巴韋林和酪氨酸酶活性中心的結(jié)合模式,可以看出利巴韋林能夠很好地嵌入到酪氨酸酶的活性口袋。進(jìn)一步分析了利巴韋林與酪氨酸酶活性口袋處的氨基酸殘基的結(jié)合情況,從圖7-b可以看出,利巴韋林呋喃環(huán)上所連接的羥基,可與和酪氨酸酶B鏈上Lys379、Glu356、Gln307形成氫鍵,測得間距分別為0.21、0.3、0.22 nm。而連接在1,2,4-三唑雜環(huán)上的羧酰胺基,則與B鏈的Asp312、Val313、Asn310形成氫鍵,其間距分別為0.2、0.23和0.23 nm。分子對接的結(jié)果表明,利巴韋林可以強(qiáng)有力地結(jié)合到酪氨酸酶的活性中心,并與周圍的氨基酸殘基形成氫鍵。 a-酪氨酸酶和利巴韋林對接模型;b-利巴韋林和酪氨酸酶氨基酸殘基形成氫鍵圖7 利巴韋林(藍(lán)色)和酪氨酸酶分子對接結(jié)果Fig.7 Molecular docking results of ribavirin and tyrosinase 不同濃度的利巴韋林對貢梨鮮切梨塊和梨汁的保鮮作用如圖8所示,其中曲線1~5的利巴韋林濃度依次為0、0.04、0.2、0.4和0.8 mmol/L。 a-利巴韋林對鮮切梨塊失重率的影響;b-利巴韋林對梨汁褐變度的影響圖8 利巴韋林對貢梨的保鮮效果Fig.8 Effect of ribavirin on the preservation of Gong pear注:曲線1~5的利巴韋林濃度為0、0.04、0.2、0.4、0.8 mmol/L 由圖8可知,隨著貯藏時(shí)間的延長,梨塊的失重率和梨汁的褐變度均呈上升趨勢。但隨著利巴韋林濃度的增加,相較于空白對照組,梨塊的失重率和梨汁的褐變程度均顯著下降(P<0.05),當(dāng)利巴韋林濃度為0.8 mmol/L時(shí),梨塊的失重率減小至對照組的44.8%。由此可知,利巴韋林在貢梨保鮮過程中能夠顯著降低失重率和減少褐變產(chǎn)物的生成。LIN等[19]的研究發(fā)現(xiàn),奧美拉唑可有效抑制鮮切蘋果中的多酚氧化酶活性,從而抑制褐變的發(fā)生。由此,可推測利巴韋林可抑制貢梨當(dāng)中的多酚氧化酶活性,從而減緩貢梨當(dāng)中酚類物質(zhì)的氧化。 利巴韋林是一種高效的酪氨酸酶抑制劑,其IC50為(0.3±0.05)mmol/L,且利巴韋林抑制酪氨酸酶屬于可逆、競爭性抑制。利巴韋林可與酪氨酸酶通過1個(gè)結(jié)合位點(diǎn)形成“利巴韋林-酶”靜態(tài)復(fù)合物,從而淬滅酪氨酸酶的內(nèi)源熒光,這一過程伴隨著非輻射能量轉(zhuǎn)移和酶構(gòu)象的改變。利巴韋林可嵌入到酪氨酸酶的活性口袋并與周圍的6個(gè)氨基酸殘基形成氫鍵。利巴韋林對于貢梨具有很好的保鮮效果,能夠有效地降低鮮切梨塊的失重率和梨汁的褐變程度。本論文的研究結(jié)果為開發(fā)新型的果蔬保鮮劑提供了理論依據(jù)和實(shí)踐基礎(chǔ)。
2.6 分子對接分析

2.7 貢梨保鮮實(shí)驗(yàn)

3 結(jié)論

