蛻膜巨噬細胞調控滋養細胞侵襲力的研究
沙曉燕?伍彬升?鮑俊杰?劉慧姝


【摘要】目的 探討蛻膜巨噬細胞對滋養細胞侵襲力的調控。方法 取20 ~ 35歲女性正常早孕(6 ~ 7+6周)行人工流產的蛻膜組織15 ~ 20 g。將蛻膜組織充分清洗后使用Collagenase和Dnase消化2次,每次30 min,細胞懸液過濾后通過CD14+免疫磁珠分選,并行免疫熒光鑒定。流式細胞儀分析巨噬細胞M1型(CD80+和CD86+)和M2型(CD163+和CD206+)。獲得的巨噬細胞置于6孔板培養,24 h后收集細胞上清。巨噬細胞上清與滋養細胞系HTR-8/SVneo共培養24 h,實時定量PCR檢測HTR-8/SVneo的水通道蛋白1(AQP 1)mRNA相對表達量變化,以及基質金屬蛋白酶-2(MMP-2)和MMP-9 mRNA相對表達量的變化。應用實時無標記細胞分析技術(RTCA)檢測人早孕蛻膜巨噬細胞上清對人滋養層細胞系HTR-8/SVneo侵襲力的影響。結果 成功建立人類早孕蛻膜巨噬細胞體外培養體系。流式細胞檢測顯示,人類正常早孕蛻膜組織中巨噬細胞以M2型為主,約占全部巨噬細胞的87%。巨噬細胞上清使HTR-8/SVneo的AQP 1和MMP-9 mRNA相對表達量升高(P均< 0.001)。RTCA結果顯示巨噬細胞上清明顯增強HTR-8/SVneo的侵襲力(P < 0.001)。結論 體外培養條件下,蛻膜巨噬細胞可能通過介導AQP1表達升高而增強滋養細胞的侵襲力。
【關鍵詞】蛻膜巨噬細胞;水通道蛋白1;滋養細胞侵襲力;實時無標記細胞分析
Study of the regulation of trophoblast invasion by decidual macrophages Sha Xiaoyan, Wu Binsheng, Bao Junjie, Liu Huishu. Department of Obstetrics, Preterm Birth Prevention and Treatment Research Unit, Guang-zhou Women and Childrens Medical Center, Guangzhou Medical University, Guangzhou 510623, China
Corresponding author, Liu Huishu, E-mail: liuhuishu@ gwcmc. org
【Abstract】Objective To investigate the regulatory effect of decidual macrophages on the invasion of trophoblast. Methods Decidual tissues (15-20 g) were collected from clinically normal first trimester (6 - 7+6 weeks) pregnant women (20-35 years old) who underwent elective termination of pregnancy for non-medical reasons. Freshly-collected decidual tissues were rinsed with PBS and digested with collagenase Type IV and DNase I for 30 min twice. Macrophages were purified using a Ficoll-Hypaque gradient followed by CD14+ selection using magnetic beads, and identified by immunofluorescence. The percentage of M1 macrophages (CD80 and CD86) and M2 macrophages (CD163 and CD206) were analyzed by flow cytometry. The macrophages were cultured in a 6-well plate and the supernatant was collected 24 h later. The macrophage supernatant was co-cultured with trophoblast cell line HTR-8/SVneo for 24 h. The changes in the relative expression of AQP1 in HTR-8/SVneo as well as those of matrix metalloproteinase 2 (MMP2) and MMP9 were detected by real-time quantitative PCR. Real-Time Cell Analysis was used to evaluate the effect of macrophage supernatant on the invasiveness of HTR-8/SVneo. Results An in vitro cell culture system of human early pregnant decidual macrophages was established. Flow cytometry results showed that M2 macrophages were predominant in normal early pregnant decidual tissues, accounting for approximately 87%. Macrophage supernatant significantly up-regulated the expression levels of AQP 1 and MMP 9 in HTR-8/SVneo (both P < 0.001). RTCA demonstrated that macrophage supernatant significantly enhanced the invasiveness of HTR-8/SVneo (P < 0.001). Conclusion Decidual macrophages may enhance the trophoblast invasiveness by mediating the up-regulated expression of AQP 1 in vitro.
【Key words】Decidual macrophage;Aquaporin 1;Trophoblast invasion;Real-time cell analysis
胎盤滋養細胞侵襲力異常可引起流產、子癇前期/子癇、胎兒生長受限、妊娠滋養細胞疾病、胎盤植入等妊娠相關性疾病[1]。巨噬細胞在母胎界面免疫狀態的形成和維持中發揮了重要的調控作用[2]。巨噬細胞如果發生分化異常、亞群平衡失調或功能異常時,也會導致流產、子癇前期、胎兒生長受限等病理妊娠及不良妊娠結局[3]。母胎界面巨噬細胞等免疫細胞可能調控滋養細胞的侵襲,但具體機制不清。多項研究顯示,水通道蛋白1(AQP1)不僅調控多種細胞的水通透性,而且介導病理生理變化過程中的細胞遷移及侵襲[4]。本研究探討蛻膜巨噬細胞對滋養細胞侵襲力的調控,旨在為滋養細胞侵襲力異常相關疾病的研究提供新的思路,現報告如下。
材料與方法
一、材 料
1. 蛻膜組織
2018年7至12月在本院計劃生育門診要求人工流產、孕6 ~ 7+6周的正常妊娠婦女(20 ~ 35歲)13例,取其人工流產術后的蛻膜組織。入組者既往月經規律,無自然流產等不良孕產史,無內科合并疾病,本次妊娠期間無陰道異常出血,B超檢查提示胚胎發育正常。所有操作已通過廣州市婦女兒童醫療中心倫理委員會審批,入組者均已簽署知情同意書。
2. 主要設備
包括低溫冰箱(Baxter,美國),恒溫水浴箱(上海森信實驗儀器有限公司,中國),微量加液器(Eppendoff,德國),生物顯微鏡(Olympas BX 50,日本),臺式高速離心機(上海安亭科學儀器廠, 中國),CO2細胞培養箱(Eppendorf公司,德國), 免疫磁珠細胞分選(MACS)分離器(Mihenyi Biotec, 德國), MACS分離柱(Miltenyi Biotec, 德國),流式細胞儀(BD FACS Canto, 美國),iCelligence實時細胞功能分析儀DP(ACEA, 美國),熒光定量PCR儀Mx3000P(Agilent Stratagene, 美國)。
3. 主要材料
滋養細胞系HTR-8/SVneo由Gendie Lash 教授贈送,購于ATCC。其他材料包括胎牛血清(Gibco公司, 美國),DMEM/F12培養基(Gibco公司, 美國),0.25%胰酶-乙二胺四乙酸(EDTA)溶液(Gibco公司,美國),RPMIl640(Sigma公司,德國),CD14一抗(Sigma公司,德國),CY3-兔抗鼠二抗(Sigma公司, 德國),MACS抗CDl4抗體磁珠(Miltenyi Biotec, 德國),CD14 PerCP、HLA-DR APC、CD80 FITC、CD86 PE-Cy7、CD163 BV421、CD206 PE流式抗體(BD公司, 美國),基質膠(Corning公司, 美國)。
二、實驗方法
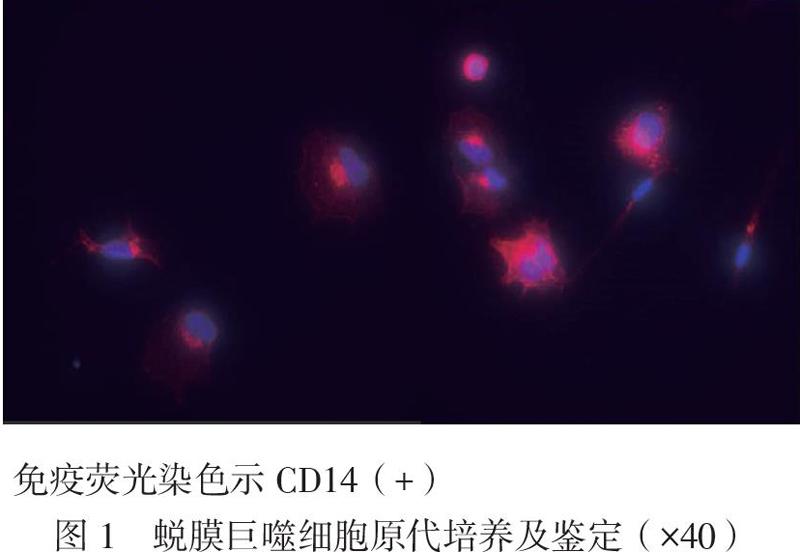
1. 蛻膜巨噬細胞原代培養及鑒定
收集蛻膜組織15 ~ 20 g,生理鹽水充分清洗,去除殘留血塊。將蛻膜切成小塊組織,轉移至含有15 ml 消化液(含膠原酶1 g/L和DNA酶 0.04 kU/L)的50 ml離心管中。將離心管置于MACS 轉子上,配平,轉動30 min。取出離心管,靜置2 ~ 3 min使組織沉淀。取40 μm細胞篩過濾組織上清液。重復消化2 ~ 3次。已過濾的組織上清液500×g離心5 min,棄上清。加入15 ml含10%胎牛血清的RPMI1640完全培養基,置于T75培養瓶中培養過夜,備用(13例組織中蛻膜細胞培養成功10例)。
次日將T75培養瓶中的貼壁細胞轉移至離心管中,500×g離心5 min;用180 μl預冷的MidiMACS緩沖液重懸細胞沉淀,加入20 μl CD14磁珠,置于4℃冰箱孵育15 min。將MACS磁柱固定在分離器上,提前用1 ml MidiMACS緩沖液將柱子潤濕。取800 μl預冷的MidiMACS緩沖液加入細胞中。細胞過柱,加入1 ml MidiMACS緩沖液清洗磁柱,重復3次,直至濾液澄清。收集磁柱上的細胞,500×g離心5 min,RPMI1640完全培養基重懸細胞沉淀,置于37℃、5%CO2的培養箱內培養。免疫熒光鑒定后將蛻膜巨噬細胞傳代于6孔板中,每孔1×106個細胞,加入2 ml含10%胎牛血清的RPMI1640培養液,置于細胞培養箱內培養24 h,收集細胞上清備用。
2. 流式細胞儀檢測蛻膜巨噬細胞分型
次日取T75培養瓶中約1×106個貼壁細胞進行流式細胞儀檢測,CD14和HLA-DR標記蛻膜巨噬細胞,CD80和CD86標記M1型蛻膜巨噬細胞,CD163和CD206標記M2型蛻膜巨噬細胞。
3. 滋養細胞系HTR-8/SVneo的表達變化檢測
滋養細胞HTR-8/SVneo傳代于6孔板,每孔3×106個細胞,DMEM/F12完全培養基培養。細胞貼壁后更換培養基并分組,對照組予1/2 DMEM/F12完全培養基+1/2 RPMI1640完全培養基,實驗組予1/2 DMEM/F12完全培養基+1/2巨噬細胞上清。培養24 h后分別收集細胞,實時定量PCR檢測AQP 1和基質金屬蛋白酶-2(MMP-2)、MMP-9表達的變化,引物序列見表1,2-△△Ct法計算目的基因mRNA相對表達量。
4. 滋養細胞侵襲力檢測
應用xCELLigence DP多功能實時無標記細胞分析(RCTA)儀,使用CIM檢測板檢測滋養細胞侵襲力。CIM下室鋪基質膠20 μl,放入細胞培養箱4 ~ 6 h,待基質膠完全凝固后方可用于實驗。根據CIM下室分組,對照組予85 μl DMEM/F12完全培養基+80μl RPMI1640完全培養基;實驗組予85 μl DMEM/F12完全培養基+80 μl巨噬細胞上清液。CIM上室與下室組合,上室加入30 μl無血清DMEM/F12培養基,置于37?C、5% CO2的培養箱平衡1 h,置于DP 系統上進行基線測量。上室加入100 μl無血清DMEM/F12 HTR-8/SVneo細胞懸液,每孔細胞數目為5×104個,均平行設置復孔。室溫放置30 min后放入培養箱的儀器上,每15 min監測并記錄細胞指數值(CI,CI越高代表穿過基質膠的細胞數量越多,即細胞的侵襲力越高),連續觀察48 h。
三、統計學處理
采用 SPSS 23.0對數據進行統計學處理及分析。計量資料均符合正態分布,以表示,組間比較采用t檢驗。P < 0.05 為差異有統計學意義。
結果
一、蛻膜巨噬細胞原代培養及鑒定
應用MACS分離人類早孕蛻膜巨噬細胞,可得到活性較高的巨噬細胞。應用免疫熒光方法進行巨噬細胞CD14抗體的再次鑒定,確定所分離的細胞為蛻膜巨噬細胞,見圖1。
二、蛻膜巨噬細胞的M1、M2分型
應用流式細胞儀進行巨噬細胞的分型鑒定,人類早孕蛻膜巨噬細胞中以M2型為主,約占全部巨噬細胞的87%,見圖2。
三、滋養細胞系HTR-8/SVneo的AQP1、MMP-2、MMP-9 mRNA相對表達量變化
實驗組蛻膜巨噬細胞上清液與滋養細胞共培養后,滋養細胞AQP1 mRNA及MMP-9 mRNA相對表達量均比對照組升高(P均< 0.001),MMP-2表達無明顯變化(P > 0.05),見圖3和表2。
四、蛻膜巨噬細胞對滋養細胞系HTR-8/SVneo侵襲力的影響
RCTA顯示,實驗組的CI值更高,即巨噬細胞上清液使人滋養層細胞系HTR-8/SVneo的侵襲力更強(見圖4)。滋養細胞系HTR-8/SVneo實時監測48 h,實驗組CI值為2.52±0.15,對照組為1.63±0.13,實驗組CI值高于對照組(t = 13.652,P < 0.001)。
討論
滋養細胞侵襲和遷移至子宮的分子機制目前尚不清楚,但多項研究顯示其侵襲過程是分子和細胞的相互作用調節,受滋養細胞本身和母胎界面微環境的精細調控。生理妊娠情況下,巨噬細胞普遍存在于母胎界面,蛻膜巨噬細胞主要參與蛻膜化的進程,促進母胎免疫耐受環境形成、協助滋養細胞侵入和螺旋動脈形成等。但蛻膜巨噬細胞和滋養細胞的生物學行為調控機制尚不清楚。本研究通過體外培養人早孕蛻膜巨噬細胞,證實早孕蛻膜組織中主要為M2 型巨噬細胞;并將蛻膜巨噬細胞在體外條件下與滋養細胞共培養,結果顯示巨噬細胞可增強滋養細胞的侵襲力,而滋養細胞的AQP1及MMP-9表達升高。
巨噬細胞按照其表型和分泌的細胞因子可以分為2種極化類型,即經典活化的M1 型和選擇性活化的M2型巨噬細胞[5]。母胎界面中的巨噬細胞主要為M2型,分泌高水平的抑制性細胞因子IL-10,低表達促炎性細胞因子IL-1β,因而有利于維持免疫耐受及正常妊娠狀態。妊娠期疾病或者母胎界面微環境的變化可使M1型和M2型巨噬細胞發生相互轉化。Li等[3]的研究顯示,子癇前期孕婦蛻膜中巨噬細胞數量偏高,且粒細胞-巨噬細胞集落刺激因子(GM-CSF)表達過量;而GM-CSF 可誘導巨噬細胞向M1型極化[6]。因此,研究者認為M1 型巨噬細胞與子癇前期的發生密切相關。另一研究報道中,胎盤巨噬細胞CD74缺失后,活化的巨噬細胞向M1型轉變,且高表達TNF-α、MCP-1等,而CD74基因敲除小鼠的子宮變小,螺旋動脈重塑受阻,并出現胚胎生長受限,研究者認為巨噬細胞向促炎方向的活化改變,干擾了滋養細胞的正常功能,導致病理妊娠[7]。
研究顯示AQP1不僅調控多種細胞的水通透性,而且介導病理生理變化過程中的細胞遷移及侵襲[4, 8]。Mu等[9]研究顯示,AQP1在大鼠膠原誘導的關節炎中表達升高,AQP1 siRNA通過抑制β-catenin信號傳導通路抑制關節炎成纖維樣滑膜細胞的增殖、遷移和侵襲。Shu等[10]對子宮內膜異位癥小鼠進行研究,結果顯示AQP1在子宮內膜異位癥中呈高表達,通過siRNA抑制AQP1基因表達使子宮內膜細胞黏附和侵襲能力增強,細胞凋亡增加,且血管生成受到抑制。
本研究通過體外培養人早孕蛻膜巨噬細胞,證實早孕蛻膜巨噬細胞中主要為M2型巨噬細胞,蛻膜巨噬細胞在體外條件下與滋養細胞共培養,結果顯示巨噬細胞可增強滋養細胞的侵襲力,而滋養細胞的AQP1及MMP-9表達升高。因此,蛻膜巨噬細胞在體外培養條件下可促進滋養細胞的侵襲,這可能與調控滋養細胞AQP1的表達有關。至于是否能通過調節蛻膜巨噬細胞的活性來調節滋養細胞AQP1 的表達,進而調控滋養細胞的侵襲,預防胎盤發育異常相關疾病,還需進一步探索。
參 考 文 獻
[1] 楊建波, 陳漢青. 胎盤種植異常的產前診斷與預防. 新醫學, 2009, 40(1):9-11.
[2] Ning F, Liu H, Lash GE. The role of decidual macrophages during normal and pathological pregnancy. Am J Reprod Immunol, 2016, 75(3):298-309.
[3] Li M, Piao L, Chen CP, Wu X, Yeh CC, Masch R, Chang CC, Huang SJ. Modulation of decidual macrophage polarization by macrophage colony-stimulating factor derived from first-trimester decidual cells: implication in preeclampsia. Am J Pathol, 2016,186(5):1258-1266.
[4] Sha XY, Liu HS, Ma TH. Osmotic water permeability diversi-fication in primary trophoblast cultures from aquaporin 1-deficient pregnant mice. J Obstet Gynaecol Res, 2015, 41(9):1399-1405.
[5] Brown MB, von Chamier M, Allam AB, Reyes L. M1/M2 macrophage polarity in normal and complicated pregnancy. Front Immunol, 2014, 5:606.
[6] Weiss G, Sundl M, Glasner A, Huppertz B, Moser G. The trophoblast plug during early pregnancy: a deeper insight. Histochem Cell Biol, 2016, 146(6):749-756.
[7] Przybyl L, Haase N, Golic M, Rugor J, Solano ME, Arck PC, Gauster M, Huppertz B, Emontzpohl C, Stoppe C, Bernhagen J, Leng L, Bucala R, Schulz H, Heuser A, Weedon-Fekj?r MS, Johnsen GM, Peetz D, Luft FC, Staff AC, Müller DN, Dechend R, Herse F. CD74-downregulation of placental macrophage-trophoblastic interactions in preeclampsia. Circ Res, 2016, 119(1):55-68.
[8] Tomita Y, Dorward H, Yool AJ, Smith E, Townsend AR, Price TJ, Hardingham JE. Role of aquaporin 1 signalling in cancer development and progression. Int J Mol Sci, 2017, 18(2):299.
[9] Mu YR, Zhou MY, Cai L, Liu MM, Li R. Overexpression of aquaporin 1 in synovium aggravates rat collagen-induced arthritis through regulating β-catenin signaling: an in vivo and in vitro Study. J Inflamm Res, 2020, 13:701-712.
[10] Shu C, Shu Y, Gao Y, Chi H, Han J. Inhibitory effect of AQP1 silencing on adhesion and angiogenesis in ectopic endometrial cells of mice with endometriosis through activating the Wnt signaling pathway. Cell Cycle, 2019, 18(17):2026-2039.
(收稿日期:2020-10-09)
(本文編輯:林燕薇)

