菊花滑刃線蟲RPA 檢測方法研究
林 宇,鞠玉亮,劉 娟,王金成,高 建,鄭春生,魏亞東,黃國明
(1. 天津海關動植物與食品檢測中心,天津 300461;2. 安徽農業大學,安徽 合肥 230036;3. 北京海關技術中心,北京 101300)
菊花滑刃線蟲(Aphelenchoides ritzemabosi)是一種植物專性寄生線蟲,既能以內寄生方式寄生于植物組織內,又能通過外寄生方式附著于植物花、葉、芽生活[1]。該線蟲可寄生于200 種以上高等植物,菊花是其典型危害寄主。其侵染菊花后可引起菊花枯葉病,導致葉片枯死、花芽生長發育受阻或出現畸形。同時該線蟲抗逆性強,在種子、植物組織、介質土壤以及植物病殘體中能夠以休眠或脫水狀態長時間存活,具有較高的遠距離傳播擴散風險[2]。目前,菊花滑刃線蟲已在世界70 個以上國家發生,我國的江蘇、福建、江西、河南、湖北、廣東、廣西、貴州、四川、云南等地也發現其為害,對菊花、草莓、煙草等農作物的生產造成了嚴重影響[3-5]。
伴隨著分子生物學技術的快速發展和廣泛應用,植物寄生線蟲的分類鑒定也從經典的形態學方法拓展到以PCR 為基礎的變溫分子檢測技術和恒溫分子檢測技術,如PCR-RFLP、SCAR 標記、實時熒光PCR、LAMP、DNA 條形碼[6]等,這些鑒定技術為植物線蟲的分類鑒定提供了更可靠、更成熟的手段。重組酶聚合酶擴增(recombinase polymerase amplification,RPA)技術是一種在常溫下進行核酸擴增的方法,屬于等溫核酸體外擴增技術的一類[7]。其原理是利用重組酶與引物形成聚合體,在模板DNA 上搜索與之完全互補配對的DNA 序列,通過單鏈DNA 結合蛋白的作用使模板DNA 解鏈,同時在DNA 聚合酶的作用下,完成復制延伸過程[8]。
目前,RPA 技術已在植物有害生物檢測鑒定方面開展應用研究。魏梅生等[9]建立了番茄細菌性葉斑病菌(Pseudomonas syringae pv. tomato)的RPA 檢測方法,這是我國首次報道該技術的實際應用,DNA檢測靈敏度可達75 fg/μL,與普通PCR 結果相當。張娜等[10]利用RPA 技術構建了葡萄卷葉伴隨病毒3 號(Grapevine leafroll-associated virus 3 , GLRaV-3)的 快速檢測方法,將該項技術首次應用于葡萄病毒鑒定檢測。Ju 等[11]運用RPA 技術對根結線蟲屬(Meloidogyne spp.)中南方根結線蟲(M. incognita)、花生根結線蟲(M. arenaria)、爪哇根結線蟲(M. javanica)、象耳豆根結線蟲(M. enterolobii)4 個近似種成功實現快速檢測與區分。筆者擬利用RPA 技術,建立一種簡便高效的菊花滑刃線蟲檢測方法,為口岸植物檢疫快速通關、農業線蟲病害田間診斷提供更好的技術支持。
1 材料與方法
1.1 試驗材料
用于試驗的線蟲種群共計12 個,其中菊花滑刃線蟲種群2 個、水稻干尖線蟲(Aphelenchoides besseyi)種群3 個、內卷滑刃線蟲(Aphelenchoides involutus)種群1 個、雙尾擬滑刃線蟲(Aphelenchoides bicaudatus)種群1 個、真滑刃線蟲種群(Aphelenchus avenae)1 個、傘滑刃屬線蟲(Bursaphelenchus)種群2 個以及未知種群2 個。所有線蟲種群均由天津海關動植物與食品檢測中心植檢實驗室收集保存(表1)。
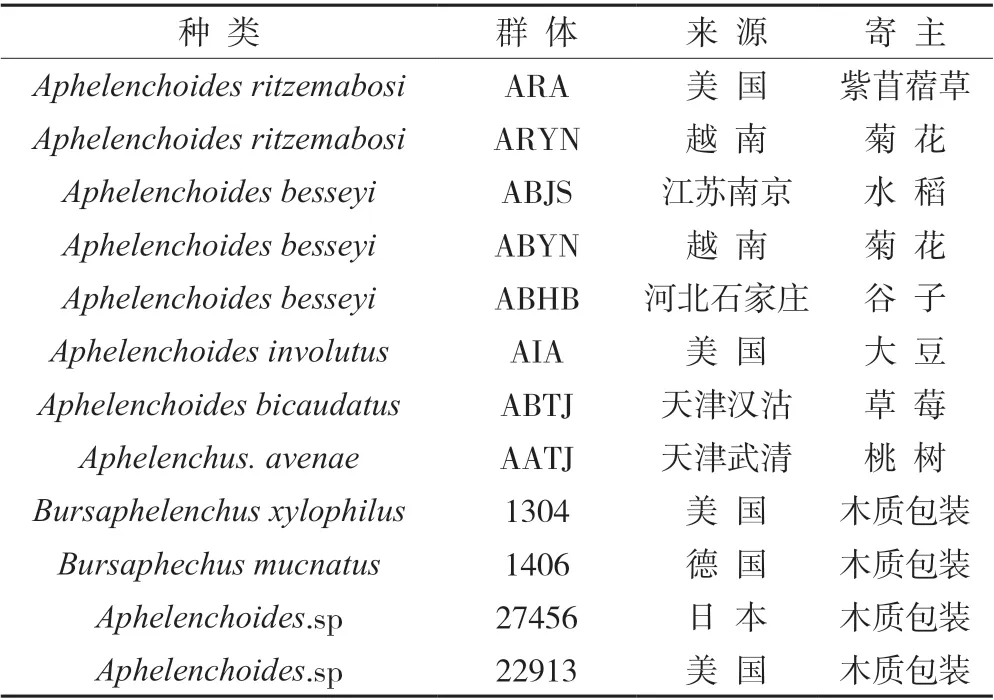
表1 試驗線蟲種群來源
主要試劑有TwistAmp Basic 試劑盒(TwistDx)、dNTPs、Taq DNA 聚 合 酶、10x PCR Buffer(Mg2+)、DL2000,均購于寶生物工程(大連)有限公司;28S rRNA-D2/D3 區通用引物 D2A/D3B 與RPA 特異性檢測引物 AR-R-F/ AR-R-R 由上海生工生物工程技術服務有限公司合成。
1.2 試驗方法
1.2.1 單條菊花滑刃線蟲DNA 提取 用挑針將線蟲置于滴有ddH2O 的載玻片中清洗,清洗后將線蟲轉入PCR 管(已加入8 μL ddH2O),利用昆蟲小型解剖刀在PCR 管中將線蟲蟲體切裂,后加入2 μL 提取裂解液,置于PCR 儀中56 ℃溫浴1 h,95 ℃加熱10 min,離心后獲得的DNA 提取液可直接用于PCR 擴增或放于-20 ℃冰箱留存[12]。
1.2.2 菊花滑刃線蟲28S rRNA-D2/D3 區擴增 利用植物寄生線蟲28S rRNA-D2/D3 區通用引物D2A/D3B擴增菊花滑刃線蟲28S rRNA-D2/D3 序列。PCR 反應體系(25 μL):2×Taq MasterMix 12.5 μL、正反向引物各1 μL(10 μmol/L)、DNA 模板2 μL,ddH2O 補足至25 μL。PCR 擴增反應程序參照王金成等[13]的方法,95℃10 min;95℃30 s,55℃30 s,72℃1 min,39 個循環;72℃10 min,冷卻至室溫。PCR 產物進行電泳檢測后送測序公司進行克隆測序。
1.2.3 RPA 特異性引物設計 檢索Genbank 數據庫中已鑒定到種的滑刃屬線蟲(Aphelenchoides spp.)的28S rRNA-D2/D3 序列進行打包下載,再結合該研究測得的菊花滑刃線蟲群體28S rRNA-D2/D3 核酸序列,利用BioEdit 軟件進行序列比對,分析差異位點,將上述序列導入Primer 6.0 設計出菊花滑刃線蟲RPA 特異性檢測引物。
1.2.4 菊花滑刃線蟲RPA 檢測方法的建立采用設計的RPA 特異性引物AR-R-F(5′- TTCAATGTCGAATAG TCAAGTTAAAGTTATG-3′)/AR-R-R(5′-GAATTTGAC TTATCGTTT CCTTTAAAACACC-3′)對菊花滑刃線蟲進行RPA 特異性測試,同時設置陰性對照(ddH2O)。反應體系(50 μL):線蟲DNA 模板10 μL、干粉溶解緩沖液(rehydration buffer)29.5 μL、引物(10 μmol/L)各2.4 μL、ddH2O 3.2 μL,加280 mmol/L 醋酸鎂2.5 μL 啟動反應。混勻后在PCR 儀中38 ℃溫浴40 min。RPA 擴增反應結束后,加入50 μL 苯酚/氯仿溶液至RPA 擴增產物中充分混勻,放置離心機12 000 r/min 離心2 min,取表面上清液用于凝膠電泳,擴增產物送至測序公司克隆測序。
1.2.5 RPA 檢測方法特異性測試 依據1.2.4 檢測反應體系對菊花滑刃線蟲及其他10 個種群進行RPA 特異性測試,同時設置陰性對照(ddH2O),對建立的RPA 檢測方法特異性進行測試。
1.2.6 RPA 靈敏度測試 提取單條菊花滑刃線蟲DNA, 分 別 稀 釋 為1/5、1/10、1/20、1/40、1/80、1/160、1/320 這7 個濃度梯度,按照1.2.4 檢測反應體系,測試RPA 檢測方法的靈敏度。
2 結果與分析
2.1 菊花滑刃線蟲28S rRNA-D2/D3 區擴增
根據植物寄生線蟲通用引物28S rRNA-D2/D3 區擴增結果(圖1)顯示,研究收集的菊花滑刃線蟲種群均擴增出明亮單一的條帶,陰性對照無條帶出現。經克隆測序后獲得菊花滑刃線蟲28S rRNA-D2/D3 區產物長度為750 bp 左右,結合Genbank 數據庫中下載的滑刃屬線蟲(Aphelenchoides spp.)28S rRNA-D2/D3區序列,綜合分析比對,設計菊花滑刃線蟲RPA 特異性檢測引物。
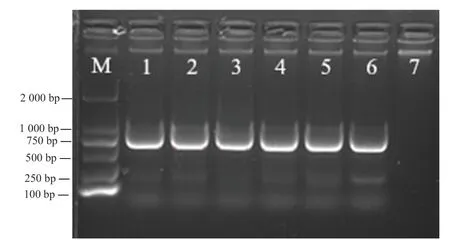
圖1 菊花滑刃線蟲種群28S rRNA-D2/D3 擴增結果
2.2 菊花滑刃線蟲RPA 檢測方法的建立
采用RPA 檢測特異性引物AR-R-F/AR-R-R 對菊花滑刃線蟲DNA 進行擴增,結果如圖2 所示,測序后獲得約202 bp 的特異性片段,與預期目的條帶一致,陰性對照(ddH2O)則無條帶出現,將擴增的特異性片段進行序列比對,與目的片段一致。
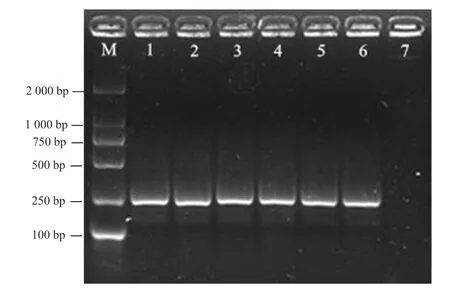
圖2 RPA 方法檢測菊花滑刃線蟲結果
2.3 菊花滑刃線蟲RPA 檢測方法特異性測試
利用RPA 檢測特異性引物AR-R-F/AR-R-R 對菊花滑刃線蟲以及近似種進行特異性測試,結果如圖3 所示,設計的RPA 引物僅能對菊花滑刃線蟲有效,擴增出約202 bp 的特異性目的片段,其余寄生線蟲與陰性對照(ddH2O)則無條帶出現,證明該檢測方法具有較強的特異性。

圖3 菊花滑刃線蟲RPA 方法特異性檢測結果
2.4 RPA 檢測靈敏度測試
對單條線蟲DNA 按1/5、1/10、1/20、1/40、1/80、 1/160、1/320 的比例進行稀釋,然后以稀釋后的DNA為模板進行RPA 檢測,結果如圖4 所示,未稀釋的菊花滑刃線蟲DNA 擴增的特異性條帶明亮清晰;稀釋至1/5~1/80 后,RPA 檢測特異性產物條帶依然質量較高,沒有明顯的減弱;當稀釋至1/160~1/320 時,擴增條帶質量明顯下降,但整體仍可清楚判別。這表明以該研究設計的RPA 特異性引物為基礎建立的菊花滑刃線蟲RPA 檢測體系具有較高的靈敏度。
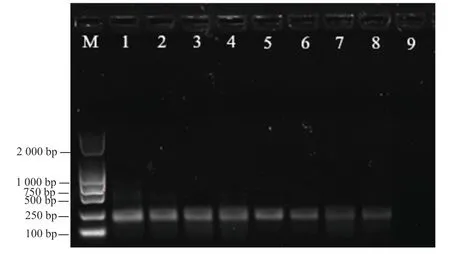
圖4 菊花滑刃線蟲雙重RPA 方法靈敏度檢測結果
3 小結與討論
試驗以菊花滑刃線蟲為對象,利用RPA 技術建立了菊花滑刃線蟲RPA 檢測方法,可特異性檢測菊花滑刃線蟲,產生約202 bp 的特異性片段,對其他近似種線蟲群體呈現陰性。該恒溫擴增檢測方法在38 ℃等溫條件下溫浴40 min 便可完成反應,同常規PCR、SCAR 標記、DNA 條形碼等檢測方法相比較,有效縮短了檢測時間,降低了對PCR 儀的剛性需求,在小型金屬浴設備中也能進行擴增,有利于該方法在基層一線實驗室的布局和推廣。而與等溫擴增技術中的典型代表環介導等溫擴增技術(LAMP)相比,RPA 技術其優勢在于,引物設計簡單,僅需一對引物即可完成擴增,避免了引物設計困難、互相干擾性大、擴增條件需大量實驗摸索、檢測體系不穩定等負面因素,因此RPA 檢測方法的建立與實用更簡便易行。
同時該研究建立的菊花滑刃線蟲RPA 檢測方法具有較高的靈敏度,不僅對單條線蟲提取DNA 實現高效檢測,而且當模板DNA 濃度稀釋為單條線蟲的1/320 時,擴增出的特異性條帶結果依然可以判別。此外,因為RPA 技術對模板DNA 的獨特結合方式,要求特異性引物至少由30~35 個堿基構成,這種長引物與模板DNA 的嚴格互補結合,從而使得RPA 檢測擴增的產物特異性較高,不容易出現假陽性結果。
研究基于RPA 技術建立的菊花滑刃線蟲檢測方法,在有效縮短檢測時間的同時,又能保持較高的靈敏度,為菊花滑刃線蟲的的檢測鑒定提供了一種更為簡便、快捷的方法,對于口岸植物檢疫快速通關、線蟲病害田間調查等應用十分方便。
菊花滑刃線蟲是滑刃屬線蟲中十分重要的植物寄生線蟲,屬于我國檢疫性有害生物[4]。崔汝強等[14]曾利用植物寄生線蟲rDNA-ITS 區序列差異性,設計出特異性引物BSF/ArtR,建立了菊花滑刃線蟲的常規PCR 特異性引物檢測方法,王金成等[15]利用NCBI數據庫滑刃屬線蟲的核糖體28S rRNA-D2/D3 和ITS序列進行系統進化分析得出,28S rRNA-D2/D3 與ITS序列能夠較好地區分大部分滑刃線蟲種類,可作為滑刃屬線蟲DNA 條形碼候選基因,上述方法一定程度上為菊花滑刃線蟲的分子鑒定提供了參考。

