醇沉金蟬花粗多糖對宮頸癌細胞的增殖抑制作用及可能機制
呂萬林,周紅秋,朱益靈,王一姝,魏淵,歐陽臻
(江蘇大學藥學院,江蘇 鎮(zhèn)江 212013)
金蟬花(Cordycepscicadae)又名蟬蛹草、蟬草、蜩、蟬茸等,為麥角菌科真菌蟬草及其寄主山蟬若蟲形成的干燥復合體,其性寒味甘,具有定驚鎮(zhèn)痙,散風熱,眼疾消炎等作用[1]。金蟬花與無性型冬蟲夏草同屬,具有的功能活性組分相似[2],但冬蟲夏草生長在條件嚴苛的青藏高原[3],而金蟬花一般生長于海拔為200~400 m的苦竹林或海拔750~900 m的針闊葉混交林地區(qū),在我國主要分布在江蘇、臺灣、海南、四川、福建、浙江、云南和廣東等地[4]。因此,金蟬花有望成為冬蟲夏草的代用品,改善冬蟲夏草資源稀缺狀況,發(fā)展成為新的保健品、藥品。
現(xiàn)代藥理學研究發(fā)現(xiàn)金蟬花具有肝損傷保護[5]、腎臟保護[6]、抗腫瘤[7]、免疫調(diào)節(jié)[8]、抗氧化[9]、降血糖[10]等多種藥理作用。多糖作為許多中藥的主要活性成分,其抗腫瘤活性受到醫(yī)藥科研工作者的青睞。據(jù)報道,金蟬花不同純化組分單獨使用均對人肺腺癌PAA-1細胞具有抑制作用;聯(lián)合化療藥物使用后則呈現(xiàn)不同的效果,總多糖表現(xiàn)為抑制作用,而腺苷則起協(xié)同作用[11]。王育純等[12]連續(xù)10 d給S180肉瘤鼠灌胃金蟬花水煎液(20 mL/kg),腫瘤抑制率達22.5%。且研究發(fā)現(xiàn)金蟬花水提取液的抗腫瘤活性要高于蟲草頭孢菌、蝙蝠蛾擬青霉菌和蛹蟲草水提液[13]。Wang等[14]實驗表明金蟬花水提取物(0、100、250、500和1 000 μg/mL)通過作用于G2/M期細胞周期并以劑量依賴的方式抑制人肝癌MHCC97H細胞的生長,但沒有凋亡跡象。Xie等[15]研究表明,金蟬花乙醇提取物對人肺腺癌A549細胞、宮頸癌Hela細胞、人胃癌SGC-7901細胞均具有增殖抑制作用,其中SGC-7901細胞的凋亡是通過增加內(nèi)質(zhì)網(wǎng)應(yīng)激,阻滯細胞S期,并激活Caspase信號通路實現(xiàn)的。
宮頸癌是婦科最常見的癌癥之一,對大多數(shù)抗腫瘤藥物不敏感,化療有效率低,發(fā)病率居女性生殖系統(tǒng)腫瘤的首位。本研究以金蟬花為原料,制備了50%和80%兩種濃度的醇沉金蟬花多糖,探討醇沉金蟬花多糖體外抗人宮頸癌Hela細胞活性及可能的機制,以期為金蟬花抗腫瘤藥品的開發(fā)提供理論依據(jù)。
1 材料與方法
1.1 主要材料與試劑
野生金蟬花于2018年7月采自江蘇省句容市天王鎮(zhèn)磨盤山,由江蘇大學藥學院歐陽臻教授鑒定;牛血清白蛋白(上海藍季科技發(fā)展有限公司);考馬斯亮藍、葡萄糖、5-氟尿嘧啶(上海國藥集團化學試劑有限公司);胎牛血清(美國Gibco公司) ;高糖DMEM培養(yǎng)基(以色列Biological Industries公司);兔抗人BAX、BCL2、P53單克隆抗體(美國CST公司);β-肌動蛋白抗體(武漢三鷹生物技術(shù)有限公司);羊抗兔二抗(南通碧云天生物技術(shù)有限公司);BCA蛋白定量試劑盒、2′,7′-二氯熒光黃雙乙酸鹽(2′,7′-Dichlorodihydrofluorescein diacetate,DCFH-DA)活性氧檢測試劑盒(上海碧云天生物技術(shù)有限公司);Trizol總RNA提取試劑盒(徐州溥博生物科技有限公司);0.25%胰酶消化液(上海創(chuàng)賽科技有限公司);脫脂奶粉(澳大利亞邁高乳業(yè)有限公司);苯酚、硫酸、95%乙醇、磷酸、三氯甲烷、正丁醇均為分析純。人宮頸癌Hela細胞(CBP60232)購于中國科學院上海生科院細胞資源中心。
1.2 儀器
B-490旋轉(zhuǎn)蒸發(fā)儀(瑞士步琪有限公司);RO-MB-10D高純水機(浙江杭州永潔達膜分離設(shè)備廠);高速低溫離心機(美國Beckman公司);SpectraMax190酶標儀(美國Molecular Devices公司);倒置顯微鏡TS100(日本Nikon公司);核酸蛋白檢測儀(日本島津公司);基因擴增儀2720型(美國應(yīng)用生物系統(tǒng)公司);熒光定量PCR儀LightCycle96(瑞士羅氏公司)。
1.3 兩種濃度醇沉金蟬花多糖的制備
將金蟬花去泥,粉碎,過80目篩。取50 g干燥粉末于1 L圓底燒瓶中,加入500 mL去離子水,88 ℃水浴加熱,提取2次,每次2 h。3 990 r/min離心15 min,分離濾渣與濾液,合并兩次濾液,旋轉(zhuǎn)減壓濃縮至70 mL。活性炭脫色3次,獲得金蟬花多糖。然后將獲得的多糖配置成5%的溶液,加入1/3體積的Sevage試劑(V三氯甲烷∶V正丁醇=4 ∶1),充分振搖20 min,4 000 r/min離心15 min,脫蛋白4次,取少量上清液測定蛋白質(zhì)及多糖含量,剩余上清液分別加入乙醇使其濃度為50%和80%,4 ℃靜置過夜以沉淀金蟬花多糖,冷凍干燥,獲得CP50和CP80。金蟬花多糖含量的測定參照中華人民共和國農(nóng)業(yè)行業(yè)標準NY/T1676-2008《食用菌中粗多糖含量的測定》中的苯酚—硫酸法。采用考馬斯亮藍微盤比色法測定蛋白質(zhì)含量[16]。
1.4 CCK-8法檢測金蟬花多糖處理后人宮頸癌Hela細胞的增殖
收集對數(shù)生長期的Hela細胞,計數(shù)并調(diào)整細胞密度為約5 × 104個/mL,每孔加100 μL于96孔板中。藥物處理組分別加入不同濃度的CP50和CP80培養(yǎng)液(25,50,100,200,400,800,1 600 μg/mL);陽性對照組用5-氟尿嘧啶(50 μg/mL)處理;對照組用培養(yǎng)基處理;空白組為不加細胞的培養(yǎng)基。設(shè)5個復孔,培養(yǎng)24 h,每孔加入10 μL CCK-8溶液避光培養(yǎng)4 h,用酶標儀在波長450 nm處測定光密度(D)值,并計算細胞存活率。細胞存活率=(實驗組D值-空白組D值)/(對照組D值-空白組D值)×100%。使用GraphPad Prism軟件計算半數(shù)抑制濃度(IC50),篩選活性較好的多糖進行后續(xù)實驗。
1.5 顯微鏡觀察金蟬花多糖處理后Hela細胞的形態(tài)
將對數(shù)生長期的Hela細胞稀釋成1 × 105個/mL的細胞懸浮液,并接種于24孔培養(yǎng)板中,每孔500 μL,培養(yǎng)24 h,除去培養(yǎng)基,PBS清洗2次,加入CP80多糖各樣液(50、100、200、400、800 μg/mL),對照組用培養(yǎng)基處理,陽性對照組加入5-氟尿嘧啶(50 μg/mL),培養(yǎng)24 h,于顯微鏡下觀察細胞形態(tài)。
1.6 DCFH-DA探針法檢測金蟬花多糖處理后Hela細胞內(nèi)活性氧水平
將Hela細胞(5×104個/mL)加入96孔板中,每孔100 μL,培養(yǎng)24 h,加入不同濃度的CP80培養(yǎng)基,24 h后吸除培養(yǎng)基,用PBS漂洗3次,加DCFH-DA溶液于培養(yǎng)箱內(nèi)孵育20 min,用無血清培養(yǎng)基洗滌3次。使用熒光酶標儀檢測熒光強度(激發(fā)光波長488 nm,發(fā)射光波長525 nm),計數(shù)并計算DCF熒光強度/104個細胞。
1.7 實時定量PCR檢測金蟬花多糖處理后Hela細胞P53、BAX和BCL2 mRNA表達
使用60 mm培養(yǎng)皿培養(yǎng)Hela 24 h,加入不同濃度的CP80培養(yǎng)基繼續(xù)培養(yǎng)24 h。除去CP80培養(yǎng)基,用PBS洗滌2遍,按照Trizol提取試劑盒說明書提取Hela細胞總RNA,取1 μL測濃度,-80 ℃保存。按cDNA逆轉(zhuǎn)錄試劑盒說明書進行操作,于PCR儀中在42 ℃ 60 min,80 ℃ 10 min的條件下合成cDNA。RT-PCR反應(yīng)體系:Master Mix 9 μL,上、下游引物(10 μmol/L)各2 μL,cDNA模板各2 μL,加無RNA酶去離子水至20 μL。以β-肌動蛋白作為內(nèi)參基因,進行實時熒光定量PCR分析,實驗平行3次。
實驗反應(yīng)條件如下,P53:95 ℃預變性10 min,95 ℃變性3 s,55 ℃退火10 s,72 ℃延伸10 s,反應(yīng)42個循環(huán)。BAX:95 ℃預變性5 min,92 ℃變性30 s,68 ℃退火30 s,72 ℃延伸45 s,反應(yīng)42個循環(huán)。BCL2:95 ℃預變性10 min,95 ℃變性30 s,55 ℃退火30 s,65 ℃延伸20 s,反應(yīng)46個循環(huán)。實驗數(shù)據(jù)采用2-ΔΔCt法進行相對定量分析。RT-PCR引物由上海生工生物技術(shù)有限公司合成。引物序列如下,P53:上游 5′-TTCCTGAAAACAACGTTCTGTC-3′,下游 5′-AACCATTGTTCAATATCGTCCG-3′;BAX:上游 5′-CGAACTGGACAGTAACATGGAG-3′,下游5′-CAGTTTGCTGGCAAAGTAGAAA-3′;BCL2:上游 5′-GACTTCGCCGAGATGTCCAG-3′,下游 5′-GAACTCAAAGAAGGCCACAATC-3′;β-肌動蛋白:上游 5′-CCTGGCACCCAGCACAAT-3′,下游 5′-GGGCCGGACTCGTCATAC-3′。
1.8 蛋白質(zhì)印跡檢測金蟬花多糖處理后Hela細胞P53、BAX和BCL2蛋白表達
取對數(shù)生長期細胞按1×106個/mL接種于培養(yǎng)皿中。培養(yǎng)24 h后,加入不同濃度的CP80培養(yǎng)基繼續(xù)培養(yǎng)24 h,PBS洗滌2遍,加胰蛋白酶消化1 min,完全培養(yǎng)基終止消化,4 ℃,4 000 r/min離心10 min。加入含PMSF的細胞裂解液冰上裂解35 min,4 ℃,12 000 r/min離心30 min,收集上清液,BCA法準確測定蛋白濃度。加入5×SDS蛋白上樣緩沖液溶解,煮沸5 min,以β-肌動蛋白作為內(nèi)參。
蛋白樣品上樣30 μg,以10%的分離膠和5%的濃縮膠進行凝膠電泳分離。濃縮膠:80 V 30 min;分離膠:110 V 70 min。在 80 V條件下轉(zhuǎn)膜60 min;37 ℃封閉1 h,用一抗稀釋液β-肌動蛋白(1 ∶1 500),BCL2(1 ∶1 000),BAX(1 ∶1 000)以及P53(1 ∶1 200)孵育2 h,用二抗稀釋液(1 ∶1 000)孵育1 h,曝光儀曝光,記錄成像結(jié)果。使用Image J軟件分析蛋白灰度值,計算蛋白相對表達量。
1.9 統(tǒng)計學分析
2 結(jié)果
2.1 CP50和CP80的含量
CP50和CP80的粗多糖得率分別為2.69%、18.79%,多糖含量分別為2.11%、6.23%。
2.2 兩種濃度醇沉金蟬花多糖對Hela細胞增殖的影響
CCK-8結(jié)果如圖1和圖2。隨著濃度的增加,CP50和CP80對Hela細胞的增殖均有一定的抑制作用(F=44.47,P<0.01;F=74.65,P<0.01)。與對照組相比,CP80濃度為100 μg/mL時,Hela細胞的存活率為87.73%(P<0.05)。隨著濃度的升高,細胞存活率降低。當濃度為200、400、800 μg/mL時具有顯著性差異,細胞存活率分別為84.85%、71.58%和58.60%(P<0.01),當濃度達到1 600 μg/mL時,細胞已經(jīng)大量凋亡,存活率為34.40%(P<0.01)。而CP50在濃度400 μg/mL時,細胞存活率降低才具有統(tǒng)計學意義,為82.98%(P<0.05),隨著濃度的升高,其抑制細胞增殖的作用較CP80小。通過GraphPad Prism軟件計算得到CP50和CP80對Hela細胞抑制的IC50值分別為1 203.0 μg/mL和778.9 μg/mL。因此,后續(xù)實驗使用CP80對人宮頸癌Hela細胞進行處理。
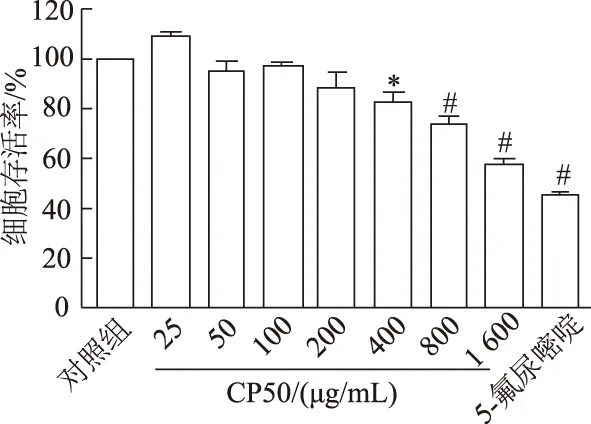
*:P<0.05,#:P<0.01,與對照組比較
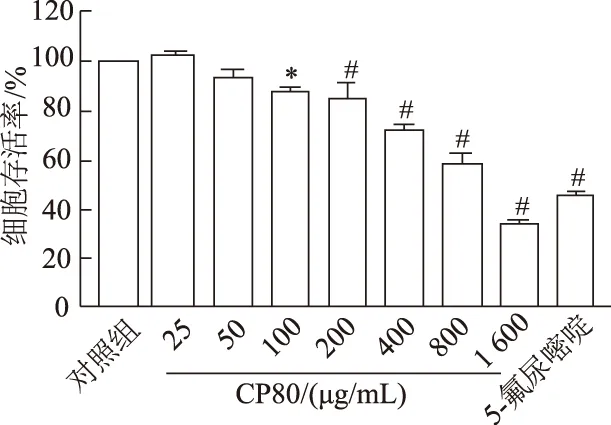
*:P<0.05,#:P<0.01,與對照組比較
2.3 CP80處理后Hela細胞的形態(tài)
由圖3可見,對照組中細胞生長良好,細胞數(shù)目多且形態(tài)為正常的梭形;5-氟尿嘧啶陽性對照組中細胞數(shù)目相對較少,細胞皺縮成團,死細胞、細胞碎片較多;CP80多糖處理組中活細胞數(shù)量與對照組相比,隨濃度的遞增,細胞逐漸減少,細胞死亡數(shù)也增多。

圖3 CP80處理后Hela細胞24 h的形態(tài)(×100)
2.4 CP80處理后Hela細胞內(nèi)的活性氧水平
如圖4所示,CP80處理Hela細胞24 h后,細胞熒光強度較對照組顯著增強,且熒光強度隨CP80濃度的升高而增加(F=131.105,P<0.01),當多糖濃度達800 μg/mL時,細胞熒光強度達最大值。
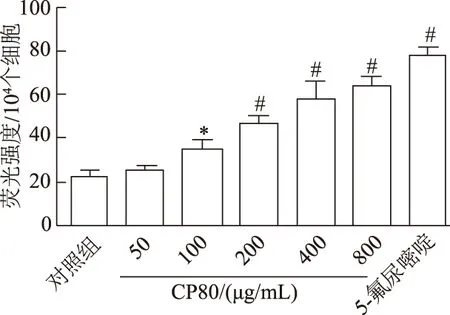
*:P<0.05,#:P<0.01,與對照組比較
2.5 CP80處理后Hela細胞內(nèi)P53、BAX和BCL2的mRNA表達
實時定量PCR結(jié)果顯示,與對照組相比,隨著CP80多糖濃度的增加,Hela細胞中BCL2mRNA的表達水平逐漸降低(F=5.246,P<0.01),而BAX、P53mRNA的表達水平逐漸升高(F=17.642,P<0.01;F=7.661,P<0.01)。當CP80多糖濃度達到800 μg/mL時,三者表達水平與陽性對照組相當。見圖5。
2.6 CP80處理后Hela細胞P53、BAX和BCL2蛋白的表達
不同濃度CP80培養(yǎng)后,蛋白質(zhì)印跡結(jié)果顯示,與對照組相比,CP80能明顯降低Hela細胞中BCL2蛋白的表達(F=141.506,P<0.01),BAX、P53蛋白在CP80多糖濃度分別達到200 μg/mL、100 μg/mL時,表達水平即明顯升高(F=6.256,P<0.01;F=3.804,P<0.05)。見圖6。
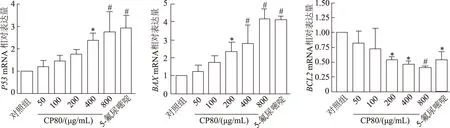
n=3;*:P<0.05,#:P<0.01,與對照組比較
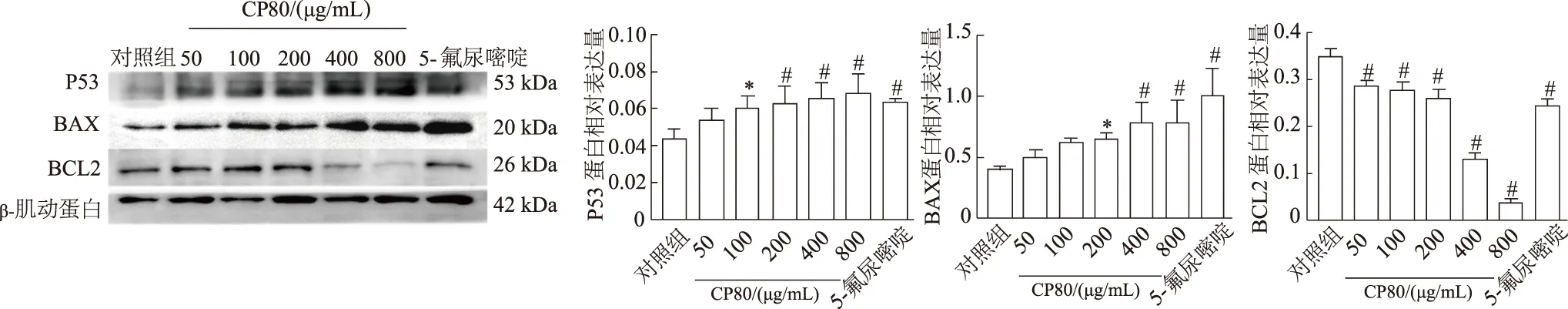
*:P<0.05,#:P<0.01,與對照組比較
3 討論
宮頸癌作為女性高發(fā)惡性腫瘤,發(fā)病率在女性婦科惡性腫瘤中居第1位,在女性惡性腫瘤中居第2位,僅次于乳腺癌。部分惡性腫瘤可通過手術(shù)、化療等治愈,但多數(shù)惡性腫瘤治療無法達到預期效果。因此,尋找新的療效好、安全低毒的抗腫瘤藥仍是當今人類面臨的難題之一。隨著科研理念和技術(shù)的不斷更新,越來越多的科研工作者開始研究中藥及其活性成分的抗腫瘤活性。何蒙嬌等[17]研究表明,白藜蘆醇可以下調(diào)人宮頸癌Hela細胞hTERTmRNA 和蛋白表達水平,抑制Hela細胞端粒酶活性,且呈濃度依賴性。中藥活性成分蛇床子素能顯著抑制Hela-S3增殖,其機制可能是升高細胞內(nèi)活性氧水平,下調(diào)BCL2、Survivin蛋白表達,上調(diào) BAX、Cleaved-PARP、Cleaved-Caspase-3 蛋白表達[18]。
本研究采用CCK-8法檢測CP50和CP80兩種粗多糖對Hela細胞增殖的影響,結(jié)果顯示隨著多糖濃度升高,兩種多糖對Hela細胞的增殖均有抑制作用,但CP80的抑制效果更為顯著,其原因可能是CP80多糖含量較CP50高。
本研究結(jié)果顯示CP80對Hela細胞的IC50值為778.9 μg/mL,該濃度劑量遠大于西藥使用劑量(陽性對照5-氟尿嘧啶為50 μg/mL)。據(jù)文獻報道,金蟬花水提物對肝癌MHCC97H細胞的IC50值為500~1 000 μg/mL[14],金蟬花乙醇提取物對人胃癌SGC-7901細胞的IC50值為400 μg/mL左右[15]。可能因為中藥多糖粗提物一般含有較多的雜質(zhì),并且通常分子量很大,難以通過細胞膜作用于腫瘤細胞,無法達到非常理想的治療效果。而有研究報道榕屬植物pandurata H分離純化的均相多糖作用于Hela細胞24 h和48 h后的IC50值分別為31.50和22.62 μg/mL[19]。板栗純化多糖YCP-H對人肝癌HepG2細胞的IC50值為 0.08 μg/mL,在劑量為1 mg/mL時,抑制率接近 95%,接近于臨床上紫杉醇對人體的正常使用濃度。此外該多糖對人非小細胞肺癌A549細胞的IC50值為17.1 μg/mL[20]。因此,后續(xù)可以對金蟬花粗多糖進行分離純化,以進行更深入系統(tǒng)的研究。
細胞內(nèi)活性氧水平升高會啟動氧化應(yīng)激反應(yīng),從而誘導腫瘤細胞凋亡[21]。本研究中,隨著CP80濃度的增加,Hela細胞內(nèi)活性氧水平顯著增加。在細胞凋亡過程中,BAX蛋白與細胞膜透化作用密不可分。而BCL2作為細胞外膜上的抗凋亡蛋白,能夠與BAX前體結(jié)合阻止細胞凋亡的發(fā)生[22]。馮嘉昆等[23]研究表明半夏提取物抑制髓系白血病、T淋巴細胞白血病細胞增殖的作用機制與其調(diào)節(jié)BAX/BCL2、Caspase-3蛋白表達有關(guān)。而改善BAX、BCL2蛋白的表達,有利于非小細胞肺癌患者的康復[24]。本研究中,CP80處理后Hela細胞P53、BAXmRNA和蛋白表達水平顯著上調(diào),BCL2mRNA和蛋白表達水平顯著下調(diào)。以上結(jié)果表明,金蟬花多糖抑制人宮頸癌Hela細胞的機制可能是通過提高細胞內(nèi)活性氧,調(diào)控BAX/BCL2的基因及蛋白質(zhì)表達,同時激活P53信號通路,介導Hela細胞凋亡。
綜上,本研究以人宮頸癌Hela細胞為腫瘤研究模型,探討了金蟬花粗多糖CP50和CP80的抗腫瘤活性作用,并對其機制進行了初步研究。后續(xù)將對CP50和CP80進一步分離純化以進行更深入的研究,為金蟬花多糖開發(fā)應(yīng)用于腫瘤的臨床治療提供有利的實驗數(shù)據(jù)。

