川芎嗪調控miR-31-5p/Ednrb 通路抑制人肺泡上皮細胞BEAS-2B 凋亡和炎癥反應
劉明宗,劉于嵩,龍國利,張 釗,江宇虹,高榕茂
(1.四川省醫學科學院·四川省人民醫院東院ICU,四川成都 610100;2.四川省醫學科學院·四川省人民醫院東院檢驗科,四川 成都 610100;3.西南醫科大學臨床醫學院,四川 瀘州 646000)
急性肺損傷(acute lung injury,ALI) 和急性呼吸窘迫綜合征 (acute respiratory distress syndrome,ARDS) 是一種臨床常見病和潛在致死綜合征,以肺泡上皮細胞凋亡增加和過度炎癥反應為特征[1-2]。近年來,盡管在呼吸生理學方面取得進展,但ALI/ARDS 死亡率仍居高不下。因此,有效控制肺泡上皮細胞異常炎癥和凋亡對改善ALI/ARDS 患者預后具有重要意義。川芎嗪(tetramethylpyrazine,TMP) 又叫四甲基吡嗪,是從中藥川芎Ligusticum chuanxiongHort.中提取的化合物,其除具有血管舒張和抗血小板活性外,還具抗氧化、抗炎作用,可減輕脂多糖或低密度脂蛋白誘導的內皮細胞炎性損傷[3-5],但川芎嗪對肺泡上皮細胞損傷的作用及潛在機制并未闡明。miR-31 是一種炎性相關微小RNA (microRNA,miRNA),其表達異常與糖尿病腎病、脊髓損傷等疾病進展有關[6-7]。生物信息學分析顯示內皮素受體B (endothelin receptor B,Ednrb) 是miR-31-5p的潛在靶基因。Ednrb 在慢阻肺患者中表達增加,抑制Ednrb 表達通過抑制炎癥反應可抑制慢阻肺進展[8]。于是推測川芎嗪對肺泡上皮細胞的抗炎和抗凋亡作用可能與調控miR-31-5p/Ednrb 通路有關。因此,本研究以脂多糖(lipopolysaccharide,LPS) 體外誘導人肺泡上皮細胞BEAS-2B 構建炎癥模型[9],探討川芎嗪對miR-31-5p和Ednrb 表達以及BEAS-2B 細胞凋亡和炎癥反應的影響,以期為川芎嗪在ALI/ARDS 輔助治療中的應用提供理論依據。
1 材料
1.1 細胞 人正常肺上皮細胞BEAS-2B 購于美國模式培養物保藏中心(American Type Culture Collection,ATCC)。
1.2 試劑 杜爾伯格伊戈爾培養液(DMEM)、胎牛血清購于美國Hyclone 公司;脂多糖購于美國Sigma 公 司。川芎嗪 (純 度≥98%,批 號20181012) 購于上海源葉生物科技有限公司。模擬物對照(miR-con)、miR-31-5p模擬物(miR-31-5pmimics)、小干擾RNA 對照(si-con)、Ednrb 小干 擾 RNA (si-Ednrb)、Ednrb 過表達載 體(pcDNA-Ednrb)、空載體質粒(pcDNA)、miRNA抑制物對照 (anti-miR-con)、miR-31-5p抑制物(anti-miR-31-5p) 由南京金斯瑞生物科技有限公司提供;膜聯蛋白V 異硫氰酸熒光素(Annexin VFITC)/碘化丙啶(PI) 細胞凋亡檢測試劑盒(批號20181213)、Trizol 試劑(批號20190105)、二喹啉甲酸(BCA) 試劑盒(批號20190215) 購于上海碧云天生物科技有限公司;腫瘤壞死因子-α(TNF-α) (批號20181205)、白細胞介素1β (IL-1β)、白細胞介素6 (IL-6) (批號20190121) 酶連免疫吸附試驗(ELISA) 檢測試劑盒購于南京建成生物工程研究所;兔源Ednrb (批號20190201)、活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved caspase-3) (批號20181211)、B 細胞淋巴瘤/白血病-2 (Bcl-2) (批號20190207)、Bcl-2相關X 蛋白(Bax) (批號20190217)、β-actin 抗體(批號20181225)、山羊抗兔Ⅱ抗 (批號20181114) 購于美國Abcam 公司。
1.3 統計學分析 通過SPSS 18.0 軟件進行處理,數據以() 表示,2 組間比較采用t檢驗,多組間比較采用單因素方差分析,組間進一步比較采用SNK-q 檢驗。P<0.05 表示差異具有統計學意義。
2 方法
2.1 細胞培養和實驗分組 采用DMEM 培養基(含10% 的胎牛血清) 常規培養BEAS-2B 細胞,48 h顯微鏡下觀察細胞生長狀態,進行傳代培養。取對數期細胞進行實驗,調整細胞密度為2×105個/mL,按照2 mL/孔接種到6 孔板,實驗分組如下。對照組:正常培養的BEAS-2B 細胞。LPS組:采用終濃度為1 μg/mL 的LPS 處理BEAS-2B細胞24 h。LPS+川芎嗪5 μmol/L 組、LPS+川芎嗪20 μmol/L 組、LPS+川芎嗪80 μmol/L 組:采用終濃度為5、20、80 μmol/L 的川芎嗪作用2 h 后,給予1 μg/mL 的LPS 刺激24 h。LPS+miR-con 組、LPS+miR-31-5p 組、LPS+si-con 組、LPS+si-Ednrb組:利用脂質體LipofectamineTM2000 將miR-con、miR-31-5pmimics、si-con、si-Ednrb 分別轉染BEAS-2B 細胞后按照上述方式進行LPS 刺激。LPS+川芎嗪+pcDNA 組、LPS+川芎嗪+pcDNA-Ednrb組:將pcDNA、pcDNA-Ednrb 分別轉染BEAS-2B細胞后按照上述方式進行川芎嗪(80 μmol/L) 和LPS 處理。
2.2 流式細胞術檢測細胞凋亡 收集按照上述方式進行干預處理的各組細胞,PBS 液洗滌細胞2次,加入結合緩沖液調整細胞密度為1×106個/mL。取100 μL 細胞懸液加入到流式管,按照細胞凋亡檢測試劑盒說明書分別加入5 μL 的Annexin VFITC 和5 μL 的PI,室溫條件避光孵育15 min,隨后立即上機檢測細胞凋亡情況。
2.3 ELISA 試劑盒檢測細胞培養液中TNF-α、IL-1β 和IL-6 水平 各組細胞上述方式進行干預處理后,吸取細胞培養液上清,采用ELISA 試劑盒分別測定細胞培養液中TNF-α、IL-1β 和IL-6 含量。步驟如下:向反應孔內加入100 μL 的待檢測樣品或標準品,空白孔調零后,于450 nm 波長處檢測各孔吸光度值,根據標準品計算TNF-α、IL-1β 和IL-6 水平。
2.4 RT-qPCR 檢測miR-31-5p和EdnrbmRNA 表達 收集按照上述方式進行干預處理的各組細胞,參照Trizol 說明書提取各組細胞總RNA,采用DNA 酶除去DNA 影響后,逆轉錄試劑盒合成cDNA。合成PCR 引物進行RT-qPCR 擴增。引物序列分別為miR-31-5p正向5′-GCGCAGGCAAGATGCTGG-3′,反向5′-GTGCAGGGTCCGAGGT-3′;U6正向5′-CTCGCTTCGGCAGCACATATACT-3′,反 向5′-ACGCTTCACGAATTTGCGTGTC-3′;Ednrb正 向5′-GGTTGTGTCCTGCCTTGTGTT-3′,反向5′-TTCGCATGCACTTGTTCTTGT-3′;β-actin正 向 5′-AAGATGA-CCCAGATCATGTTTGAG-3′,反 向 5′-TAGATGGGCACAGTGTGGGTG-3′。以cDNA 為 模板,采用SYBR 染料進行標記,于ABI 7500 上進行PCR 檢測。分別以U6 和β-actin為內參,按照2-ΔΔCt法計算miR-31-5p和EdnrbmRNA 表達水平。
2.5 Western blot 檢測Ednrb、Cleaved caspase-3、Bcl-2、Bax 蛋白表達 各組細胞上述方式進行干預處理后,BCA 法測定蛋白濃度。將蛋白樣本和5×上樣緩沖液混合1 ∶4 混合配置上樣終液,100 ℃變性3 min,按照每孔到30 μg 細胞蛋白進行聚丙烯酰胺凝膠電泳。常規濕法轉膜后將膜置于5%的脫脂牛奶中室溫條件封閉1 h,加入稀釋的Ⅰ抗后4 ℃側擺搖床孵育過夜,回收Ⅰ抗后,TBST 洗膜3次,每次10 min。然后加入稀釋的Ⅰ抗室溫孵育2 h,TBST 洗膜3 次,每次10 min。配制化學發光顯色液暗室內顯色,ImageJ 軟件分析目的條帶的灰度值。
2.6 雙熒光素酶報告基因實驗驗證miR-31-5p靶向調控 Ednrb 表達生物信息學分析工具Targetscan 預測顯示miR-31-5p與Ednrb 的3’ -UTR區域存在部分特異性結合的核苷酸序列,推測miR-31-5p 可能靶向調控Ednrb 表達并進行驗證。含有Ednrb 的3’ -UTR 的野生型熒光素酶報告基因載體(WT-Ednrb) 和突變型熒光素酶報告基因載體(MUT-Ednrb) 由上海吉瑪制藥公司構建。將miR-con、miR-31-5pmimics 分別與WT-Ednrb、MUT-Ednrb 共轉染至BEAS-2B 細胞,轉染48 h雙熒光素酶報告基因試劑盒測定各組細胞的熒光素酶活性。為驗證miR-31-5p 對Ednrb 的調控作用,分別將miR-con、miR-31-5pmimics、anti-miRcon、anti-miR-31-5p轉 染 BEAS-2B 細 胞,轉 染48 h,按“2.5” 項下方法測定Ednrb 蛋白表達水平。
3 結果
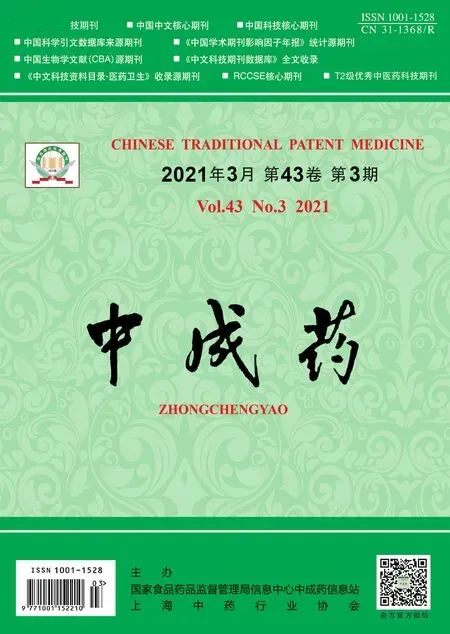
3.1 川芎嗪抑制BEAS-2B 細胞凋亡和炎癥因子分泌 與對照組比較,LPS 組BEAS-2B 細胞Cleaved caspase-3 和Bax 蛋白表達增加,Bcl-2 蛋白表達降低,細胞凋亡率升高,細胞培養液中IL-1β、IL-6和TNF-α 的濃度增加(P<0.01);與LPS 組比較,LPS+川芎嗪5 μmol/L 組、LPS+川芎嗪20 μmol/L組、LPS +川芎嗪80 μmol/L 組BEAS-2B 細胞Cleaved caspase-3 和Bax 蛋白表達降低,Bcl-2 蛋白表達增加,細胞凋亡率降低,細胞培養液中IL-1β、IL-6 和TNF-α 的濃度降 低 (P<0.05,P<0.01)。見表1、圖1。
表1 川芎嗪抑制BEAS-2B 細胞凋亡和炎癥因子分泌(, n=9)Tab.1 BEAS-2B inhibited cell apoptosis and inflammatory factor secretion by TMP (, n=9)

表1 川芎嗪抑制BEAS-2B 細胞凋亡和炎癥因子分泌(, n=9)Tab.1 BEAS-2B inhibited cell apoptosis and inflammatory factor secretion by TMP (, n=9)
注:與對照組比較,**P<0.01;與LPS 組比較,#P<0.05,##P<0.01。
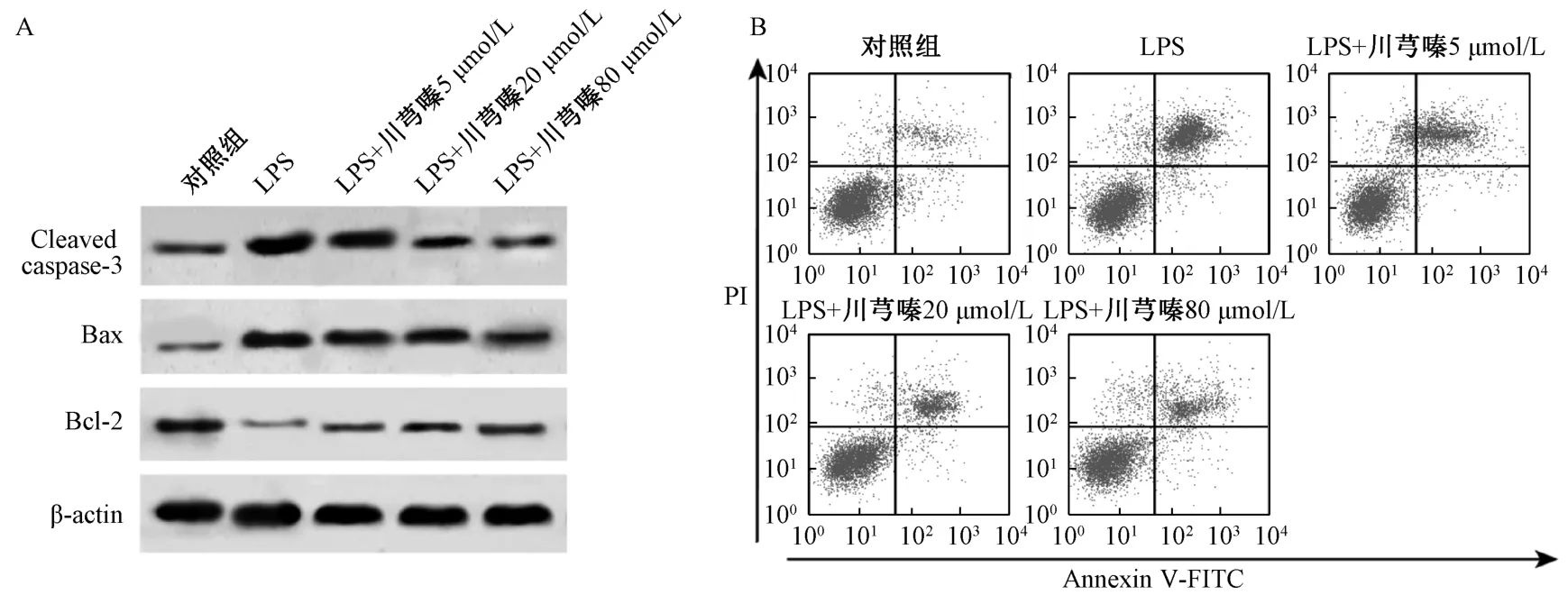
圖1 川芎嗪抑制BEAS-2B 細胞凋亡Fig.1 TMP inhibited BEAS-2B cell apoptosis
3.2 川芎嗪影響BEAS-2B 細胞miR-31-5p 和Ednrb基因及蛋白表達 與對照組比較,LPS 組BEAS-2B細胞miR-31-5p 表達降低,EdnrbmRNA 和Ednrb 蛋白表達增加(P<0.01);與LPS 組比較,LPS+川芎嗪5 μmol/L 組、LPS+川芎嗪20 μmol/L組、LPS+川芎嗪80 μmol/L 組BEAS-2B 細胞miR-31-5p表達升高,EdnrbmRNA 和Ednrb 蛋白表達降低 (P<0.05,P<0.01)。見表2、圖2。
表2 川芎嗪影響BEAS-2B 細胞miR-31-5p 和Ednrb 基因表達(, n=9)Tab.2 TMP impacts gene expressions of miR-31-5p and Ednrb in BEAS-2B cells (, n=9)
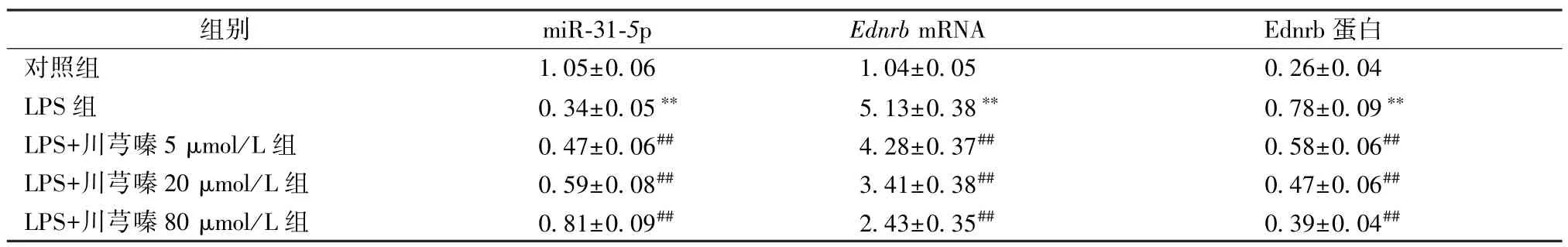
表2 川芎嗪影響BEAS-2B 細胞miR-31-5p 和Ednrb 基因表達(, n=9)Tab.2 TMP impacts gene expressions of miR-31-5p and Ednrb in BEAS-2B cells (, n=9)
注:與對照組比較,**P<0.01;與LPS 組比較,##P<0.01。
3.3miR-31-5p靶向調控Ednrb 表達 采用生物信息學分析工具Targetscan 進行靶基因預測,發現miR-31-5p、Ednrb 之間存在部分連續互補的核苷酸序列,見圖3A。雙熒光素酶報告顯示,與miR-con和WT-Ednrb 共轉染組比較,miR-31-5p和WTEdnrb 共轉染組BEAS-2B 細胞熒光素酶活性降低(P<0.01);與miR-con 和MUT-Ednrb 共轉染組比較,miR-31-5p 和MUT-Ednrb 共轉染組BEAS-2B 細胞熒光素酶活性變化無統計學意義(P>0.05),見表3。上 調miR-31-5p表達后,BEAS-2B 細 胞Ednrb 蛋白表達降低;下調miR-31-5p 表達后BEAS-2B 細胞Ednrb 蛋白表達增加(P<0.01),見表4、圖3B。

圖2 Western blot 檢測BEAS-2B 細胞中Ednrb 蛋白表達Fig.2 Detection of expressions of Ednrb protein in BEAS-2B cells by Western blot
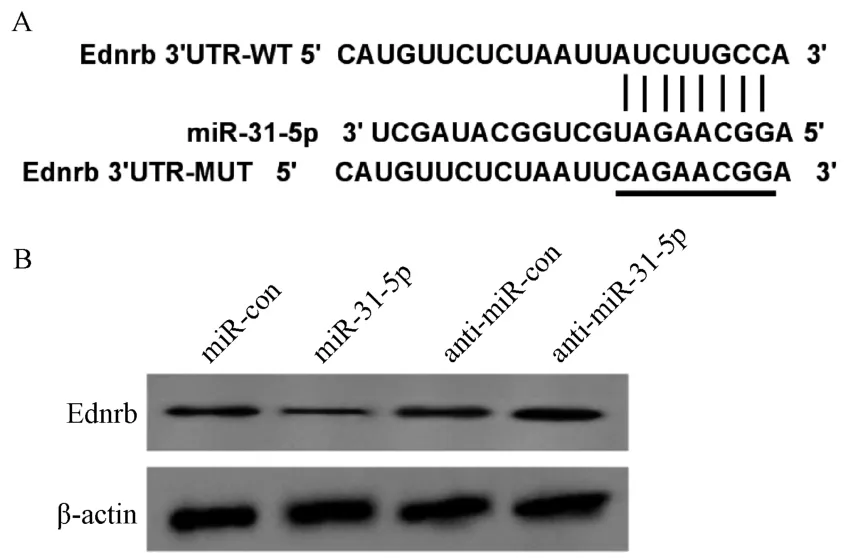
圖3 miR-31-5p 靶向調控Ednrb 表達Fig.3 Targeted regulation on Ednrb expression by miR-31-5p
表3 雙熒光素酶報告實驗(, n=9)Tab.3 Report of Dual luciferase experiment (, n=9)

表3 雙熒光素酶報告實驗(, n=9)Tab.3 Report of Dual luciferase experiment (, n=9)
注:與miR-con 組比較,**P<0.01。
表4 miR-31-5p 調控Ednrb 蛋白表達(, n=9)Tab.4 Regulation of Ednrb protein expression by miR-31-5p (, n=9)

表4 miR-31-5p 調控Ednrb 蛋白表達(, n=9)Tab.4 Regulation of Ednrb protein expression by miR-31-5p (, n=9)
注:與miR-con 組比較,** P <0.01;與anti-miR-con 組比較,##P<0.01。
3.4 過表達miR-31-5p對BEAS-2B 細胞凋亡和炎癥因子分泌的影響 與LPS+miR-con 組比較,LPS+miR-31-5p組BEAS-2B 細胞miR-31-5p表達升高,Cleaved caspase-3 和Bax 蛋白表達降低,Bcl-2蛋白表達增加,細胞凋亡率降低,細胞培養液中IL-1β、IL-6 和TNF-α 的濃度降低(P<0.01)。見表5、圖4。
表5 過表達miR-31-5p 對BEAS-2B 細胞凋亡和炎癥因子分泌的影響(, n=9)Tab.5 Effects of miR-31-5p overexpression on BEAS-2B cell apoptosis and inflammatory factor secretion (, n=9)
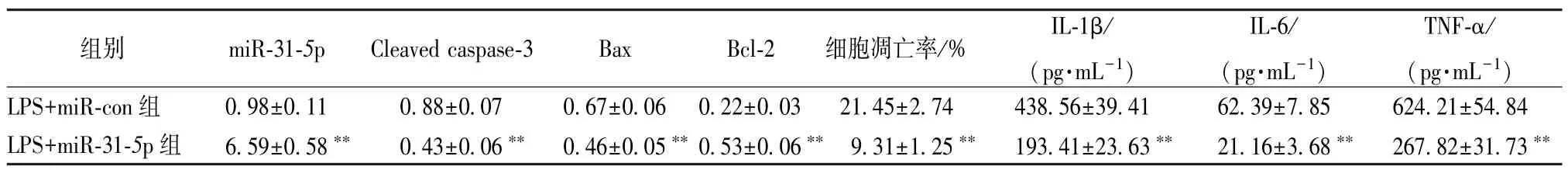
表5 過表達miR-31-5p 對BEAS-2B 細胞凋亡和炎癥因子分泌的影響(, n=9)Tab.5 Effects of miR-31-5p overexpression on BEAS-2B cell apoptosis and inflammatory factor secretion (, n=9)
注:與LPS+miR-con 組比較,**P<0.01。
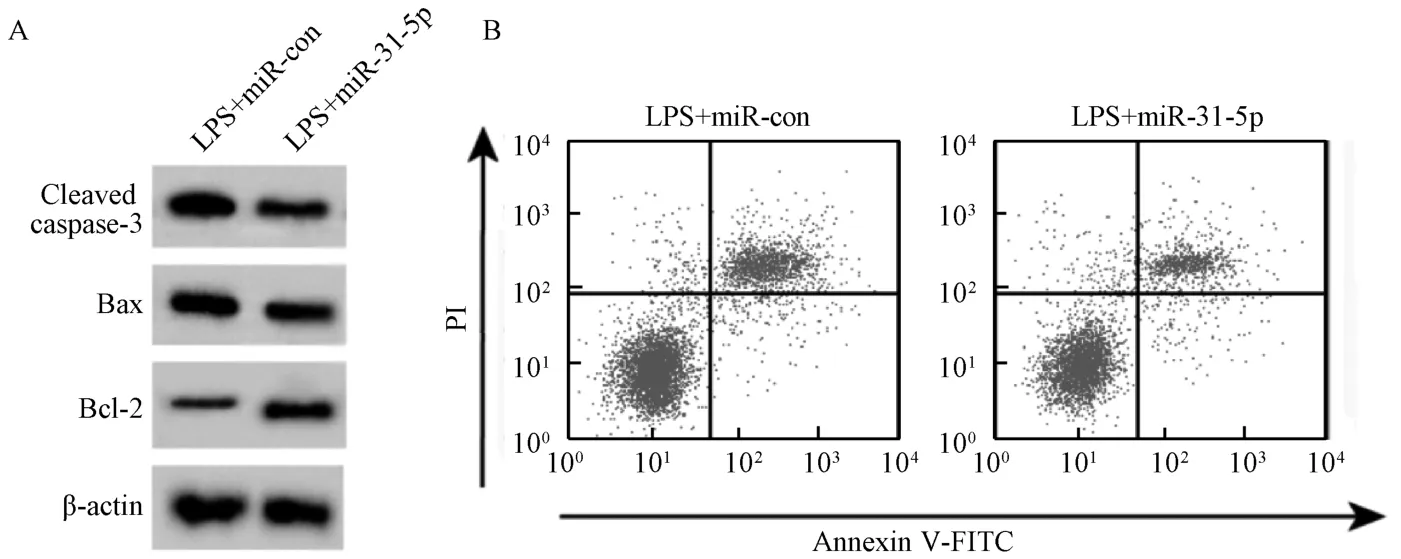
圖4 過表達miR-31-5p 對BEAS-2B 細胞凋亡和炎癥因子分泌的影響Fig.4 Effects of miR-31-5p overexpression on apoptosis and secretion of inflammatory factors in BEAS-2B cells
3.5 沉默Ednrb 對BEAS-2B 細胞凋亡和炎癥因子分泌的影響 與LPS+si-con 組比較,LPS+si-Ednrb組BEAS-2B 細胞Ednrb 蛋白表達降低,Cleaved caspase-3 和Bax 蛋白表達降低,Bcl-2 蛋白表達增加,細胞凋亡率降低,細胞培養液中IL-1β、IL-6和TNF-α 水平降低(P<0.01),見表6、圖5。
表6 沉默Ednrb 對BEAS-2B 細胞凋亡和炎癥因子分泌的影響(, n=9)Tab.6 Effects of silencing Ednrb on BEAS-2B cell apoptosis and secretion of inflammatory factors (, n=9)

表6 沉默Ednrb 對BEAS-2B 細胞凋亡和炎癥因子分泌的影響(, n=9)Tab.6 Effects of silencing Ednrb on BEAS-2B cell apoptosis and secretion of inflammatory factors (, n=9)
注:與LPS+si-con 組比較,**P<0.01。
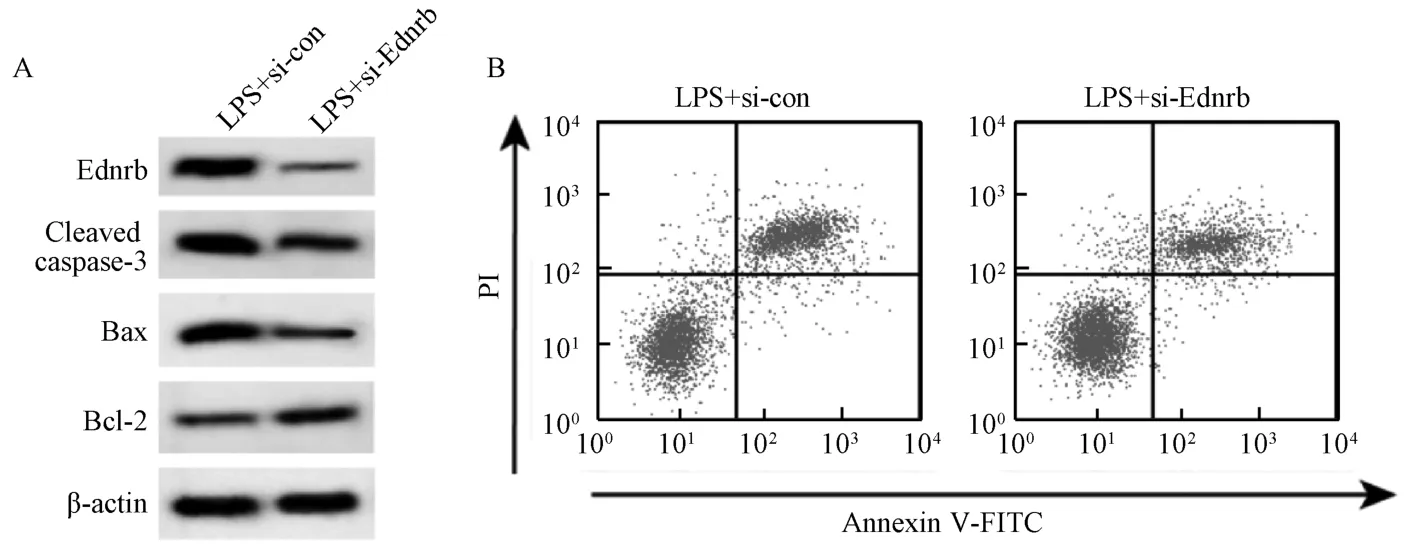
圖5 沉默Ednrb 對BEAS-2B 細胞凋亡和炎癥因子分泌的影響Fig.5 Effects of Ednrb silencing on BEAS-2B cell apoptosis and secretion of inflammatory factors
3.6 過表達Ednrb 部分逆轉川芎嗪對BEAS-2B 細胞凋亡和炎癥因子分泌的影響 與LPS+川芎嗪+pcDNA 組比較,LPS+川芎嗪+pcDNA-Ednrb 組BEAS-2B 細胞 Ednrb 蛋白表達升高,Cleaved caspase-3 和Bax 蛋白表達增加,Bcl-2 蛋白表達降低,細胞凋亡率升高,細胞培養液中IL-1β、IL-6和TNF-α 水平增加(P<0.01),見表7、圖6。
表7 過表達Ednrb 部分逆轉川芎嗪對BEAS-2B 細胞凋亡和炎癥因子分泌的影響(, n=9)Tab.7 Partially reversed TMP’ s effects on apoptosis and secretion of inflammatory factors in BEAS-2B cells by Ednrb overexpression (, n=9)

表7 過表達Ednrb 部分逆轉川芎嗪對BEAS-2B 細胞凋亡和炎癥因子分泌的影響(, n=9)Tab.7 Partially reversed TMP’ s effects on apoptosis and secretion of inflammatory factors in BEAS-2B cells by Ednrb overexpression (, n=9)
注:與LPS+川芎嗪+pcDNA 組比較,**P<0.01。
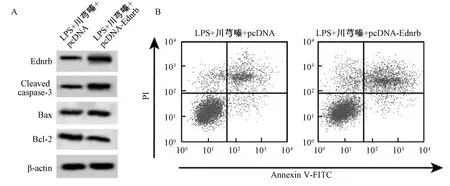
圖6 過表達Ednrb 部分逆轉川芎嗪對BEAS-2B 細胞凋亡和炎癥因子分泌的影響Fig.6 Partially reversed TMP’s effects on apoptosis and secretion of inflammatory factors in BEAS-2B cells by Ednrb overexpression
4 討論
川芎嗪是川芎提取物的主要活性成分之一,近年來其除用于心腦血管疾病治療外,其在肺損傷中的潛在作用也被逐步揭示。Liu 等[10]研究顯示川芎嗪可抑制內質網應激蛋白激酶誘導的肺微血管內皮細胞凋亡,對膿毒癥誘發的ALI 具有治療作用;Meng 等[11]研究指出川芎嗪可能通過減弱細胞凋亡進而保護鈍性胸外傷所致的肺損傷;此外,川芎嗪還可提高機體抗氧化能力活性保護肺組織免受燙傷所致的傷害[12]。與上述保護作用一致,本研究顯示川芎嗪干預可下調促凋亡蛋白Cleaved caspase-3、Bax 表達,上調抗凋亡蛋白Bcl-2 表達,減輕LPS誘導的BEAS-2B 細胞凋亡。TNF-α 是ALI 中重要的細胞因子,其可誘導IL-6 的釋放,增強中性粒細胞對血管內皮的黏附,加劇機體炎癥反應,抑制TNF-α、IL-1β 和IL-6 的分泌可減輕ALI 大鼠肺部損傷[13]。本研究顯示川芎嗪干預可減輕LPS 誘導的BEAS-2B 細胞TNF-α、IL-1β 和IL-6 的分泌,抑制BEAS-2B 細胞炎癥反應。提示川芎嗪通過抑制肺泡上皮細胞凋亡和炎癥反應發揮ALI/ARDS 治療作用。
miR-31 是一種具有多效作用的miRNA,在食管鱗癌[14]、宮頸癌[15]、結直腸癌[16]等多種人類惡性腫瘤中高表達發揮癌基因作用。在結腸炎中miR-31 表達上調,結腸內給予miR-31 抑制劑恢復抗炎因子IL-25 表達阻斷Th1/Th17 介導的炎癥反應是一種潛在的克羅恩病治療方法[18]。然而,在2 型糖尿病性腎病患者中miR-31 表達降低,且miR-31 表達與白細胞黏附、炎性因子TNF-α 和IL-6 分泌呈負相關,血清miR-31 水平是2 型糖尿病性腎病的潛在生物標志物[5]。Targetscan 靶基因預測顯示miR-31-5p與Ednrb之間存在相互作用,研究顯示慢性阻塞性肺病患者Ednrb 表達明顯升高,南蛇藤醇通過抑制Ednrb/Kng1 信號通路抑制香煙煙霧引起的細胞炎癥,減輕慢性阻塞性肺疾病。但miR-31-5p/Ednrb 對LPS 誘導的肺泡上皮細胞損傷的影響尚未可知。LPS 干預后檢測miR-31-5p和Ednrb 表達發現,miR-31-5p表達降低,Ednrb 表達升高,而川芎嗪呈劑量依賴性地抑制LPS 誘導的Ednrb 表達,促進miR-31-5p表達。進一步研究發現miR-31-5p靶向負性調控Ednrb 表達,過表達miR-31-5p 或沉默Ednrb 均可減輕LPS 誘導的BEAS-2B 細胞凋亡以及促炎因子TNF-α、IL-1β 和IL-6 的分泌,與川芎嗪的作用一致。進一步研究發現過表達Ednrb 可部分逆轉川芎嗪對LPS 誘導的肺泡上皮細胞凋亡和炎癥反應的保護作用。這些結果表明川芎嗪對LPS 誘導的肺泡上皮細胞損傷的保護作用與調控miR-31-5p/Ednrb 通路有關。
綜上所述,川芎嗪通過上調miR-31-5p/Ednrb通路抑制人肺泡上皮細胞BEAS-2B 凋亡和炎癥反應,為其在ALI/ARDS 輔助治療中的應用奠定理論依據。