高壓制備液相色譜同時制備5 種銀杏內酯
馮自立,朱志斌,趙正棟,陳 旺,李 穎
(1.陜西理工大學,陜西 漢中 723001;2.陜西萃程生物醫藥科技有限公司,陜西 漢中 723007)
銀杏內酯為銀杏葉重要活性物質,主要包括銀杏內酯A、B、C 和白果內酯[1],具有抗炎、抗氧化、抗血小板聚集、神經保護等諸多藥理活性[2-7],其中銀杏內酯B 是迄今為止在自然界中發現的活性最強的血小板活化因子拮抗劑[8]。由于銀杏內酯活性與其純度具有相關性,故近年來有不少學者對該成分的純化工藝進行研究,目前主要方法有有機溶劑萃取-結晶法、有機溶劑萃取-柱層析法、模擬移動床色譜法等[9-15],但都存在產品生產周期長、收率和純度低、不能實現多種內酯化合物同時制備等缺陷。
高壓制備液相色譜是快速分離和制備高純度天然產物活性成分的重要方法之一,因其分離度好、制備效率高、載樣量大、制備化合物純度高,正成為中藥化學成分分離純化的重要手段[16-17],在對照品制備、藥理活性研究、中藥現代化和質量控制等方面發揮了重要作用。由于銀杏內酯紫外吸收弱,采用常規的紫外檢測器靈敏度較低,導致其收率和純度不理想,故本實驗采用高壓制備液相色譜實現銀杏內酯A、B、C、J 和白果內酯同時制備的在線檢測,以期為相關系統研究奠定基礎。
1 材料
烘干銀杏葉于2018 年10 月購自陜西金慧方中藥科技有限公司,經陜西理工大學植物系教研室楊培君教授鑒定為銀杏科植物銀杏Ginkgo bilobaL.的干燥葉(總黃酮醇苷質量分數0.72%總萜內酯質量分數0.46%)。銀杏內酯A、B、C、J 和白果內酯對照品(陜西樂博生化科技有限公司)。分析用甲醇、四氫呋喃為色譜純;制備用甲醇、乙腈、四氫呋喃、乙醇、乙酸乙酯、鹽酸、碳酸氫鈉、活性炭、酸性氧化鋁為分析純;水為超純水(實驗室自制)。
DYG-200 L 超聲波中藥提取罐(寧波新芝超聲設備有限公司);Agilent 1260 高效液相色譜儀(美國Agilent 公司);HB DAC-50 高效制備液相色譜系統(江蘇漢邦科技有限公司);UNIEX 7700 蒸發光散射檢測器(上海通微分析技術有限公司);AVANCE 400 核磁共振儀(德國Bruker公司);AL204 電子天平 (瑞士梅特勒-托利多公司);YRE-2050A 旋轉蒸發儀(鞏義市予華儀器有限責任公司);SCIENTZ-10 N 真空冷凍干燥箱(上海圣科儀器設備有限公司)。
2 方法與結果
2.1 銀杏總內酯提取 取干燥銀杏葉20 kg,粉碎過80 目篩,加復合酶液(纖維素酶∶果膠酶=1 ∶1) 80 L (復合酶用量67.0 g),鹽酸調pH 至5,在50 ℃下酶解4 h,加80 L 工業乙醇攪拌均勻,超聲(2 kW) 提取60 min,濾過,濾渣加160 L 50%乙醇超聲提取60 min,濾過,合并濾液,減壓濃縮至20 L,等體積石油醚(60~90 ℃) 萃取2次,水相用0.5 mol/L 氫氧化鈉溶液調pH 至8.0,濾過,濾液用10%鹽酸溶液調pH 至7.0,加300 g 氯化鈉充分攪拌,等體積乙酸乙酯萃取3 次,合并乙酸乙酯相,無水硫酸鈉干燥,濾過,濾液減壓濃縮至干,得總銀杏內酯粗品228.3 g,純度36.4% (RSD=1.6%,n=3),回收率90.3% (RSD=1.8%,n=3)。
2.2 銀杏內酯結晶 向“2.1” 項下粗品加入500 mL甲醇加熱溶解,再加入200 mL 去離子水攪拌均勻,置于4 ℃冰箱中結晶12 h,濾過,母液合并減壓濃縮至原體積的1/3,繼續于4 ℃冰箱中結晶12 h,抽濾,合并晶體,丙酮重結晶,真空干燥,得總銀杏內酯晶體95.0 g,純度95.8%(RSD=2.1%,n=3),回收率91.3% (RSD=2.3%,n=3)。
2.3 銀杏內酯制備 將“2.2” 項下總銀杏內酯用70%甲醇配制成50 g/L 溶液,0.45 μm 濾膜過濾,高效制備液相色譜進行制備。
2.3.1 柱填料選擇 分別以正向硅膠(200~300 目)、酸性氧化鋁 (200~300 目)、Sephadex LH-20 葡聚糖凝膠(27~163 μm)、十八烷基鍵合硅膠(10 μm) 為填料,對銀杏內酯進行制備。結果,正向硅膠、酸性氧化鋁對銀杏內酯的分離度較差,上樣量少,有機溶劑用量多,重復性不理想,產品純度、收率均較低;LH-20 凝膠分離度差,上樣量少,分離速度慢;十八烷基鍵合硅膠分離度好,上樣量多,有機溶劑用量少,重復性好,制備時間短,產品純度、收率均較高,故選擇其作為柱填料。
2.3.2 制備溶劑系統選擇 根據HPLC 溶劑系統四面體優化法,對水、甲醇、乙腈、四氫呋喃4 種溶劑體系進行色譜制備。結果,甲醇-水體系可將5 種銀杏內酯分離開,但柱效低,上樣量少,制備時間長,溶劑用量多;乙腈-水體系較難分離銀杏內酯A、B,無法同時制備5 種銀杏內酯;甲醇-四氫呋喃-水體系對5 種銀杏內酯的選擇性較好,制備時間短,分離度好,上樣量多,故選擇其作為制備溶劑系統。
2.3.3 銀杏內酯放大制備 制備色譜條件為NP7010C 高壓制備泵(×2);DAC-HB50 動態軸向壓縮柱(50 mm×250 mm),Megres C1810 μm 填料;20 mL 定量環;分流式串聯 UNIEX-7700 蒸發光散射檢測器;Unimicro ChromStation 色譜工作站;流動相甲醇-四氫呋喃-水(30 ∶10 ∶60);體積流量95 mL/min;分流比0.5 ∶94.5;漂移管溫度70 ℃;載氣體積流量2.5 L/min;進樣量12 mL/次。結果,5 種銀杏內酯分離度良好,一次上樣600 mg 仍能實現基線分離,在25 min 內能完成一次制備;產物經減壓濃縮、真空冷凍干燥后,各銀杏內酯收率均大于95%,色譜圖見圖1。
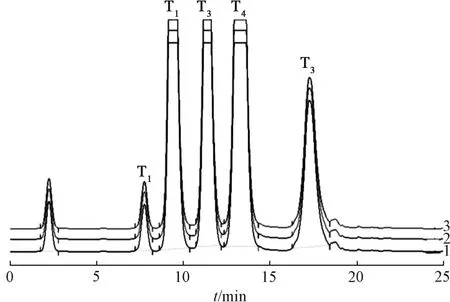
圖1 銀杏內酯高壓制備液相色譜圖
2.4 銀杏內酯檢測
2.4.1 對照品溶液制備 精密稱取銀杏內酯A、B、C、J及白果內酯對照品各5.0 mg,甲醇定容至5 mL,搖勻,過0.45 μm 微孔濾膜,取續濾液,即得。
2.4.2 供試品溶液制備 取制備的5 種銀杏內酯各5.0 mg,甲醇定容至5 mL,搖勻,過0.45 μm 微孔濾膜,取續濾液,即得。
2.4.3 色譜條件 TC-C18色譜柱(4.6 mm × 250 mm,5 μm);UNIEX-7700 蒸發光散射檢測器;流動相甲醇-四氫呋喃-水(30 ∶ 10 ∶ 60);體積流量1.0 mL/min;柱 溫30 ℃;進樣量10 μL。
2.4.4 結果 制得化合物T13.22 g,純度98.26%;T224.23 g,純度98.74%;T317.80 g,純 度98.14%;T428.02 g,純度98.05%;T510.58 g,純度98.64%,色譜圖見圖2。
2.5 結構鑒定
化合物T1:白色粉末(甲醇),mp 349~350 ℃。1H-NMR(400 MHz,DMSO-d6)δ:1.79 (1H,dd,J=15.2,7.8 Hz,H-1),2.72 (1H,dd,J=15.2,7.8 Hz,H-1),4.81 (1H,t,J=7.8 Hz,H-2),6.40 (1H,s,3-OH),4.65 (1H,d,J=4.0 Hz,H-6),4.16 (1H,m,H-7),5.50 (1H,d,J=6.6 Hz,7-OH),1.56 (1H,d,J=12.5 Hz,H-8),4.94 (1H,d,J=5.0 Hz,H-10),6.89 (1H,d,J=5.0 Hz,10-OH),6.05 (1H,s,H-12),2.87 (1H,q,J=7.2 Hz,H-14),1.09 (1H,d,J=7.2 Hz,H-16),1.04 (9H,s,t-Bu);13CNMR (100 MHz,DMSO-d6)δ:36.6 (C-1),87.4 (C-2),85.9 (C-3),100.1 (C-4),63.2 (C-5),85.8 (C-6),72.4(C-7),49.3 (C-8),62.5 (C-9),68.6 (C-10),174.1 (C-11),109.5 (C-12),171.1 (C-13),40.5 (C-14),176.7(C-15),8.3 (C-16),32.4 (C-17),29.0 (C-18),29.0 (C-19),29.0 (C-20)。以上數據與文獻[18] 報道一致,故鑒定為銀杏內酯J。
化合物 T2:白色針狀結晶 (甲醇),mp 353~354 ℃。1H-NMR (400 MHz,DMSO-d6)δ:3.91 (1H,dd,J=7.2,3.6 Hz,H-1),4.93 (1H,d,J=3.6 Hz,1-OH),4.63 (1H,d,J=7.2 Hz,H-2),6.46 (1H,s,3-OH),4.92(1H,d,J=4.0 Hz,H-6),4.03 (1H,m,H-7),5.61 (1H,d,J=6.2 Hz,7-OH),1.53 (1H,d,J=12.4 Hz,H-8),4.96 (1H,d,J=5.6 Hz,H-10),7.54 (1H,d,J=5.6 Hz,10-OH),6.08 (1H,s,H-12),2.80 (1H,q,J=7.0 Hz,H-14),1.12 (3H,d,J=7.0 Hz,H-16),1.09 (9H,s,t-Bu);13C-NMR (100 MHz,DMSO-d6)δ:74.0 (C-1),92.0(C-2),83.1 (C-3),98.7 (C-4),66.6 (C-5),79.5 (C-6),74.2 (C-7),49.4 (C-8),64.2 (C-9),69.2 (C-10),174.3(C-11),109.7 (C-12),170.6 (C-13),41.8 (C-14),176.7(C-15),8.3 (C-16),32.4 (C-17),29.2 (C-18),29.2 (C-19),29.2 (C-20)。以上數據與文獻[19] 報道一致,故鑒定為銀杏內酯C。
化合物T3:白色針狀結晶 (甲醇),mp 316~317℃。1H-NMR (400 MHz,DMSO-d6)δ:2.91 (1H,d,J=18.4 Hz,H-1),2.77 (1H,d,J=18.4 Hz,H-1),4.90(1H,t,J=7.2 Hz,H-6),2.53 (1H,dd,J=13.6,7.2 Hz,H-7),2.06 (1H,dd,J=13.6,7.2 Hz,H-7),5.40 (1H,s,8-OH),5.13 (1H,d,J=5.2 Hz,H-10),7.25 (1H,d,J=5.2 Hz,10-OH),6.26 (1H,s,H-12),1.04 (9H,s,t-Bu);13C-NMR (100 MHz,DMSO-d6)δ:42.1 (C-1),173.2(C-2),174.3 (C-4),58.0 (C-5),68.2 (C-6),36.0 (C-7),86.0 (C-8),65.8 (C-9),83.1 (C-10),177.6 (C-11),99.3 (C-12),37.3 (C-17),26.8 (C-18),26.8 (C-19),26.8 (C-20)。以上數據與文獻[19] 報道一致,故鑒定為白果內酯。
化合物 T4:白色針狀結晶 (甲醇),mp 350~351 ℃。1H-NMR (400 MHz,DMSO-d6)δ:2.72 (1H,dd,J=12.5,7.7 Hz,H-1),1.76 (1H,dd,J=15.2,7.7 Hz,H-1),4.80 (1H,t,J=7.7 Hz,H-2),6.32 (1H,s,3-OH),4.92 (1H,s,H-6),2.01 (1H,dd,J=10.5,2.9 Hz,H-7),2.01 (1H,dd,J=10.5,2.9 Hz,H-7),1.68 (1H,t,J=10.5 Hz,H-8),4.92 (1H,d,J=5.2 Hz,H-10),6.78(1H,d,J=5.2 Hz,10-OH),6.00 (1H,s,H-12),2.93(1H,q,J=7.2 Hz,H-14),1.12 (1H,d,J=7.2 Hz,H-16),1.02 (9H,s,t-Bu);13C-NMR (100 MHz,DMSO-d6)δ:36.8 (C-1),88.2 (C-2),86.3 (C-3),110.5 (C-4),68.3 (C-5),85.6 (C-6),36.3 (C-7),49.1 (C-8),67.0(C-9),69.0 (C-10),174.7 (C-11),100.1 (C-12),171.2(C-13),40.7 (C-14),176.8 (C-15),8.6 (C-16),32.4(C-17),29.3 (C-18),29.3 (C-19),29.3 (C-20)。以上數據與文獻[19] 報道一致,故鑒定為銀杏內酯A。
化合物 T5:白色針狀結晶 (甲醇),mp 350~351 ℃。1H-NMR (400 MHz,DMSO-d6)δ:4.05 (1H,dd,J=7.4,3.4 Hz,H-1),4.93 (1H,d,J=3.4 Hz,1-OH),4.62 (1H,d,J=7.4 Hz,H-2),6.45 (1H,s,3-OH),5.31(1H,d,J=3.6 Hz,H-6),1.93 (1H,td,J=14.0,4.0 Hz,H-7),2.13 (1H,dd,J=13.6,4.6 Hz,H-7),1.71 (1H,dd,J=14.0,4.6 Hz,H-8),5.02 (1H,d,J=5.4 Hz,H-10),7.46 (1H,d,J=5.4 Hz,10-OH),6.06 (1H,s,H-12),2.84 (1H,q,J=7.0 Hz,H-14),1.11 (3H,d,J=7.0 Hz,H-16),1.03 (9H,s,t-Bu);13C-NMR (100 MHz,DMSO-d6)δ:74.1 (C-1),92.3 (C-2),83.2 (C-3),98.8(C-4),72.2 (C-5),79.0 (C-6),37.1 (C-7),49.0 (C-8),67.7 (C-9),69.3 (C-10),174.3 (C-11),109.9 (C-12),170.6 (C-13),42.1 (C-14),176.8 (C-15),8.3 (C-16),32.2 (C-17),29.3 (C-18),29.3 (C-19),29.3 (C-20)。以上數據與文獻[19] 報道一致,故鑒定為銀杏內酯B。
3 討論
由于銀杏內酯具有較強且廣泛的藥理活性,故對該類化合物進行系統的純化制備具有重要理論意義和實際價值。為了快速制備高純度的銀杏內酯單體化合物,本實驗以銀杏葉為原料,經酶解預處理、提取、溶劑萃取、結晶、高壓制備液相色譜同時獲得高純度的銀杏內酯A、B、C、J 和白果內酯。
銀杏內酯是銀杏葉主要藥用成分,對心血管、神經系統均具有較強的藥理活性,一直以來受到眾多研究者的青睞,但其含量較低,結構相似,導致分離純化較為困難。本實驗對高壓制備液相色譜分離銀杏內酯過程中的填料種類和溶劑體系進行篩選,最終選擇十八烷基鍵合硅膠作為制備用填料,甲醇-四氫呋喃-水作為流動相,并采用分流式串聯蒸發光散射檢測器,從而實現該成分的在線檢測和制備。與傳統的溶劑萃取、結晶、硅膠柱層析等方法比較,高壓制備液相色譜可大幅提高銀杏內酯單體制備的效率和收率,所得產品純度高,有機溶劑用量少,生產成本降低,對工業化生產具有重要的指導意義。