外泌體在寄生蟲及媒介病毒中的研究進展
王海洋,李夢茹,程 鵬,公茂慶
上世紀80年代,有研究者在體外培養的綿羊紅細胞的上清液中發現了一種直徑在40~100 nm之間的小囊泡。隨后,這種小囊泡被命名為外泌體(exosomes)。研究之初,外泌體被普遍認為是細胞代謝的一種“廢棄物”,因而并沒有受到廣泛關注。現如今,隨著生物醫學技術的發展,人們對外泌體的認識也愈加深入。外泌體的典型直徑為30~100 nm,電鏡下呈杯狀形態,在蔗糖密度梯度下懸浮密度為1.10~1.21 g/mL[1-2],其膜結構中含有外泌體的標志物四聚體蛋白家族CD9和CD81[3],以及豐富的鞘磷脂和膽固醇,這些都是在黃病毒感染中必不可少的物質[4]。普遍認為,外泌體主要存在于大多數體液中,如血漿、羊水、尿液、母乳和唾液等,具有廣泛的病理生理功能[5-6]。
外泌體的相關研究主要集中在以下3個方面:①作為細胞間信號轉導的樞紐,調節機體的免疫應答,促進細胞增殖;②作為疾病早期診斷的標志物分子,外泌體內部含眾多細胞特異性結構,能夠準確反映分泌細胞的類型及功能,因此可以通過檢測特異性標志物來檢測某些疾病的發生發展狀況;③作為一種靶向給藥途徑,因外泌體表面有許多特異性膜蛋白,可以識別受體并與之發生特異性結合,因此,將外泌體作為一個定向給藥系統能夠大大增加藥物作用的精確性,并且能夠減少藥物的用量,降低藥物的毒副作用[7]。
需要特別指出的是,細胞外囊泡(extracellular vesicles,EVs)與外泌體有眾多相似的特征且兩者之間至今沒有一個明確的界限加以區分,有學者將外泌體和EVs的概念混用,也有學者認為外泌體屬于EVs范疇,將EVs根據直徑大小和生成、分泌方式的不同分為外泌體和微囊泡(microvesicles,MVs)[8]。
1 醫學原蟲外泌體
醫學原蟲以及原蟲感染性疾病至今仍是全球亟需解決的醫療衛生問題,外泌體的發現和研究為防治原蟲疾病帶來了新的轉機。已有研究表明,瘧原蟲(Plasmodium)、利什曼原蟲(Leishmania)和錐蟲(Trypanosome)等多種醫學原蟲都能夠釋放外泌體,并且已有學者從原蟲的分泌物中成功分離并純化外泌體,這對于外泌體在醫學原蟲領域的研究打下了堅實的基礎。
1.1蟲源性外泌體 從最近幾年的報道中不難看出,蟲源性外泌體的研究主要集中在醫學原蟲中。根據產生的機制和大小的不同,蟲源性外泌體主要被分為4種類型:①外泌體;②微型囊泡;③凋亡小體;④瘤小體。具體組分和物質性質見表1。接下來分別對研究較為集中的幾種醫學原蟲外泌體及其在原蟲感染性疾病中的作用進行分論。

表1 蟲源性外泌體研究進展Tab.1 Research progress of parasites-derived exosomes
1.1.1利什曼原蟲外泌體 利什曼病是一種由利什曼原蟲通過白蛉(sandfly)傳播的寄生蟲病,根據臨床特征可分為皮膚利什曼病、粘膜利什曼病和內臟利什曼病3種類型。研究發現利什曼原蟲外泌體通過刺激人類宿主產生白細胞介素-10(IL-10)和抑制腫瘤壞死因子α(TNF-α)的釋放來調節人類單核細胞所釋放的細胞因子(主要為IL-4)對干擾素-γ(IFN-γ)的作用[9],從而起到殺傷胞內病原體的作用。此外,杜氏利什曼原蟲(Leishmaniadonovani)外泌體會抑制脊椎動物淋巴結和脾臟產生CD4+T細胞,并加重宿主的感染[9]。另外已有研究證實,在已發現的329種利什曼原蟲蛋白質中,有超過52%是由外泌體介導的方式釋放的,且大都可以看作是利什曼原蟲感染的主要毒性因子[10-11]。與其他原蟲類似,利什曼原蟲外泌體可以通過調節巨噬細胞的信號傳導功能發揮促炎作用,并在感染部位招募中性粒細胞,加劇感染[12]。此外,利什曼原蟲表面分布著一種鋅依賴的金屬蛋白酶GP63,約占其總蛋白組的1%,通過糖磷脂酰肌醇(GPI)錨定在利什曼原蟲表面得以表達,或通過外泌體介導的方式分泌到細胞外環境[13-14]。有報道稱,GP63基因因編碼一些常見的毒力因子而高度保守。早期關于GP63毒力作用的研究表明,GP63能夠將補體蛋白C3b裂解為失活的iC3b片段,從而幫助寄生蟲逃避補體介導的裂解作用。研究發現外泌體在利什曼原蟲GP63進入巨噬細胞發揮毒力作用時具有重要的作用,即利什曼原蟲外泌體先與巨噬細胞質膜融合,再介導GP63的入膜反應[15]。因此,如能對外泌體介導的原蟲入膜反應加以阻抗干預措施,或許能夠間接的抑制GP63發揮毒性,繼而降低利什曼病的嚴重程度[15]。在Hassani等[16]關于利什曼原蟲外泌體釋放實驗中,最初的結果表明當原蟲進入脊椎動物宿主時,環境溫度發生改變會促使原蟲表面囊泡和外泌體的分泌急劇增加。Atayde等[17]通過小鼠實驗表明,外泌體和其它多種囊泡甚至決定著利什曼病的嚴重程度和轉歸。
1.1.2瘧原蟲外泌體 瘧疾是一種由瘧原蟲引起的寄生蟲病,臨床表現為間歇性發熱、嘔吐、乏力和紅細胞損傷引起的頭痛[18]。研究表明,外泌體的釋放量與瘧疾的嚴重程度有關[19]。從受伯氏瘧原蟲(Plasmodiumberghei)感染的宿主血清中提取的外泌體含有寄生蟲抗原,以劑量特異性的方式刺激巨噬細胞表面CD40表達和TNF釋放,并通過巨噬細胞誘發免疫反應[20]。另外,研究人員還從BALB/c小鼠的外周血中分離出約氏瘧原蟲(Plasmodiumyoelii)所釋放的外泌體,通過蛋白質組學研究,發現這些外泌體含有寄生蟲蛋白(具有免疫原性和免疫反應性),能夠刺激小鼠產生IgG抗體,誘導網狀紅細胞增多癥和激活宿主免疫反應[21]。還有報道稱,約氏瘧原蟲外泌體能在受感染小鼠體內抑制肺癌細胞的生長,且外泌體中miRNA的高攜帶量會導致血管內皮生長因子受體(VEGFR2)表達降低,從而抑制血管生成和腫瘤的生長[22]。
1.1.3陰道毛滴蟲外泌體 有關陰道毛滴蟲(Tri-chomonasvaginalis)外泌體的研究發現,外泌體能夠通過抑制宿主分泌IL-8從而有效抑制嗜中性粒細胞的增殖和遷移,繼而影響嗜中性粒細胞通過凝集素途徑或旁路途經激活補體而發揮殺蟲作用。因此可以認為,蟲源外泌體抑制IL-8的分泌,有利于其在宿主體內存活和生長[23]。
綜上所述,對于受感染的宿主來說,蟲源性外泌體是一把“雙刃劍”,給原蟲在寄生時提供了有利的寄生環境,為之后的感染提供了較有力的保障;同時又能激活宿主免疫反應,實現對宿主的保護性免疫。
1.2宿主源性外泌體 過去關于原蟲-外泌體的研究中,已有大量報道指出,醫學原蟲在寄生和感染宿主細胞的同時,不僅蟲體本身可以釋放大量外泌體,還可以刺激宿主細胞分泌外泌體,前者主要參與調控蟲體的寄生環境和宿主免疫應答,后者主要參與調節機體的免疫系統。更具體地說,蟲源性外泌體及宿主細胞釋放的外泌體都參與了寄生蟲病的發病機制[24]。一方面,蟲源性外泌體包含保守的寄生蟲特異性信息,包括蛋白質、RNA、非編碼RNA(ncRNA)和核酸,這些信息被轉移到宿主細胞,然后可以調節宿主免疫系統,參與寄生蟲的免疫逃逸,最終促進感染[25]。另一方面,宿主細胞在受到寄生蟲感染時進入應激狀態,同時釋放外泌體,激活NK細胞、巨噬細胞、單核細胞、T細胞、B細胞等免疫細胞,發揮抗感染作用[26]。
Bhatnagar[27]等研究發現,受到剛地弓形蟲(Toxoplasmagondii)感染的巨噬細胞會大量釋放外泌體,同時,這些外泌體會促進未成熟巨噬細胞釋放Toll樣受體(TLR)和TNF-α等細胞因子,這些細胞因子會積極地參與機體的抗蟲免疫反應。另外,妊娠期母鼠在受到弓形蟲感染時,從受感染的樹突狀細胞中提取的外泌體可以保護小鼠的胎兒不受垂直傳播導致的感染[28]。可見,宿主細胞在受到原蟲入侵時,能夠以分泌外泌體的方式對感染源做出回應以保護機體免受侵擾。
在瘧原蟲感染的小鼠模型中,Combes[29]等發現敲除ABCA1基因可直接導致宿主源性外泌體分泌量下降,從而保護受感染小鼠免受腦型瘧疾。Lorena[21]等研究了小鼠體內受約氏瘧原蟲(Plasmodiumyoelii)感染的網狀細胞所釋放的外泌體免疫效應,他們觀察到,外泌體介導的免疫效應可以很好地保護小鼠免受約氏瘧原蟲等多種原蟲的感染。另有一項研究[30]揭示了外泌體在惡性瘧原蟲(Plasmodiumfalciparum)生物學中的作用,表明受感染的紅細胞可以通過分泌外泌體直接與寄生的瘧原蟲進行信息交換,這一效應似乎對瘧原蟲向媒介蚊蟲的傳播發揮了重要的作用,但其具體機制不詳。
以上宿主源性外泌體的研究證明了其在醫學原蟲感染中的重要性。一些宿主源性外泌體的研究進展見表2。
2 醫學蠕蟲外泌體
在蠕蟲感染過程中,分泌細胞的起源是決定外泌體功能和組分的關鍵因素,在功能方面,外泌體是機體-蟲體免疫調節的關鍵一環:包括抗原呈遞、調節宿主免疫應答、表達某些活化分子、免疫監視以及介導細胞間通訊[35-36]。在組分方面,蠕蟲外泌體主要含有miRNA、蛋白質及脂類等。
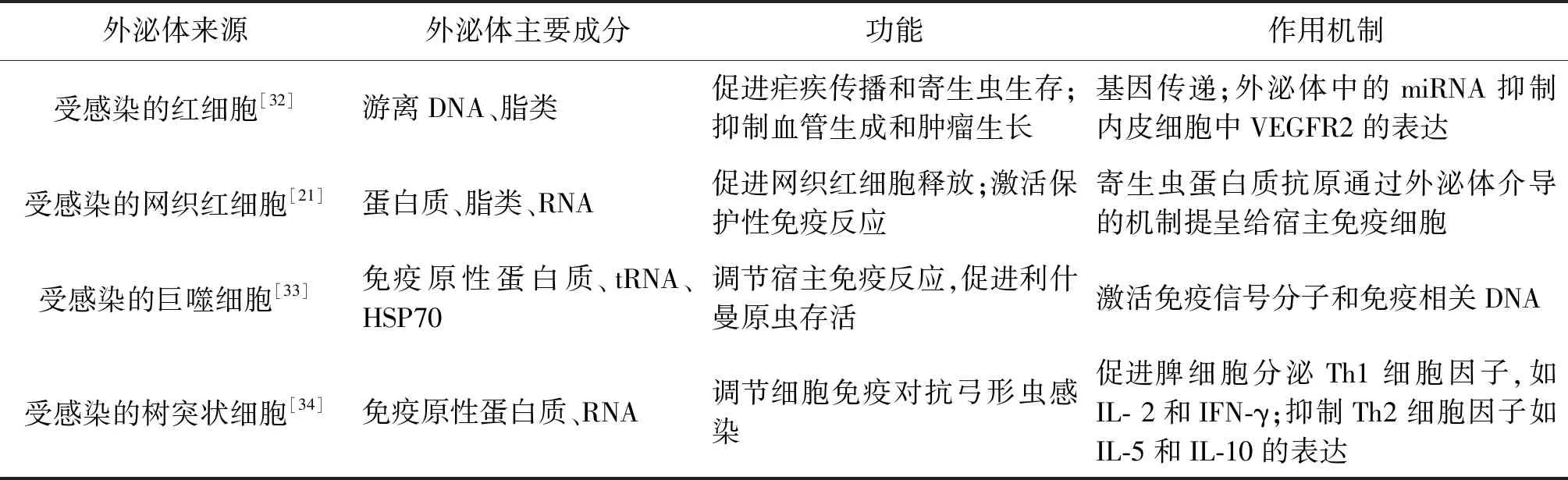
表2 宿主源性外泌體研究進展Tab.2 Research progress of parasitifer-derived exosomes
2.1馬來布魯線蟲外泌體 馬來布魯線蟲(Brugiamalayi)以蚊蟲為中間宿主,是一種常見的醫學蠕蟲,主要寄生于人類淋巴系統,侵入人體后會引發淋巴絲蟲病[37]。Zamanian[38]等用RNA干擾(RNA interference,RNAi)技術沉默了馬來布魯線蟲外泌體釋放基因BM-CPL-1,發現該蟲在失去外泌體釋放功能后,不僅對蚊蟲的感染率下降了近40%,而且建立和維持寄生蟲血癥的功能也受到了限制。另有報道,馬來布魯線蟲在宿主體內釋放的外泌體還有激活宿主巨噬細胞的功能,以調節機體固有免疫應答[24]。由此可見,通過調節宿主體內的蟲源性外泌體的分泌,對某些蠕蟲感染性疾病的治療來說可作為一個潛在的有利靶點。
2.2血吸蟲外泌體 血吸蟲病是由裂體屬吸蟲如日本血吸蟲(Schistosomajaponicum)、曼氏血吸蟲(Schistosomamansoni)等感染引起的熱帶寄生蟲病,其在世界范圍內對公共衛生所造成的影響僅次于瘧疾。最近,有學者首次從日本血吸蟲中分離、提純了外泌體樣囊泡,并對其做了分析。結果表明,這些囊泡能夠促進巨噬細胞極化,并產生TNF-α、CD16/32等促炎因子[39]。此外,Zhu[40]等通過蛋白質組學分析了血吸蟲外泌體中的403個蛋白質成分,發現這些蛋白組分除了具有催化活性、翻譯調節活性以及抗體結合活性外,還可以將miRNA傳遞到宿主細胞中,從而介導寄生作用。在自身免疫性疾病中,樹突狀細胞釋放的外泌體可以調節免疫反應的過度活化;且最新的研究表明,向小鼠模型腹腔注射樹突狀細胞源性外泌體可以抑制小鼠炎癥性腸胃病的進展,主要作用機制是抑制促炎細胞因子,如IL-17a和IFN-γ,并促進TGF-β抗炎細胞因子的生成。鑒于其抗炎作用的存在,多位學者認為外泌體可能具有免疫抑制藥物的應用價值[41-42]。
2.3絲蟲外泌體 淋巴絲蟲病是一種由寄生的班氏絲蟲(Filariaphilippinensis)、馬來絲蟲(Brugiamalayi)引起的由蚊蟲傳播的熱帶病,在全球73個國家傳播和流行。研究指出,班氏絲蟲感染宿主后,會向宿主分泌大量外泌體,其內主要包含生物活性蛋白、mRNA、miRNA和其它非編碼小RNA[43]。現已證明,外泌體攜帶的部分小RNA能夠調控宿主的基因表達,并抑制宿主的免疫反應,以促進蟲體的寄生和生長[44-45]。而那些具有生物活性的蛋白質,其中約80%都能在哺乳動物的外泌體中發現。那些已經被鑒定的蛋白質,有20%參與了生物活性分子的結合,16%參與了各種離子的運輸,21%參與了各種水解酶和轉移酶的代謝過程。以上生物活性物質發揮作用的前提是攜帶它們的外泌體能對其進行精準的運輸和調控[46],比如當機體發生絲蟲感染時,會以外泌體介導的方式釋放BM-CPL-1(一種類似于半胱氨酸蛋白酶的蛋白質分子),雖然這種蛋白質分子的具體功能尚不清楚,但是已有學者證實它的存在能夠良好地維持寄生蟲血癥[47]。
3 醫學節肢動物外泌體
醫學節肢動物的治理是目前防治媒介疾病最有效的方法之一。隨著人們對外泌體有了更深入的了解,醫學節肢動物外泌體及其在媒介病毒和媒介疾病中的研究成果也相繼問世。其中,以蜱蟲和蚊蟲等節肢動物外泌體的研究成果最具代表性,學者們希望節肢動物外泌體能給媒介疾病的防治提供新的思路和參考價值。
3.1蜱蟲外泌體 蜱蟲是多種脊椎動物體表的暫時性寄生蟲,同樣也是一些人獸共患病的重要傳播媒介和貯存宿主[48]。研究發現,來自蜱神經元細胞的外泌體可能介導蜱蟲傳播的黃病毒RNA和蛋白質,并在中樞神經系統中從一個神經元細胞向另一個神經元細胞傳遞。另外,蜱傳蘭加特病毒(tick-borne langat virus,LGTV)是一種與蜱傳腦炎病毒(tick-borne encephalitis virus,TBEV)密切相關的模式病原體,其能夠充分利用節肢動物外泌體將病毒RNA和蛋白傳遞到宿主皮膚角化細胞和血細胞[49]。有學者發現,在蜱N2a細胞和神經元細胞中可觀察到LGTV E蛋白去糖基化現象[50],而這種病毒E蛋白的去糖基化過程需要病毒粒子和外泌體的參與。值得指出的是,在蜱蟲細胞中維持糖基化的LGTV E-蛋白的主要作用可能是為了促進宿主細胞分泌外泌體和感染病毒,從而使節肢動物在寄生到脊椎動物宿主時能立即傳播病毒以觸發感染[50]。也有學者證實,在蚊蟲細胞中,西尼羅河病毒(West Nile virus,WNV)E蛋白大量糖基化是將病原體傳遞給脊椎動物宿主所必需的過程[51]。部分寄生蟲與醫學節肢動物外泌體研究進展見表3。
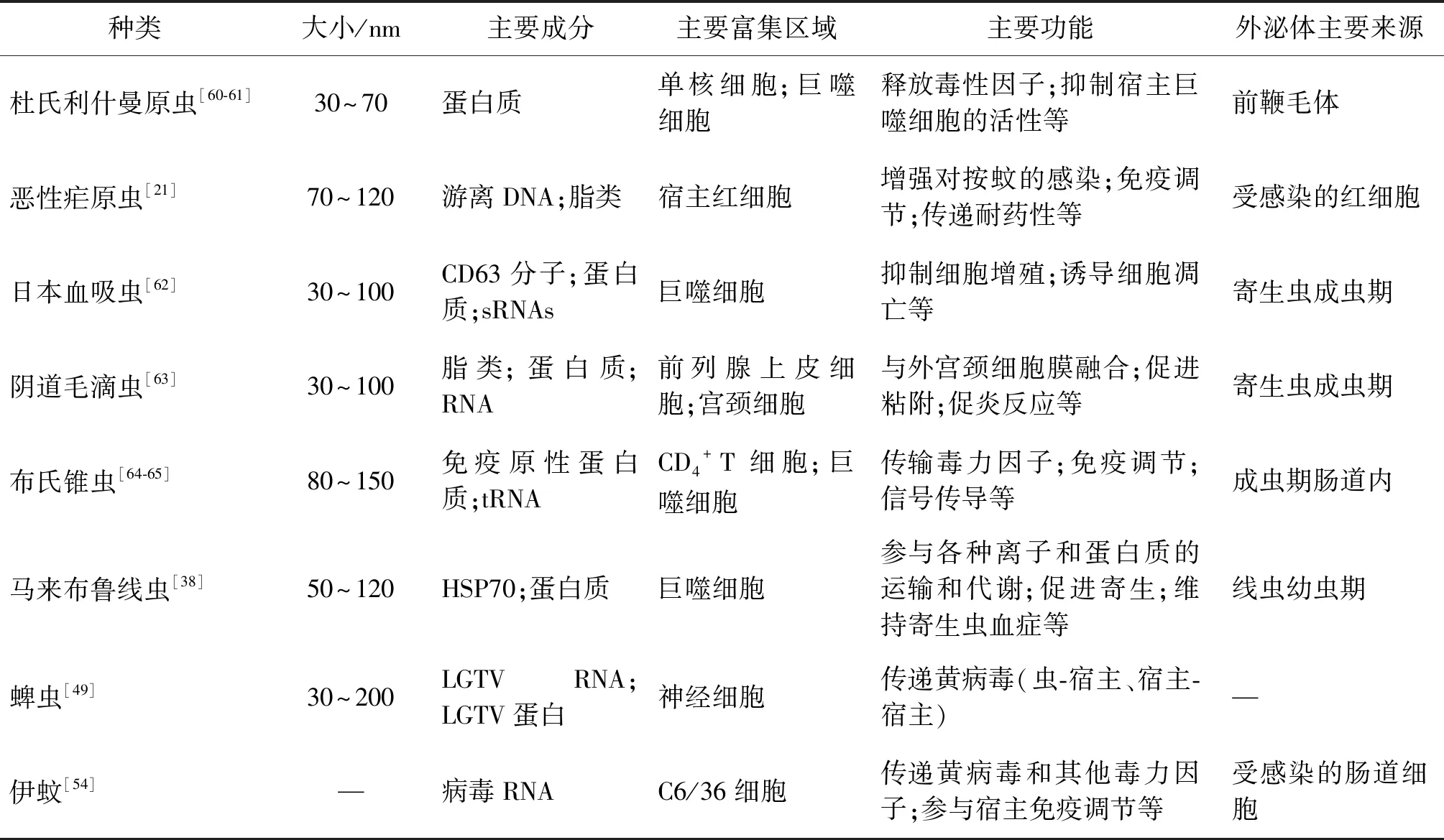
表3 部分寄生蟲與醫學節肢動物外泌體研究進展Tab.3 Research progress of exosomes on a part of parasites and vector insects
3.2蚊蟲外泌體 伊蚊(Aedes)是登革病毒(Dengue virus,DENV)的主要傳播媒介,DENV屬于黃病毒科黃病毒屬,含4種血清型(Ⅰ、Ⅱ、Ⅲ、Ⅳ型)[52]。外泌體不僅參與伊蚊的各項生理機能,同樣參與著登革熱疾病的感染過程[53],登革熱是一種廣泛流行于熱帶和亞熱帶的人獸共患疾病。Vora等[54]曾報道感染DENVⅡ型或Ⅲ型的伊蚊細胞能夠分泌攜帶病毒RNA和蛋白質的外泌體,且這些外泌體能夠繼而感染伊蚊C6/36細胞和哺乳動物細胞。Vora使用低劑量GW4869(外泌體釋放抑制劑)處理受DENVⅡ型感染的蚊蟲細胞并作為陰性對照,發現DENVⅡ感染是由外泌體的釋放所介導的。與此同時,GW4869處理也影響了病毒包膜蛋白與伊蚊細胞四聚體蛋白域內的糖蛋白(Tsp29Fb)的相互作用,表明該節肢動物Tsp29Fb在外泌體釋放途徑中發揮一定的作用。經過反復驗證,Vora做出了這樣的結論:通過抑制節肢動物Tsp29Fb或通過GW4869抑制外泌體的釋放可能是一種阻斷DENVⅡ傳播的有效方法,也可能成為一種防治蚊媒病毒的潛在措施。Braicu[55]等另有報道,外泌體這條通路不僅參與了DENV的傳播和感染,還能幫助DENV Ⅱ型繼續尋找下一個靶細胞。值得注意的是,Zhou[49]等用網格蛋白(clathrin)抑制劑(Pitstop-2)處理后發現,外泌體介導的蟲媒病毒傳播依賴于網格蛋白介導的內吞作用。
在此基礎上,Reyes-Ruiz[56]等人利用負染色電子顯微鏡和動態光散射技術(dynamic light scattering,DLS)對Vora等的發現加以補充,受DENV感染的伊蚊細胞所分泌的外泌體,其平均直徑遠比未受感染的伊蚊細胞的外泌體大的多,且含有病毒樣微粒。可以看出,外泌體在DENV的傳播中發揮著對宿主不利的消極作用。但是,最近的一項調查卻得出了與上述相悖的結論,Martins從感染DENV的哺乳動物體內分離出來的外泌體參與著宿主的免疫防御,調節著生物活性分子的分泌以達到抵抗感染的目的[57]。因此,定性外泌體在受DENV感染的細胞中的功能和作用機制,以及其在登革熱感染病程中發揮的作用都需要在未來的研究中進一步闡明。
另外有研究發現,大多數由醫學節肢動物傳播的黃病毒可在脊椎動物大腦微血管內皮細胞中復制,這些內皮細胞起到保護血腦屏障的作用,受感染的內皮細胞更易在外泌體的介導下受到黃病毒的侵犯并引起中樞神經系統的損傷[58-59]。有學者推測最初來源于內皮細胞的少量外泌體在進入血腦屏障后,可能會繼而介導黃病毒向中樞神經系統傳播。受到感染的神經細胞會迅速分泌大量攜帶感染源性物質的外泌體以加速血腦屏障的破壞,從而允許更高的外周病毒載量以及免疫細胞的活化和轉運。不僅如此,外泌體在介導蟲媒病毒傳播的同時,也在維持病毒RNA活性以及持久的感染而發揮著一定作用[50]。
4 總結與展望
人類與寄生蟲感染的斗爭史同樣也是一部見證著人類醫學發展的醫學史。如今,寄生蟲病仍多發于衛生條件較為落后的國家和地區,因缺乏有效的疫苗以及高效特異的治療方法而使寄生蟲感染的“重災區”蒙受著巨大的財政損失。然而,外泌體的研究或能為寄生蟲病的突破打開新大門。研究發現,外泌體樣囊泡的膜結構可以作為疫苗等藥物在宿主體內轉運。另有報道描述,寄生蟲外泌體的質膜結構較哺乳動物的更加穩定,因此通過探索其結構、生成方式和分泌方式,有望開發出更可靠的疫苗傳遞系統。此外,外泌體中含有的某些重要的蛋白成分,因其具有較強的免疫原性而被認為可以作為候選抗原以用于相關疫苗的開發[66]。值得強調的是,外泌體在宿主對寄生蟲病的免疫調控中也參與了重要的一環,如參與抗原物質提呈、刺激或抑制細胞因子分泌等。一方面,在多種效應機制的刺激下,寄生蟲向宿主體內釋放包裹有大量蟲源信息的外泌體,從而參與宿主免疫系統的調節,抑制炎癥反應,改善其寄生環境[67];另一方面,宿主也會釋放外泌體對蟲源感染做出積極回應。因此,可否在明確感染和發病機制的前提下,開發出外泌體介導的免疫療法?這一問題值得進一步深思和探討。經過數十載的探索,外泌體在腫瘤等疾病的早期診斷和靶向治療中已有了深入的研究,在寄生蟲以及媒介病毒領域中也有了長足的發展。未來,需要規范外泌體分離和提純方式、建立各研究領域外泌體數據庫,以便在今后的研究中更加高效便捷地辨識和提取。相信隨著研究的不斷深入,利用外泌體早期預防、診斷和治療寄生蟲疾病和媒介疾病將成為現實。
利益沖突:無

