慢性腎臟病患者外周血單核細胞內IL-37水平及臨床意義*
李超強,朱凱欣,黃美燕,徐軍發
中山大學附屬東華醫院:1.生殖醫學科;2.檢驗科,廣東東莞 523110;3.廣東醫科大學檢驗醫學研究所,廣東東莞 523808
慢性腎臟病(CKD)是臨床常見病之一,2010年我國CKD患病率超過10.8%[1]。CKD病理表現為腎小球、腎小管炎性物質浸潤及內皮細胞、系膜細胞不良增生,導致腎組織萎縮和纖維化。研究顯示,CKD患者血液中白細胞介素(IL)-6、IL-8和胎盤轉化生長因子(TGF)等細胞因子異常表達[2-3]。IL-37是一種新型細胞因子,在多種炎癥疾病患者血漿中檢出水平升高。筆者前期研究發現CKD患者血漿IL-37水平升高,有效治療后血漿IL-37水平降低[4]。但IL-37在CKD中的作用機制不明確,本研究通過檢測CKD患者外周血單核細胞內IL-37水平,并分析血液相關指標,進一步探討IL-37在CKD中的作用機制及臨床意義。
1 資料與方法
1.1一般資料 選取2016年9月至2018年12月中山大學附屬東華醫院確診的36例CKD患者作為CKD組,其診斷和分期標準依據2014年慢性腎臟病指南[5],患者入院前未接受過治療,未合并糖尿病、肝炎、肺結核、人類免疫缺陷病毒(HIV)感染及自身免疫性疾病。選取來自中山大學附屬東華醫院健康體檢科的22例健康志愿者作為對照組。CKD組中,男20例,女16例;年齡(47.92±14.15)歲。對照組中,男12例,女10例;年齡(41.50±10.77)歲。兩組年齡、性別比例比較,差異無統計學意義(P>0.05),具有可比性。將經藥物或血液透析等治療大于10 d的18例CKD患者進行治療前后的比較。所有研究對象均知情同意并簽署知情同意書。本研究通過中山大學附屬東華醫院醫學倫理委員會批準。
1.2儀器與試劑 人淋巴細胞分離液(天津市灝洋生物制品科技有限公司),1640基礎培養基(美國Gibco公司),IL-37檢測試劑(美國BD公司),尿酸(UREA)、尿素氮(BUN)、肌酐(CREA)試劑盒(德國羅氏公司),胱抑素C(Cys-C)試劑盒(廣州科方生物技術股份有限公司);流式細胞儀(美國BD公司),高速冷凍離心機(美國Thermo公司),邁瑞5180全自動血液分析儀(中國邁瑞公司),COBAS C501全自動生化分析儀(德國羅氏公司)。
1.3血常規和C反應蛋白(CRP)水平檢測 采集乙二胺四乙酸二鉀(EDTA-K2)抗凝血3 mL,按照邁瑞5180全自動血液分析儀的操作方法進行相應血常規指標和CRP水平檢測。
1.4腎功能指標檢測 采集肝素抗凝血3 mL,分離出血清,按照COBAS C501全自動生化分析儀的操作方法進行BUN、CREA、UREA和Cys-C水平檢測。
1.5外周血單核細胞內IL-37水平檢測
1.5.1外周血單核細胞分離 采集EDTA-K2抗凝血10 mL,300×g離心5 min,去血漿留血細胞沉淀。用等量無菌1×磷酸緩沖鹽溶液(PBS)稀釋血細胞沉淀并混勻,在15 mL離心管中,于人淋巴細胞分離液的液面上方沿管壁緩慢加入等量血細胞懸液,300×g離心20 min。用無菌吸管吸取白膜層加入含10%1640培養基1×PBS中,計數后,取1×106個細胞于兩管流式上樣管中,300×g離心5 min,棄上清液,染色后作流式細胞分析。
1.5.2單核細胞內IL-37水平檢測 按IL-37流式細胞試劑盒的操作方法進行,上機檢測后,根據單核細胞在流式細胞儀中的前向散射(FSC)及側向散射(SSC)散點圖的特征,進行單核細胞的設門,記錄標本單核細胞內IL-37水平。
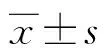
2 結 果
2.1外周血單核細胞內IL-37水平及其他指標情況 CKD組外周血單核細胞內IL-37水平明顯高于對照組,差異有統計學意義(t=7.147,P<0.05)。CKD組血液中性粒細胞數(NE#),單核細胞數(MO#),血清CRP,BUN,CREA、UREA和Cys-C水平均高于對照組,差異有統計學意義(P<0.05);兩組淋巴細胞數(LY#)比較,差異無統計學意義(P>0.05)。見表1。
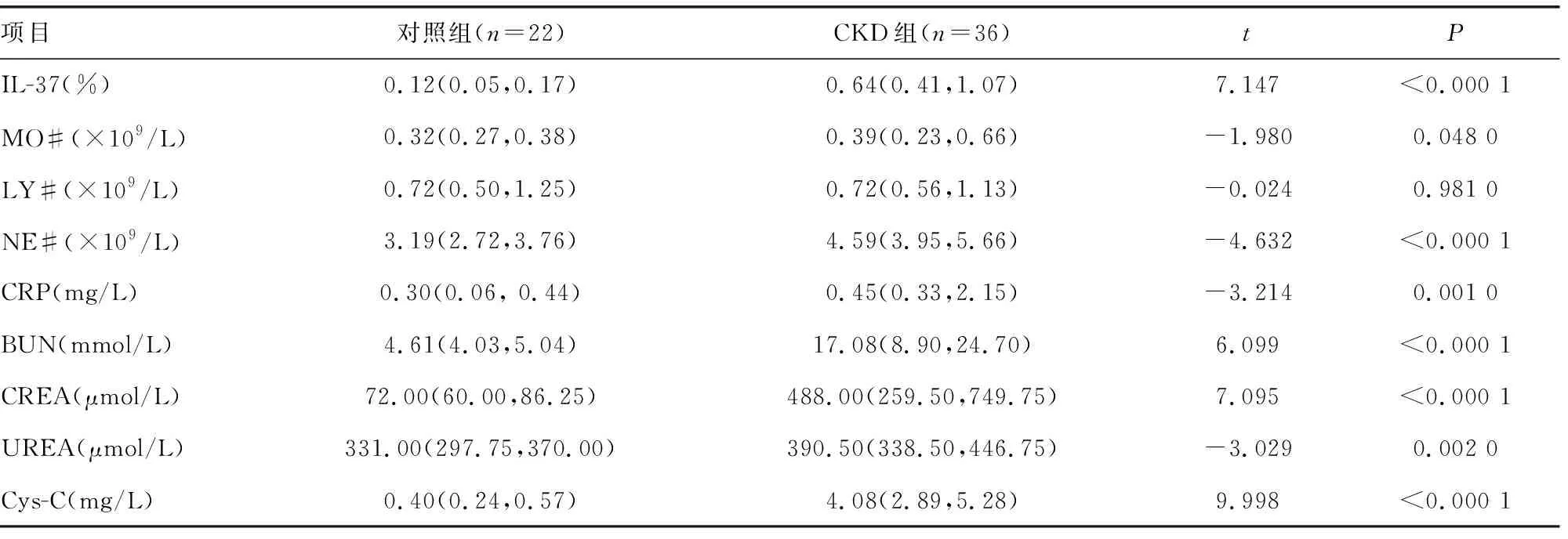
表1 CKD組與對照組外周血單核細胞內IL-37水平及其他指標的比較[M(P25,P75)]
2.2患者治療前后血液指標情況 18例患者經治療大于10 d,平均14.2 d,治療后組外周血單核細胞內IL-37水平低于治療前組,差異有統計學意義(P<0.05)。治療后組BUN、CREA、UREA和CRP水平均低于治療前組,差異有統計學意義(P<0.05)。治療后組血清Cys-C水平,血液MO#、NE#、LY#與治療前比較,差異無統計學意義(P>0.05)。見表2。
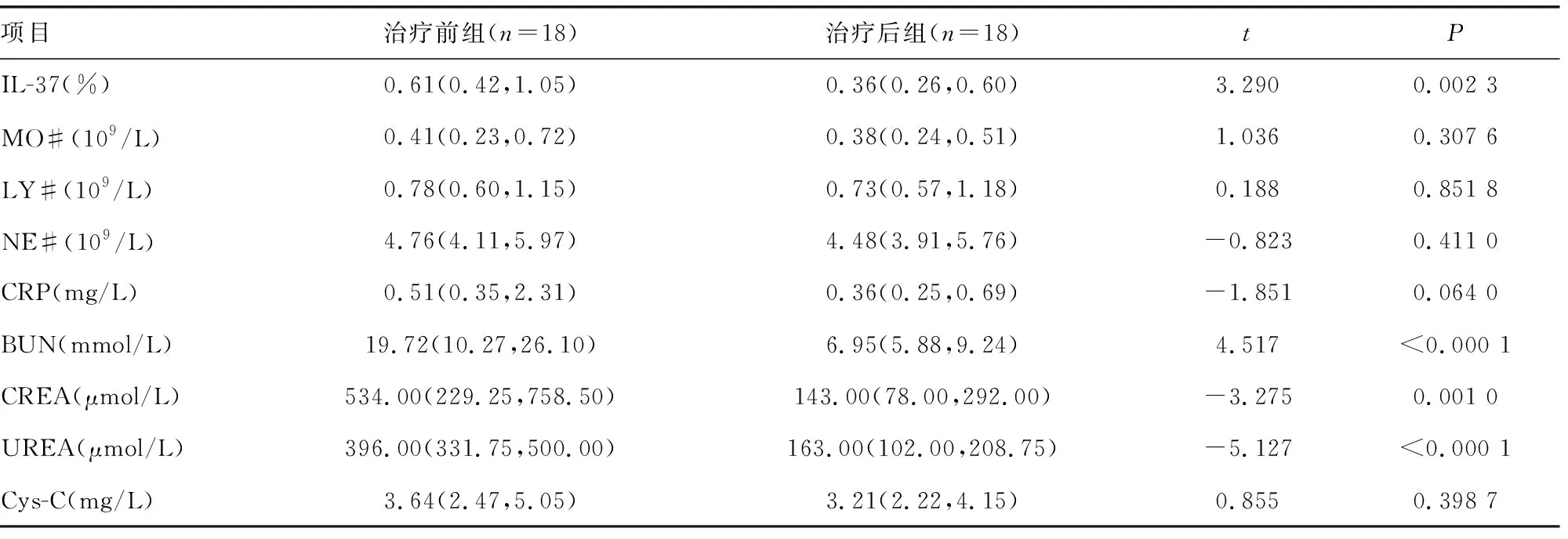
表2 治療前后外周血單核細胞內IL-37水平及其他指標的比較[M(P25,P75)]
2.3患者外周血單核細胞內IL-37水平與其他血液指標的相關性 患者外周血單核細胞內IL-37水平與血液中MO#(r=0.396 4,P<0.05)、NE#(r=0.343 5,P<0.05)及血清CRP水平(r=0.507 6,P<0.05)呈正相關,與LY#,血清BUN、CREA、UREA和Cys-C水平無相關性(P>0.05)。
3 討 論
CKD是免疫炎性介質參與的自身免疫性疾病,細胞因子生成和激活是疾病形成和發展的重要基礎。研究顯示,IL-1、IL-6、IL-8、IL-17、轉化生長因子-β(TGF-β)、人胰島素生長因子1(IGF-1)、血漿內皮素1(ET-1)和內核因子-κB(NF-κB)等細胞因子異常分泌,可活化酪氨酸蛋白激酶(JAK)及信號轉導子和轉錄激活子(STAT)信號途徑,刺激腎組織內皮細胞、系膜細胞分泌單核細胞趨化蛋白-1(MCP-1)和腫瘤壞死因子-α(TNF-α)等,加重腎組織炎性反應[6-7]。IL-8和IL-17還可直接誘導大量中性粒細胞和T細胞浸潤腎小球,加重腎組織局部炎癥和免疫損傷[8]。TGF-β可上調Smad7蛋白,激活NF-κB,誘導足細胞凋亡;也可促進Ⅰ型膠原合成,直接誘導腎臟組織纖維化[9]。ET-1、TGF-β和IGF-1可作用于腎組織,使腎系膜細胞增生、細胞外基質堆積,腎小球動脈硬化,引起水鈉潴留,造成水腫、高血壓等臨床癥狀[10-11]。因此,多細胞因子多途徑參與了CKD的發生與發展。
本研究結果顯示,CKD患者外周血單核細胞內IL-37水平明顯升高,經藥物或血液透析治療后單核細胞內IL-37水平下降,與CKD患者血漿IL-37水平的研究結果相似[4]。提示血漿IL-37與單核細胞內IL-37有密切關系,血漿IL-37或來源于單核細胞[12],且血漿和單核細胞中的IL-37均參與CKD的發生、發展。IL-37在CKD中的機制可能為:可通過抑制Toll樣受體激動劑,減少腎臟IL-1β、IL-6、IL-18和TNF-α等炎性細胞因子產生[13];也可通過抑制NLRP3炎性小體的激活,影響炎性細胞的募集和Th1/Th2平衡[14];與IL-18Rα鏈非競爭性地形成復合體,抑制NF-κB、絲裂原活化蛋白激酶(MAPK)等途徑,使得γ-干擾素(IFN-γ)的合成下調,抑制樹突狀細胞活性,從而延緩抗原提呈過程,抑制其免疫應答[15]。此外,成熟的IL-37還可以進入細胞核與Smad3蛋白結合,形成復合體,調節基因轉錄來抑制促炎因子的產生。總之,IL-37可通過抑制促炎因子表達、阻斷信號轉導、誘導抑炎因子表達等途徑抑制炎癥。因此,IL-37檢測是評估CKD治療效果的輔助性指標。
血清中BUN、CREA、UREA和Cys-C聯合檢測能有效反映患者腎功能狀況,是患者藥物治療或血液透析后常規檢測的生化指標。本文跟蹤檢測18例患者,結果顯示,患者經藥物或血液透析后,外周血單核細胞內IL-37,血清BUN、CREA、UREA水平呈不同程度的降低,但血清Cys-C水平、血液MO#、LY#、NE#變化不明顯。這提示外周血單核細胞內IL-37水平降低與腎功能改善相關。本研究結果也顯示,CKD患者外周血單核細胞內IL-37水平與腎功能指標中BUN、CREA、UREA、Cys-C無相關性,這提示外周血單核細胞內IL-37水平與CKD進展不一定呈正相關,與之前研究結果相似[4]。可能原因為跟蹤例數少,沒有對CKD的分期進行分析,但是隨著CKD向終末期進展,機體并發癥增多,自身免疫應答更紊亂,刺激IL-37表達的機制和途徑也更復雜。
外周血中性粒細胞、單核細胞及淋巴細胞在炎性疾病中扮演著重要角色。炎性反應會使外周血NE#、MO#和LY#不同程度地升高,參與抵抗病原侵入、吞噬異物、殺滅病菌等,并釋放大量趨化因子、IL-1、IL-6、TNF-α等。CRP是急性時相反應蛋白,在機體發生炎癥或感染后,血漿CRP水平會升高,而且在急性、亞急性與慢性病理狀態下,CRP有不同特征性的改變[16]。CKD是一個慢性炎性過程,患者體內炎性介質的持續存在和炎性反應刺激體內NE#、MO#和LY#反應性增多,參與腎組織的免疫防御,以阻止或延緩固有免疫及適應性免疫細胞的免疫應答[14]。在相關性分析中,CKD患者血液NE#、MO#及血清CRP水平與單核細胞內IL-37水平呈正相關。提示IL-37與炎性細胞水平密切相關。此外,本研究發現CKD患者血液中LY#略有升高,可能提示淋巴細胞更多轉化為T細胞、B細胞和NK細胞,具有免疫性殺傷作用。抑炎因子IL-37、炎性細胞、炎性因子等不斷作用于腎臟組織,最終造成腎組織的免疫損傷及CKD形成。
綜上所述,CKD患者外周血單核細胞內IL-37水平升高,與血液MO#、NE#及血清CRP水平呈正相關。經臨床藥物或血液透析有效治療后,CKD患者腎功能改善,外周血單核細胞內IL-37水平下降。

