基于尿酸酶-鈀納米粒子的比色分析定量檢測血清尿酸的方法建立及初步應用評價*
鄒瑟音,雷 達,凌連生,黃文秀,閆俊平
1.廣東省第二人民醫院檢驗醫學部,廣東廣州 510000;2.中山大學化學工程學院,廣東廣州 510000
尿酸(UA)是由黃嘌呤氧化酶作用于DNA和RNA降解產生的嘌呤代謝產物,越來越多的試驗數據表明UA對人體有著非常重要的影響[1-2],因此,實時監測體內UA水平,掌握其水平變化顯得尤為重要。不同的技術已被應用到體內外血清UA水平的檢測,包括電化學方法、熒光檢測技術、酶化學法、磷鎢酸比色法、干化學法和質譜法等[3-5]。納米技術的出現為UA的檢測方法研究拓寬了新的方向,越來越多的研究者致力于UA檢測新技術的研究[6-9],然而將研究成果用于臨床常規檢測則比較少見。筆者在前期研究中發現嵌于三聚氰胺氰尿酸鹽中的鈀納米粒子(MCA-Pd NPs)具有較強的過氧化物酶活性[10-11],因此建立了基于尿酸酶-MCA-Pd NPs的UA檢測體系,并對該檢測體系進行專一性試驗、線性范圍確定、重復性試驗、回收試驗、與常規檢測方法比較等方法學評價,為將其應用于臨床血清UA檢測奠定基礎。現報道如下。
1 材料與方法
1.1材料來源 40份血清標本來源于廣東省第二人民醫院門診及住院患者,其中UA檢測水平為低值為(108.0~195.0 μmol/L)13例、中值者(250.0~398.0 μmol/L)13例、高值者(450.0~820.0 μmol/L)14例。
1.2儀器與試劑 三聚氰胺、三聚氰酸(比利時Acros Organics公司);無水檸檬酸、無水乙酸鈉、UA、醋酸[阿拉丁試劑(上海)有限公司];氯化鈀、2,2′-連氮基-雙-(3-乙基苯并二氫噻唑啉-6-磺酸)二銨鹽(ABTS2-)[生工生物工程(上海)有限公司];濃鹽酸(廣州化學試劑廠);尿酸酶(上海瓦蘭生物科技有限公司);所有試驗過程中所用的水皆為超純水,且所用試劑均為分析純。UV-2550紫外-可見分光光度計(日本島津公司);日立7600生化分析儀;B-260恒溫水浴鍋(上海亞榮生化儀器廠);85-2型恒溫磁力攪拌器(鞏義市予華儀器有限責任公司)。
1.3方法
1.3.1MCA-Pd NPs的合成 根據試驗室前期研究成果合成性質穩定、具有高過氧化物酶活性的MCA-Pd NPs[12],室溫貯存備用。
1.3.2分析條件 以ABTS2-為顯色底物,10 μL待測UA樣品+50 μL 1.6 g/L尿酸酶+100 μL 0.105 mg/mL MCA-Pd NPs+50 μL 90 mmol/L ABTS2-,反應溫度為37 ℃,反應時間為20 min。
1.3.3比色分析 所有標本的比色分析均使用UV-2550紫外-可見分光光度計在420 nm處進行吸光度值檢測。
1.3.4UA標準溶液的制備及線性范圍的確定 準確稱取適量的UA標準品,用超純水充分溶解,此溶液為5 mmol/L UA標準儲備液,于4 ℃保存;臨用前,將儲備液用超純水稀釋至2 mmol/L UA,此為UA標準應用液,再稀釋成系列濃度的溶液(10.0、20.0、50.0、100.0、200.0、400.0、600.0、800.0 μmol/L,以及1.0、1.1、1.2、1.4、1.6 mmol/L)。通過測定這一系列濃度UA標準品的吸光度值,獲得濃度與吸光度的關系曲線。
1.3.5檢測UA的專一性 為研究該方法檢測UA的專一性,筆者將UA分別替換成超純水、葡萄糖、膽固醇、高密度脂蛋白和低密度脂蛋白,進行比色分析。
1.3.6重復性試驗 用空白基質配制89.0、297.0和714.0 μmol/L UA質控品,分4個批次檢測,每批次重復測定5次,計算批內變異系數(CV)和批間CV。
1.3.7回收試驗 制備基礎樣品及分析標本1、2、3,分別用本研究建立的檢測體系檢測其UA濃度,每份樣品作雙份檢測。
1.3.8臨床標本檢測 40份臨床血清標本分別用本研究建立的檢測體系和日立7600生化分析儀進行UA水平檢測,嚴格按試劑盒說明書操作。
1.4統計學處理 所有數據用Microsoft Excel2003和SPSS17.0進行處理和統計分析,不同試驗組間的結果差異采用單因素方差分析,方法之間的相關性采用線性回歸分析。P<0.05表示差異有統計學意義。
2 結 果
2.1檢測UA的專一性 加有UA的f管液體由無色轉變為綠色,而a、b、c、d和e 5管液體仍表現為無色,在420 nm波長處,f管的吸光度值均比另外5管高,差異有統計學意義(P<0.05),說明尿酸酶-MCA-Pd NPs檢測體系只對UA有反應,具有較高的選擇性。見圖1。

注:a為超純水;b為葡萄糖;c為膽固醇;d為高密度脂蛋白;e為低密度脂蛋白;f為UA;與f管比較,*P<0.001。
2.2線性范圍的確定 濃度與吸光度值呈線性相關的濃度范圍為50.0~1 000.0 μmol/L,其線性回歸方程為Y=0.000 1X+0.063 3,r=0.994 3。見圖2。
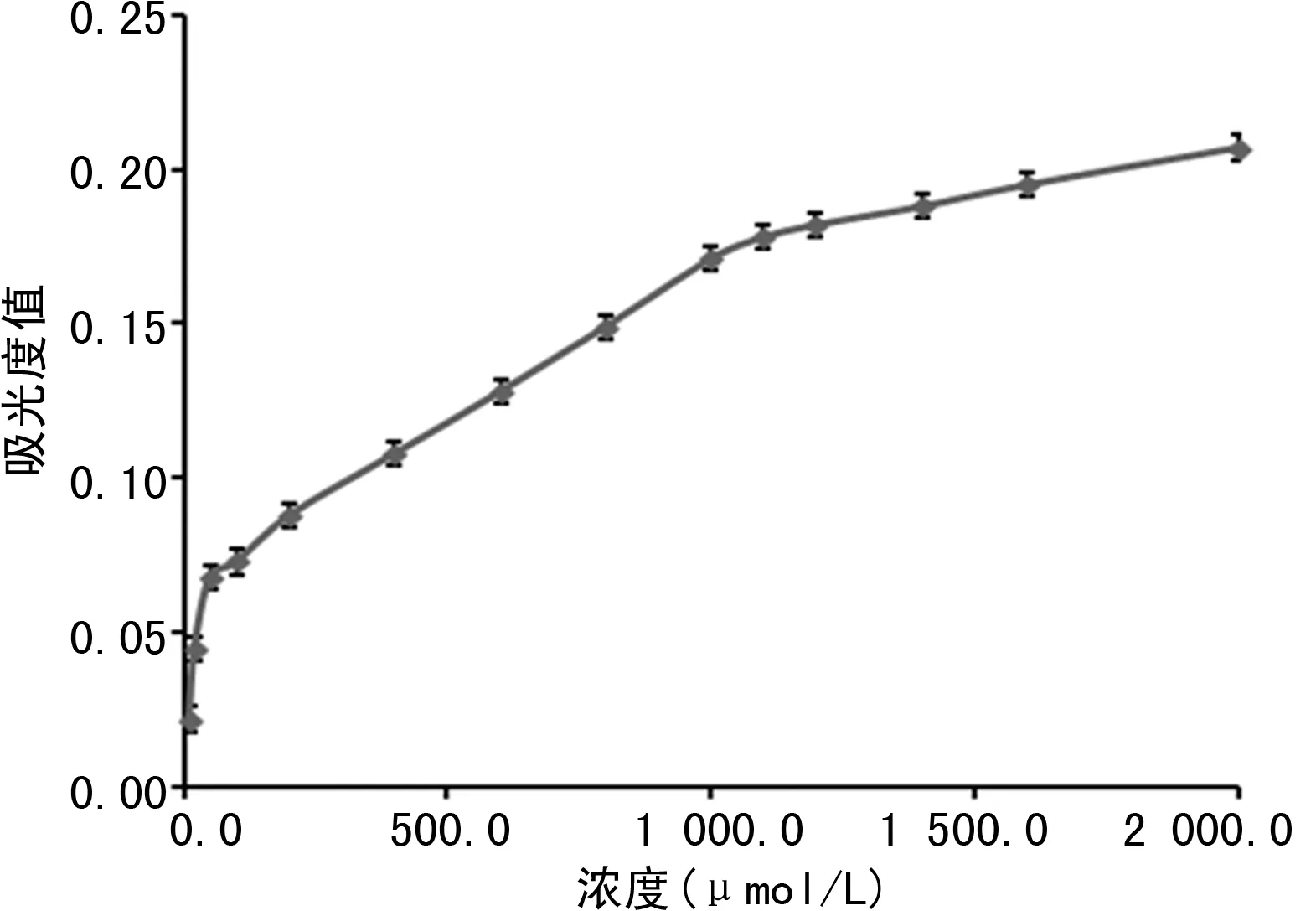
圖2 線性范圍的確定
2.3重復性試驗 3種濃度的批內CV分別為:3.51%、2.86%、3.05%,批間CV分別為7.63%、5.12%、7.25%。見表1。
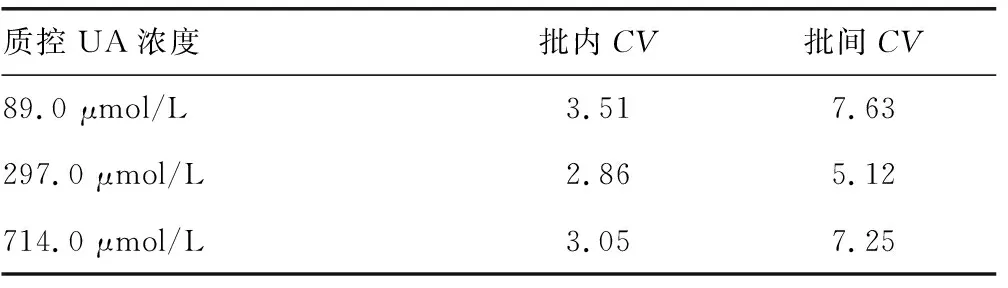
表1 尿酸酶-MCA-Pd NPs檢測體系的精密度(%)
2.4回收試驗 UA回收率為97.0%~104.0%,見表2。

表2 UA回收試驗結果
2.6新建方法與生化分析儀檢測結果比對 經線性回歸分析,回歸方程為Y生化分析儀=0.996 4X新建方法-0.475 4,r=0.995 8。見圖3。
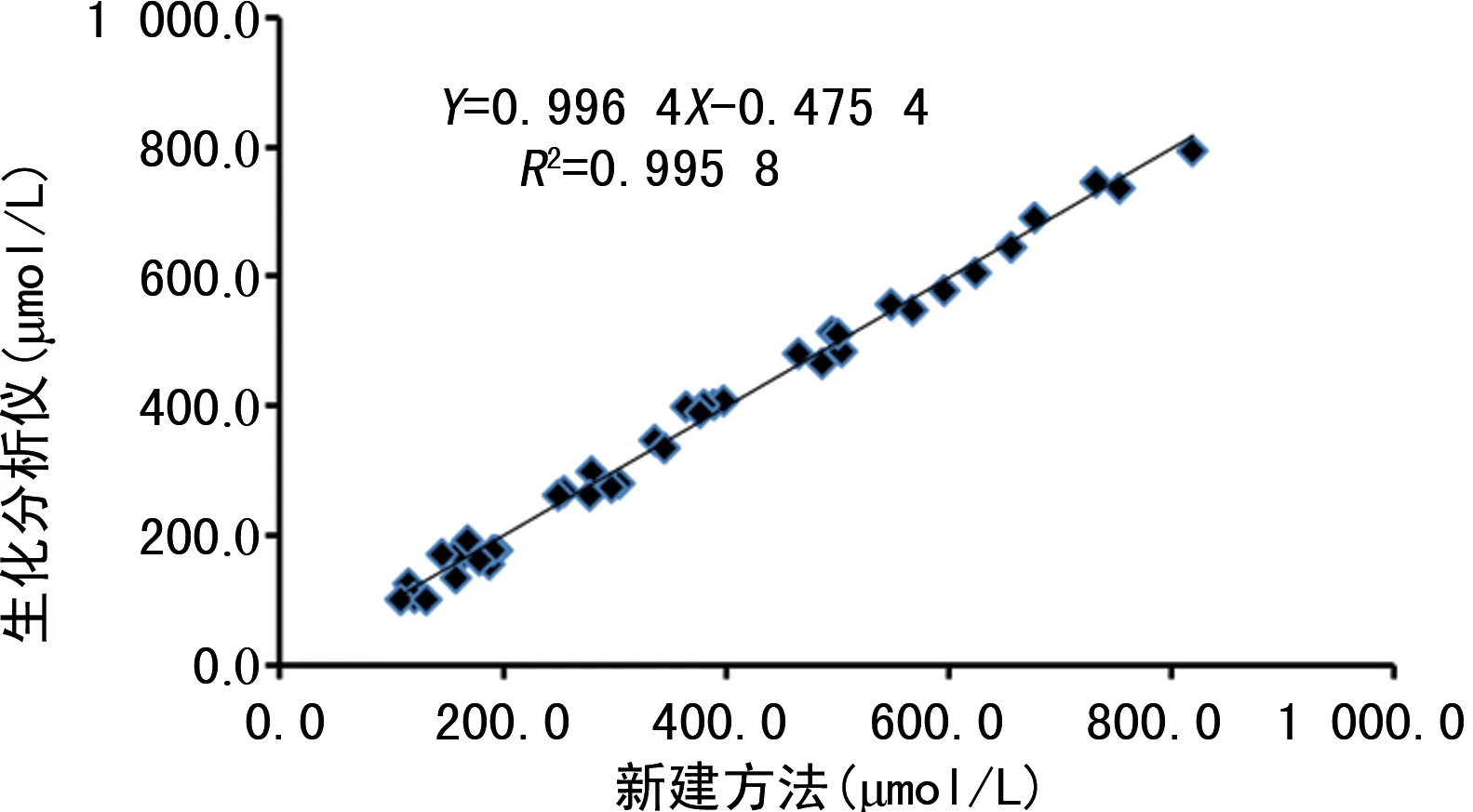
圖3 新建方法與生化分析儀檢測結果比對
3 討 論
納米材料模擬酶與天然酶具有一定的相似性,而與天然酶相比,其具有可通過化學手段批量合成、制備工藝簡單、穩定性好、便于運輸和長期儲存、適合進行化學修飾和改性等優點。因此,納米材料模擬酶的研究受到越來越多的關注,如四氧化三鐵磁性納米粒子(Fe3O4MNPs)、貴金屬納米粒子、碳基納米材料等被發現具有過氧化物酶活性[11],并被應用到生物傳感、免疫分析、癌癥診斷與治療、神經保護、環境治理等領域。該檢測體系是基于尿酸酶-MCA-Pd NPs建立起來的,MCA-Pd NPs具有強的過氧化物酶活性,促進體系中產生的過氧化氫分解成羥基自由基,再進一步將底物ABTS2-氧化為顯綠色的自由基ABTS·-,液體由無色轉變成綠色,在420 nm處有最大的吸收峰,MCA-Pd NPs在檢測體系中發揮著促進信號產生及傳遞的作用,而尿酸酶對它的底物有嚴格的選擇性,專一催化UA發生化學反應[12],因此,在專一性試驗時,將臨床常規檢測中與UA采用相同檢測原理的葡萄糖和膽固醇類物質作為對照,結果得到的吸光度值都很低,說明該方法用于UA檢測幾乎不受這類物質的干擾,確保了體系檢測UA的高選擇性。
FANG等[13]和LONG等[14]應用同樣具有過氧化物酶活性的雙摻NaYF4納米粒子進行尿酸酶催化比色法檢測,檢測限分別低至5.79、6.7 μmol/L,而本研究所建立檢測方法的測定下限只有50.0 μmol/L,與前者相比有一定差距,但是在實際臨床檢驗中,大部分的標本檢測結果是正常或者高值,低值尤其是<60.0 μmol/L的標本較少見,對低值的檢測臨床意義不大,而UA高值對臨床診斷痛風、高尿酸血癥等疾病及治療效果監測更有臨床意義,因此50.0 μmol/L的檢測下限也能滿足臨床的需要。
目前,臨床實驗室的大型生化分析儀普遍使用的是尿酸酶-過氧化物酶偶聯法進行血清UA的常規檢測,該方法采用的過氧化物酶為天然的植物酶,具有性質不穩定、在生物體水平較低、提純及儲存較困難等缺點,限制了它的實際應用。本研究建立的檢測體系與臨床大型生化分析儀有良好的可比性,而該檢測體系應用的納米材料模擬酶MCA-Pd NPs通過簡單的化學合成即可大量獲取,性質穩定,易于儲存,比天然酶更具有應用前景。此外,除UA外,目前臨床中還有許多常規檢驗項目如血糖、5′-核苷酶、總膽固醇、三酰甘油、高密度膽固醇和低密度膽固醇等都會用到過氧化物酶參與的檢測原理,只需將檢測體系中的尿酸酶換成其他特異酶如葡萄糖氧化酶等,即可對特定物質進行檢測,因此,該檢測體系具有靈活、簡便、檢測成本低、應用廣泛等實用價值。
本研究應用具有過氧化物酶活性的MCA-Pd NPs,建立基于尿酸酶-MCA-Pd NPs的血清UA濃度定量檢測方法,檢測選擇性高,線性范圍寬,重復性好,準確度高,能夠滿足臨床分析要求,與臨床常規測定血清UA水平的結果具有較好的可比性。

