膠質瘤與惡性腦膜瘤患者腫瘤組織ABCG2、IGFBP-2表達及預后的關系分析*
葉勇強,劉勝華,田必正,何 森,郝建強,謝 飛△
1.四川省資陽市第一人民醫院神經外科,四川資陽 641300;2.四川省三臺縣人民醫院神經外科,四川綿陽 621100;3.重慶市銅梁區人民醫院神經外科,重慶 402560
神經系統腫瘤種類較多,而神經上皮組織腫瘤在臨床上發病率最高,并且其分類及分型較為復雜,神經膠質瘤就是其中一種,膠質瘤起源于神經膠質細胞,包括星形細胞腫瘤、少突膠質細胞腫瘤及混合性膠質細胞腫瘤等,惡性度較高[1-2]。腦膜瘤多位于大腦矢狀竇和凸面旁,易導致偏癱等神經系統損傷癥狀,病程較短,且水腫明顯[2-3]。三磷酸腺苷結合轉運蛋白G超家族成員2(ABCG2)是膜轉運體ABC超家族成員,近年來被發現與多種良惡性腫瘤的發生、發展存在潛在關聯,且其還參與了腫瘤的耐藥[4]。胰島素樣生長因子結合蛋白-2(IGFBP-2)主要通過非胰島素樣生長因子依賴性和胰島素樣生長因子依賴性發揮生物學功能,能夠調節細胞增生、血管生成及細胞遷移,與膠質瘤的發生、發展關系密切[5-6]。本研究針對膠質瘤與腦膜瘤患者腫瘤組織ABCG2、IGFBP-2表達差異展開分析,并圍繞其對預后評價的臨床意義進行對比研究。
1 資料與方法
1.1一般資料 選取2015年1月至2018年6月在資陽市第一人民醫院確診為膠質瘤患者96例(膠質瘤組)及惡性腦膜瘤患者38例(惡性腦膜瘤組)作為受試對象。膠質瘤組中男54例,女42例;年齡為38~75歲,平均(56.57±18.32)歲。惡性腦膜瘤組中男23例,女15例;年齡為50~87歲,平均(68.45±17.93)歲。兩組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性。全部患者隨訪1年。納入標準:(1)臨床資料、病理學檢查確診為膠質瘤及惡性腦膜瘤的受試對象均于資陽市第一人民醫院接受手術治療;(2)在接受本研究前未接受過特殊的化療及放療;(3)接受本研究時不伴有顱腦外傷;(4)無其他長期的神經內科相關疾病病史。排除標準:(1)同時罹患其他器官系統惡性腫瘤或其他神經系統良惡性腫瘤及炎癥;(2)各種原因不能配合本次研究及隨訪。所有患者及其家屬均知情同意,并簽署知情同意書。本研究經資陽市第一人民醫院倫理委員會批準通過。
1.2儀器與試劑 鼠抗人ABCG抗體(美國Abcam生物公司,產品批號A-AJ1006a);IGFBP-2免疫組化試劑盒(福建中杉金橋生物技術有限公司,FREE-001);光學顯微鏡(北京世科信科學儀器有限公司,XSP-100SM)。
1.3方法 受試對象均接受手術治療,術中留取腫瘤組織標本,采用免疫組化法檢測96例膠質瘤患者和38例惡性腦膜瘤患者標本中ABCG2、IGFBP-2陽性細胞的表達,計算其陽性細胞百分率并劃分等級。免疫組化法檢測ABCG2蛋白表達水平。取制作好的4 μm組織切片,首先經二甲苯脫蠟后,以梯度乙醇脫水,自來水沖洗后磷酸緩沖鹽溶液(PBS)沖洗,滴加抗原修復液0.01 mol/L、pH6.0的檸檬酸緩沖液,自然冷卻后用PBS沖洗;以過氧化氫滴加,用來阻斷內源性過氧化物酶15 min;用PBS沖洗后滴加20%正常羊血清室溫下封閉30 min,傾去血清加鼠抗人ABCG抗體,工作濃度1∶30;按說明書完成測定,并進行結果判定。ABCG2的免疫結果判定:ABCG2主要在細胞膜表達,以細胞膜出現棕黃色高出背景色為陽性細胞。隨機選取5個高倍視野,進行陽性、陰性細胞計數,陽性細胞百分率=陽性細胞數/(陽性細胞數+陰性細胞數)×100%。陽性級別分為3個等級:Ⅰ級陰性,陽性細胞百分率為0%;Ⅱ級陽性,陽性細胞百分率為>0%~10%;Ⅲ級強陽性,陽性細胞百分率>10%。
IGFBP-2檢測嚴格按照免疫組化試劑盒說明書進行操作,方法同上。一抗為羊抗人 IGFBP-2單克隆抗體(美國Santa Cruz生物技術公司),工作濃度1∶400。在4 ℃下進行孵育過夜,用S-P即用型試劑盒染色。在光鏡(北京世科信科學儀器有限公司,XSP-100SM)下出現胞質和胞膜粗細一致的棕黃色顆粒即為陽性。每張切片隨機觀察3個高倍鏡視野,分別計數100個細胞,通過陽性腫瘤細胞的百分率分級:Ⅰ級陰性,見極少或無陽性腫瘤細胞(0%~<10%);Ⅱ級陽性(+),陽性細胞百分率10%~<30%;Ⅲ級陽性(++),陽性細胞百分率30%~<60%;Ⅳ級強陽性(+++),陽性細胞百分率≥60%。將ABCG2陰性和陽性患者作為低表達ABCG2組,將ABCG2強陽性患者作為高低表達ABCG2組。將IGFBP-2陰性和陽性(+)患者作為低表達IGFBP-2組,將IGFBP-2陽性(++)和強陽性(+++)患者作為高表達IGFBP-2組。研究隨訪受試對象1年,收集期間預后復發率和病死率,分析其與分級的相關性。并收集患者出現不良事件(死亡、神經功能中度缺損)的情況。
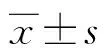
2 結 果
2.1受試對象腫瘤組織ABCG2、IGFBP-2表達分布 膠質瘤患者與惡性腦膜瘤患者ABCG2的表達分布具有相似性,主要分布于腫瘤細胞的細胞膜,胞質也有少部分表達,為棕黃色,陽性表達細胞有沿血管分布的傾向,級別越高,陽性表達細胞越多。見圖1。膠質瘤患者與惡性腦膜瘤患者IGFBP-2表達分布也具有相似性,在胞質和胞膜均有表達,為棕黃色,級別越高,陽性表達細胞越多。見圖2。
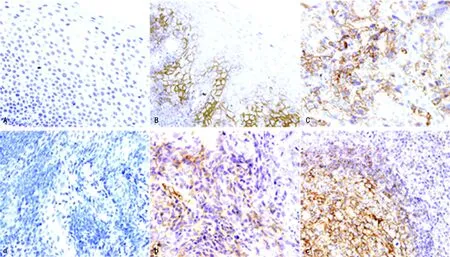
注:A為膠質瘤患者腫瘤組織中ABCG2陰性免疫組化結果,B為膠質瘤患者腫瘤組織中ABCG2陽性免疫組化結果,C為膠質瘤患者腫瘤組織中ABCG2強陽性免疫組化結果;a為惡性腦膜瘤患者腫瘤組織中ABCG2陰性免疫組化結果,b為惡性腦膜瘤患者腫瘤組織中ABCG2陽性免疫組化結果,c為惡性腦膜瘤患者腫瘤組織中ABCG2強陽性免疫組化結果。

注:A為膠質瘤患者腫瘤組織中IGFBP-2陰性免疫組化結果,B為C為膠質瘤患者腫瘤組織中IGFBP-2陽性(+)免疫組化結果,C為膠質瘤患者腫瘤組織中IGFBP-2陽性(++)免疫組化結果,D為膠質瘤患者腫瘤組織中IGFBP-2強陽性(+++)免疫組化結果;a為惡性腦膜瘤患者腫瘤組織中IGFBP-2陰性免疫組化結果,b為惡性腦膜瘤患者腫瘤組織中IGFBP-2 Ⅱ級陽性(+)免疫組化結果,c為腦膜瘤患者腫瘤組織中IGFBP-2陽性(++)免疫組化結果,d為腦膜瘤患者腫瘤組織中IGFBP-2強陽性(+++)免疫組化結果。
2.2兩組腫瘤組織ABCG2、IGFBP-2陽性細胞百分率及分級比較 膠質瘤組腫瘤組織ABCG2、IGFBP-2總陽性率與惡性腦膜瘤組比較,差異有統計學意義(P<0.05)。見表1。

表1 兩組腫瘤組織ABCG2、IGFBP-2陽性細胞百分率及分級比較[n(%)]
2.3兩組隨訪預后情況比較 膠質瘤組隨訪中復發率和病死率與惡性腦膜瘤組比較,差異無統計學意義(P>0.05)。見表2。
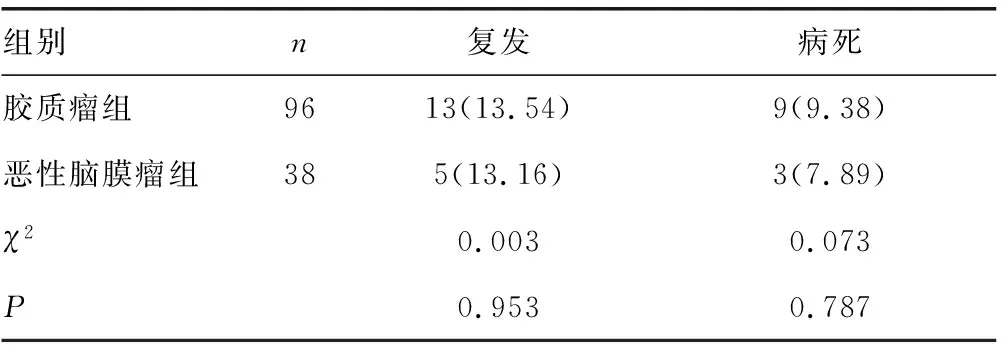
表2 兩組隨訪預后情況比較[n(%)]
進一步分析兩組患者腫瘤組織ABCG2、IGFBP-2表達與預后之間的關聯,兩組患者均可見與ABCG2、IGFBP-2表達陰性者比較,隨著陽性細胞百分率的增加,患者復發率與病死率也逐級升高。見表3、4。

表3 兩組腫瘤組織ABCG2、IGFBP-2表達與復發預后之間關系
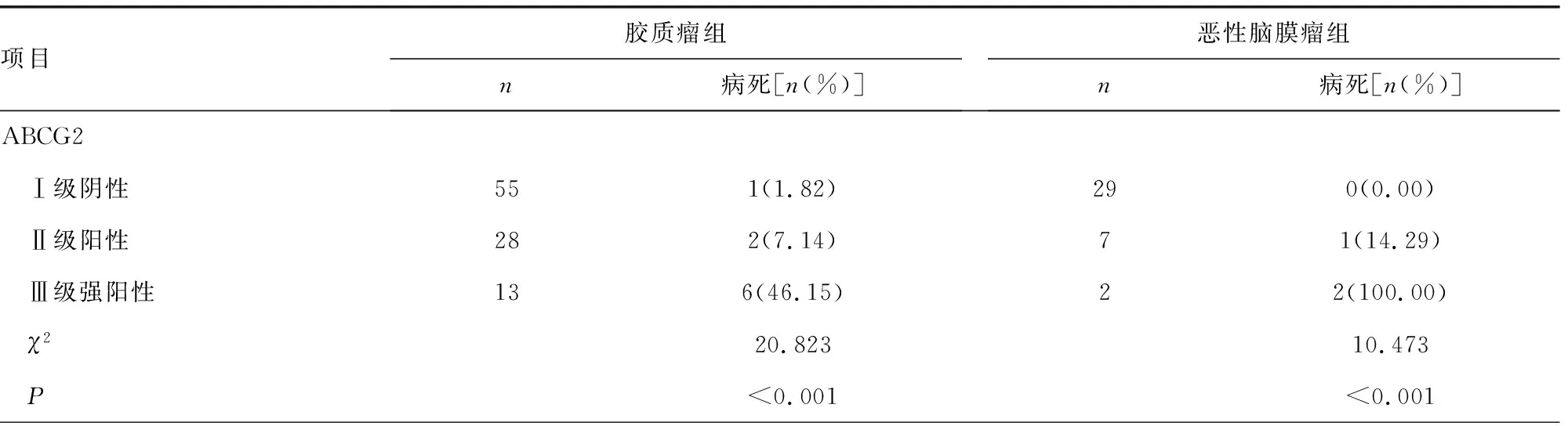
表4 兩組腫瘤組織ABCG2、IGFBP-2表達與病死預后之間關系

續表4 兩組腫瘤組織ABCG2、IGFBP-2表達與病死預后之間關系
2.4兩組患者不同ABCG2、IGFBP-2表達分布對預后的生存曲線分析 隨訪過程中,ABCG2高表達患者出現不良事件(死亡、神經功能中度缺損)的時間提前于ABCG2低表達患者(χ2=13.660,P<0.05)。見圖3。隨訪過程中,IGFBP-2高表達患者出現不良事件(死亡、神經功能中度缺損)時間提前于IGFBP-2低表達患者(χ2=19.266,P<0.05)。見圖4。
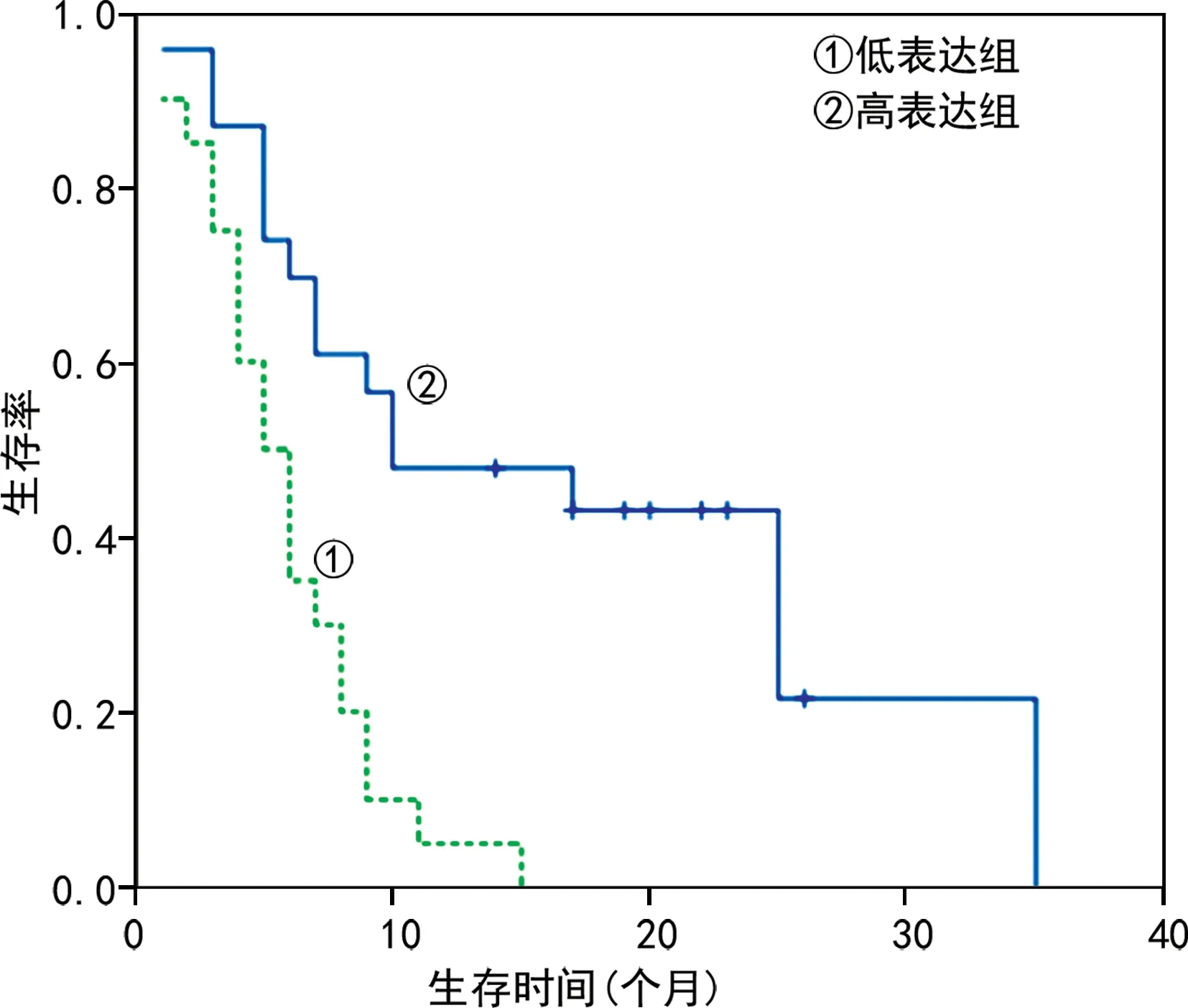
圖3 不同ABCG2表達組患者預后情況的生存曲線
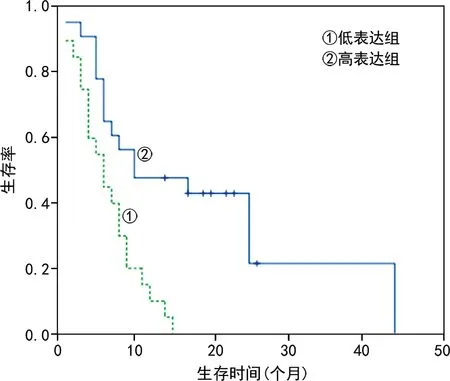
圖4 不同IGFBP-2表達組患者預后情況的生存曲線
3 討 論
膠質瘤與惡性腦膜瘤在神經系統腫瘤病理變化基礎存在相似性,但治療與預后不盡相同,臨床上需注意鑒別診斷[7-8]。ABCG2作為一種轉運蛋白,其表達和功能發揮與體內外環境因素密切關聯,隨著干細胞研究的深入,不少研究發現,其參與了干細胞特性S-P表型的形成,而且與多種惡性腫瘤的發生及腫瘤干細胞的多藥抗性密切聯系[9-10]。ABCG2也可使腦腫瘤干細胞處于未分化狀態,從而促使膠質瘤的惡性增殖[11]。同時,通過ABCG2轉運蛋白的功能排除有害物質對腫瘤干細胞的傷害,對這類細胞也具有保護作用[12]。IGFBP-2在腦中的合成部位主要位于脈絡叢及微血管系統中[13-14]。多種中樞神經系統的惡性腫瘤患者均可見IGFBP-2表達上調,腦脊液中 IGFBP-2可作為診斷惡性中樞神經系統腫瘤的一個特異性標志物。此外,IGFBP-2 陽性表達與腫瘤的惡性程度相關,可以提示腫瘤,特別是膠質瘤的惡性發展過程[15]。
近年來,已有研究發現ABCG2可能會影響成年人短期和長期記憶、精神運動功能、睡眠質量和情緒[14]。而在膠質瘤患者中,當其遇到壓力或情緒事件時,應激反應激活藍斑神經元,導致ABCG2與杏仁核協同促進去甲腎上腺素能系統在海馬體中的釋放,從而加強了記憶形成。而IGFBP-2阻斷了去甲腎上腺素與杏仁核、海馬內β腎上腺素能受體的結合,從而影響這兩個區域的功能[5]。高級神經功能是神經系統腫瘤預后觀測的重要指標,ABCG2和IGFBP-2可以有效影響患者的記憶、情感等功能。
本研究結果發現,膠質瘤和惡性腦膜瘤組織中ABCG2和IGFBP-2其分布具有相似性,ABCG2多分布于細胞膜,且陽性細胞多沿血管分布,IGFBP-2多分布于細胞質和細胞膜中。膠質瘤組腫瘤組織ABCG2、IGFBP-2總陽性率與惡性腦膜瘤組比較,差異有統計學意義(P<0.05)。這可能與惡性腦膜瘤的侵襲性遠低于神經膠質細胞瘤有關。生存分析曲線結果顯示,ABCG2、IGFBP-2高表達患者出現預后不良事件的時間普遍提前(P<0.05)。研究表明,ABCG2在膠質瘤中的表達隨著腫瘤惡性程度的升高而逐漸上調,IGFBP-2 的表達在膠質瘤和其他腫瘤類型中隨著腫瘤級別的增高而上調[16-19]。本研究同樣證實了這點,在ABCG2和IGFBP-2陽性細胞百分率較高的患者中,其腫瘤惡性程度可能也比較高,復發和病死情況也較多。提示隨著ABCG2和IGFBP-2陽性細胞百分率的增加,膠質瘤和惡性腦膜瘤患者的預后均更差。本研究發現,ABCG2和IGFBP-2對術前膠質瘤和惡性腦膜瘤的惡性程度具有預測價值,并聯合影像學檢查綜合判斷,有助于術中對病變性質、切除范圍大小的判斷,對臨床早期評估預后具有一定作用,但其具體的生物學功能和機制尚有待進一步研究,可延長隨訪時間,增加樣本量,對ABCG2和IGFBP-2兩項指標的遠期預測效能進行評估,減少混雜因素的影響,以期更進一步說明ABCG2和IGFBP-2兩項指標的預測價值。

