食管癌浸潤深度相關危險因素分析
丁丹丹,周英發,黃琳凱
(鄭州大學第二附屬醫院消化內科,河南 鄭州 450014)
在全球范圍內,食管癌的發病率和死亡率分別位居全部惡性腫瘤的第七位和第六位,我國是食管癌的高發地區之一[1]。食管癌分為食管鱗狀細胞癌(簡稱食管鱗癌)和食管腺癌,在我國食管癌病理類型以鱗癌為主,占比超過90%[2]。本研究中如無特殊指出均指食管鱗癌。然而早期食管癌癥狀隱匿,90%以上的首診都已是中晚期,治療費用高,患者預后差,早發現、早診斷是其根治性治療的關鍵[3]。早期食管癌浸潤深度不超過黏膜下層淺層(superficial submucosa,SM1)時可行內鏡下手術治療,而超過SM1則因其淋巴結轉移風險高,建議采用進展期食管癌的處理方式,因此準確判斷食管癌浸潤深度是選擇治療方法的重中之重[4]。全身炎癥性指標如血小板淋巴細胞比值(platelet to lymphocyte ratio,PLR)、中性粒細胞淋巴細胞比值(neutrophil to lymphocyte ratio,NLR)、淋巴細胞單核細胞比值(lymphocyte to monocyte ratio,LMR)與食管癌病理特征如T分級、M分級具有相關性[5]。術前白光內鏡下腫瘤長度與食管癌預后及腫瘤浸潤深度的相關性被廣泛研究[6]。本文通過對納入研究的174例患者的性別、年齡、腫瘤部位、腫瘤長度、術前PLR、NLR、LMR及術后病理診斷結果進行回顧性分析,旨在探討影響食管癌浸潤深度的危險因素,為食管癌浸潤深度提供更加準確的判斷方法。
1 資料與方法
1.1一般資料:回顧性分析2014年6月至2020年6月于鄭州大學第二附屬醫院行胃鏡+病理檢查確診為食管癌,并行手術治療的174例患者。記錄每位患者年齡、性別、白光內鏡下腫瘤長度、部位及術后病理診斷結果;每位患者術前均行血常規檢查,計算PLR、LMR及NLR。排除標準:①術前診斷食管癌遠處轉移;②術前出現大出血、感染、合并風濕免疫系統疾病等影響血常規結果的情況;③合并其他器官癌癥患者。
1.2方 法
1.2.1術后病理浸潤深度判斷:術后病理標本由病理科進行處理及診斷。浸潤層次分為:黏膜上皮層(epithelium M1)、黏膜固有層(lamina propria mucosae M2)、黏膜肌層(muscularis mucosae M3)、黏膜下層淺層(superficial submucosa,SM1)、黏膜下層深層(deep layer of submucosa,SM2-SM3)(SM1指病變浸潤黏膜下層上1/3,SM2指病變浸潤黏膜下層中1/3,SM3指病變浸潤黏膜下層下1/3。)固有肌層(muscularis propria MP)、漿膜層(adventitia AD),對于內鏡下切除的食管鱗癌標本,以200μm作為區分黏膜下淺層和深層浸潤的臨界值[7]。見圖1。
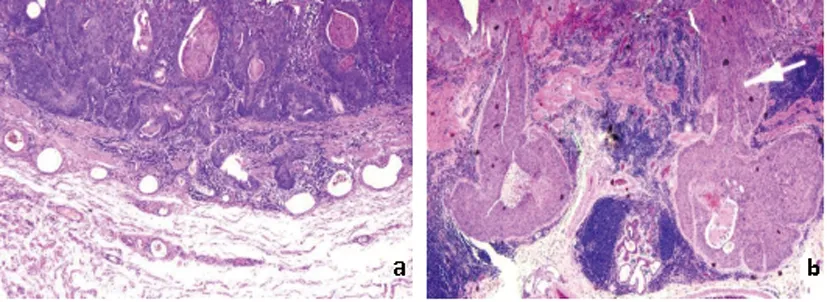
圖1 食管癌術后病理標本a:食管癌浸潤至粘膜下層淺層(HE X10) b:食管癌浸潤至粘膜下層深層,白色箭頭所指為癌細胞團 (HE X10)
1.2.2統計學方法:應用SPSS25.0軟件進行統計學分析。應用logistic回歸分析各變量與浸潤深度之間的相關性;根據logistic回歸和受試者工作特征曲線(Receiver operating characteristic curve,ROC曲線)計算最佳截距值及曲線下面積(area under curve,AUC)、敏感度、特異性等診斷指標;檢驗水準α=0.05,以P<0.05為差異有統計學意義。
2 結 果
2.1患者特征:共有174名患者入選(102名男性和72名女性),中位年齡為64歲(41~83歲)。臨床病理特征見表1。

表1 174名食管癌患者的一般特征
2.2各變量與浸潤深度的相關性:高PLR與食管癌浸潤深度相關,PLR每增加一個單位,食管癌浸潤深度超過SM1的概率增加1.017倍:(>SM1 vs ≤SM1:OR=1.017,95%CI=1.006~1.028,P=0.002)。腫瘤長度與食管癌浸潤深度相關,腫瘤長度每增加一個單位,腫瘤浸潤深度超過SM1的概率增加1.581倍:(>SM1 vs ≤SM1:OR=1.581,95%CI=1.234~2.024,P<0.001)。NLR(P=0.443)、LMR(P=0.323)、腫瘤部位(P=0.065)、年齡(P=0.418)、性別(P=0.621)與腫瘤浸潤深度不相關。見表2。
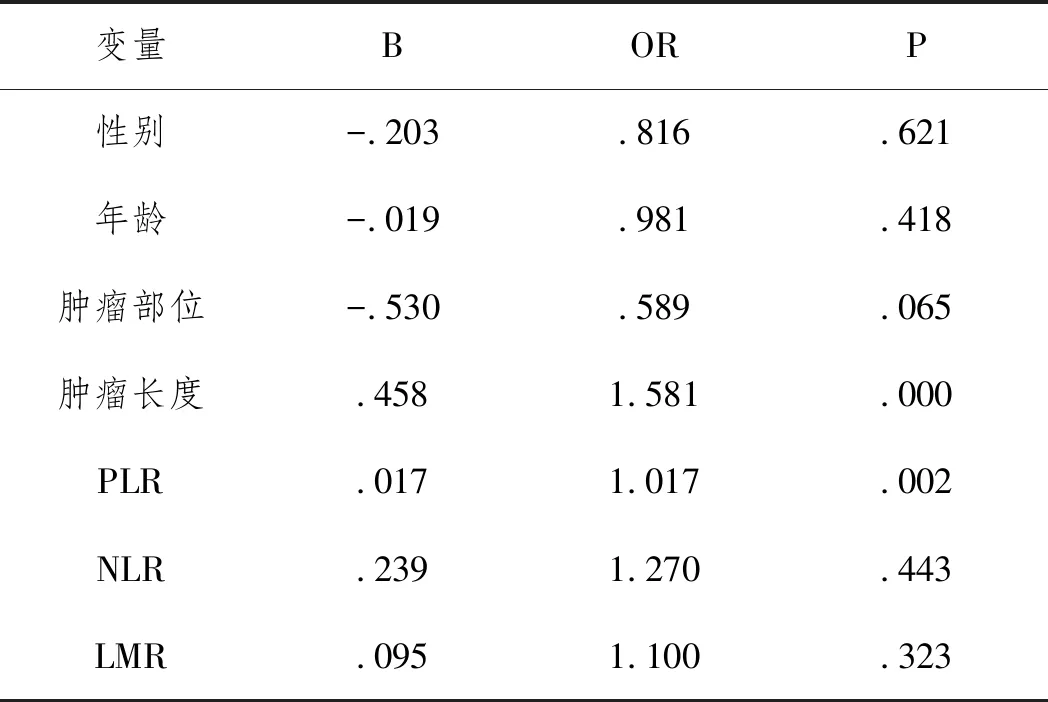
表2 各變量與食管癌浸潤深度的相關性
2.3PLR和腫瘤大小對食管癌浸潤深度的判斷:依據ROC曲線計算得PLR最佳截距值為145.47,AUC為0.74,95%CI:0.667~0.813,P<0.001;對浸潤深度>SM1的敏感度為0.495,特異性為0.883。腫瘤大小最佳截距值為3.1cm,AUC為0.796,95%CI:0.698~0.841,P<0.001;對浸潤深度>SM1的敏感度為0.722,特異性為0.714。兩者聯合診斷,AUC為0.812,95%CI:0.747~0.876,P<0.001;對浸潤深度>SM1的敏感度為0.866,特異性為0.61。見圖2。PLR和腫瘤長度在判斷食管癌浸潤深度中都具有較好的準確性,兩者聯合診斷,對浸潤深度>SM1的敏感度高達0.866,診斷準確性優于單獨檢測。見表3。
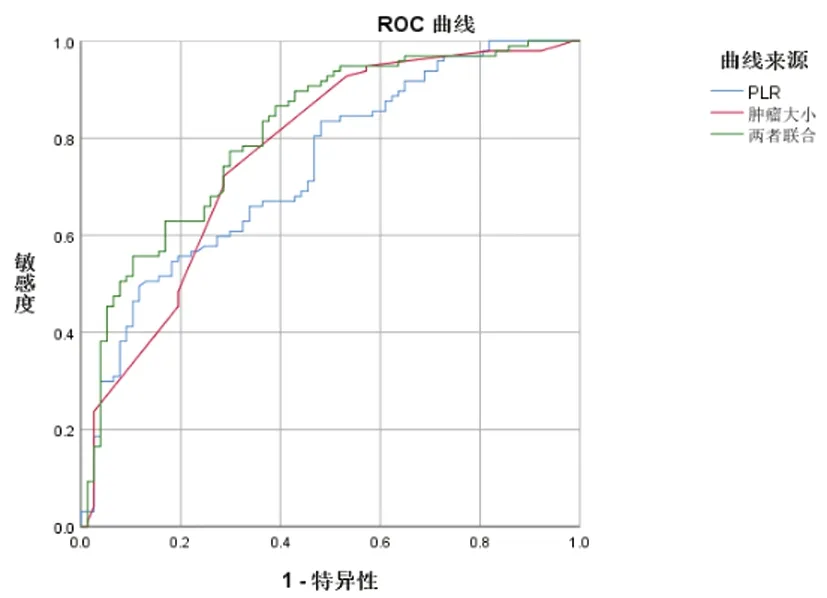
圖2 PLR、腫瘤長度及兩者聯合診斷食管癌浸潤深度ROC曲線
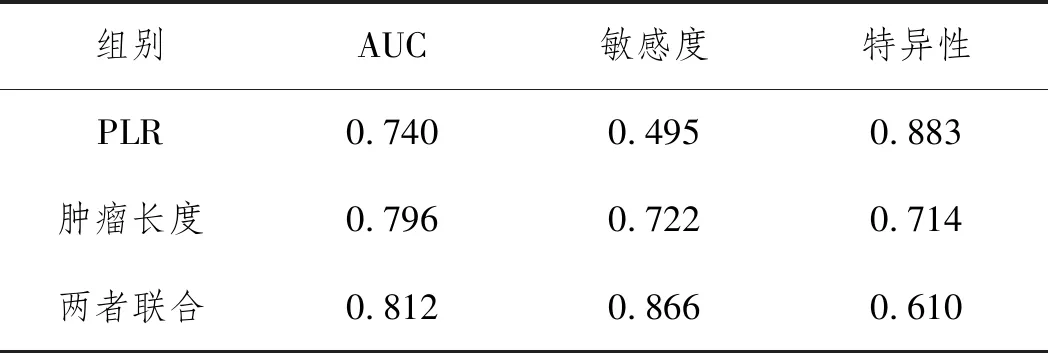
表3 PLR腫瘤長度及兩者聯合的AUC敏感度特異性比較
3 討 論
在1987年以前,美國癌癥聯合委員會(AJCC) TNM分期系統將食管腫瘤長度≤5cm劃分為T1,>5cm劃分為T2,在1987年版的AJCC TNM分期系統中,腫瘤長度被食管壁浸潤深度取代,這一變化是基于1969年至1980年日本食管癌登記數據庫,該數據庫顯示,腫瘤浸潤深度與食管鱗狀細胞癌患者10年生存率的相關性大于腫瘤的表面范圍大小。近年來腫瘤長度與食管癌預后及病理特征如T分級、N分級、M分級的相關性被廣泛研究。Arigami T[8]等人的研究顯示:腫瘤長度與腫瘤入侵深度(P<0.0001)、淋巴結轉移(P=0.0066)、靜脈入侵(P=0.0025)和腫瘤分期(P<0.0001)顯著相關。全身炎癥性指標PLR與食管癌之間的關系已被許多研究報道。Sun Y[9]等人的薈萃分析顯示:高PLR與入侵深度(P<0.001)、腫瘤長度(P<0.001)、淋巴結轉移(P =0.001)和腫瘤分期(P =0.001)相關。然而腫瘤長度和PLR用于診斷食管癌浸潤深度的研究少之又少。本研究從食管癌治療方式的選擇入手,標志性選用食管癌內鏡下切除適應癥的最大浸潤深度為界限,研究食管癌浸潤深度的相關危險因素,結果顯示:腫瘤長度與浸潤深度明顯相關(P<0.001),其診斷食管癌浸潤深度中,AUC為0.796,敏感度為0.722,特異性為0.714;高PLR與腫瘤浸潤深度相關(P=0.002),AUC為0.74,敏感度為0.495、特異性為0.883。兩者聯合診斷,AUC為0.812,敏感度為0.866,特異性為0.61。兩者聯合AUC和敏感度均高于單獨診斷,對浸潤深度>SM1的敏感度高達0.866,具有較好的診斷價值。
食管癌尤其是早期食管癌治療方式的選擇主要根據腫瘤浸潤深度,術前準確判斷浸潤深度對患者的治療方式選擇、生存質量、治療效果以及經濟獲益方面都有著重大的意義[10]。目前診斷腫瘤浸潤深度的方法主要有白光內鏡、超聲內鏡及電子染色放大內鏡[11]。本研究選用臨床極易獲得的病人參數:PLR和術前白光內鏡下腫瘤長度,探討其與腫瘤浸潤深度的關系,結果顯示PLR與術前白光內鏡下腫瘤長度是食管癌浸潤深度的危險因素;兩者聯合可進一步提高腫瘤浸潤深度判斷的準確性,具有良好的臨床應用價值。因此我們建議,把兩者聯合應用于食管癌浸潤深度的診斷,為治療方式的選擇提供更加可靠的依據。
但有一些限制也是不得不承認的。首先,本研究是回顧性設計,這不可避免會造成一些偏差。第二,本研究中樣本量不大,這些可能會影響結果的準確性:比如最佳截距值的界定,這在以后的研究中仍需大樣本的前瞻性研究進一步驗證。

