乙酰化白藜蘆醇對(duì)脂多糖誘導(dǎo)急性肺損傷中微循環(huán)修復(fù)作用機(jī)制探究
閆雪 崔蕊 熊曉毅 張敏龍
1咸陽(yáng)職業(yè)技術(shù)學(xué)院醫(yī)學(xué)院712000;2空軍軍醫(yī)大學(xué)唐都醫(yī)院呼吸科,西安710038
急性肺損傷是由多種因素 (如感染、創(chuàng)傷、休克、吸入理化物質(zhì)等)引起的以頑固性呼吸困難及低氧血癥為主要特征的一類肺部疾病,如未得到及時(shí)診治,會(huì)逐漸發(fā)展成為ARDS。感染是引起急性 肺 損 傷 最 常 見(jiàn) 的 因 素, 而 脂 多 糖(lipopolysaccharide,LPS)作為革蘭陰性菌細(xì)胞壁主要成分,是造成肺部感染的重要原因。多項(xiàng)研究表明,LPS誘導(dǎo)的急性肺損傷最主要的病理生理改變是肺組織水腫及肺泡炎癥反應(yīng)[1-2]。在多種類型的肺損傷中,肺微血管內(nèi)皮細(xì)胞通透性的增加是引起肺組織水腫及炎癥細(xì)胞滲透的關(guān)鍵改變[3]。而滲透至肺泡腔中的炎癥細(xì)胞被LPS激活后產(chǎn)生的炎癥因子又會(huì)進(jìn)一步加重肺組織的炎癥反應(yīng)[4-5]。因此,肺微血管內(nèi)皮細(xì)胞通透性的改變?cè)诜螕p傷形成過(guò)程中起到較為重要的作用。
白藜蘆醇是提取于葡萄及部分堅(jiān)果中的一種天然物質(zhì)。乙酰化白藜蘆醇是白藜蘆醇的前體藥物,其在藥代動(dòng)力學(xué)及生物利用度等方面均優(yōu)于白藜蘆醇。前期研究證實(shí),乙酰化白藜蘆醇能夠減輕其他類型引起的肺損傷及肺組織炎癥[6-7],但能否減輕LPS誘導(dǎo)的肺損傷及修復(fù)肺組織微循環(huán),仍需進(jìn)一步研究。
本研究通過(guò)大鼠及肺微血管內(nèi)皮細(xì)胞的LPS急性肺損傷模型,探究了乙酰化白藜蘆醇對(duì)LPS誘導(dǎo)的肺微循環(huán)損傷的修復(fù)作用及其相關(guān)機(jī)制。
1 材料與方法
1.1 實(shí)驗(yàn)動(dòng)物及分組 32 只健康雄性SD 大鼠,清潔級(jí),體質(zhì)量200 g左右,空軍軍醫(yī)大學(xué)實(shí)驗(yàn)動(dòng)物中心提供。采用完全隨機(jī)方法將實(shí)驗(yàn)大鼠分為4組:空白對(duì)照組、LPS 處理組、乙酰化白藜蘆醇預(yù)處理組、白藜蘆醇預(yù)處理組,每組8只。造模前1 h,空白對(duì)照組、LPS處理組大鼠分別以生理鹽水灌胃,乙酰化白藜蘆醇預(yù)處理組大鼠以150 mg/kg乙酰化白藜蘆醇灌胃,白藜蘆醇預(yù)處理組大鼠以150 mg/kg白藜蘆醇灌胃。LPS 處理組、乙酰化白藜蘆醇預(yù)處理組、白藜蘆醇預(yù)處理組制作LPS誘導(dǎo)的肺損傷模型,造模后采用放血法處死,收集肺組織標(biāo)本。動(dòng)物模型的制備:大鼠腹腔注射3%戊巴比妥鈉 (1.5 ml/kg)麻醉,仰臥固定位,頸正中切口暴露氣管,取1 ml注射器插入氣管,在4 min之內(nèi)緩慢注入5 mg/kg LPS混懸液。本實(shí)驗(yàn)經(jīng)空軍軍醫(yī)大學(xué)動(dòng)物倫理及使用委員會(huì)批準(zhǔn)。
1.2 細(xì)胞培養(yǎng)及處理 大鼠肺微血管內(nèi)皮細(xì)胞(rat pulmonary microvascular endothelial cells,RPMVECs)用含有100 U/ml青鏈霉素、25 mg/L內(nèi)皮生長(zhǎng)因子和20%胎牛血清的DMEM 培養(yǎng)基培養(yǎng)。LPS刺激前1 h,分別用200μmol/L 乙酰化白藜蘆醇和白藜蘆醇進(jìn)行預(yù)處理,之后用5 mg/L LPS處理細(xì)胞4 h。
1.3 實(shí)驗(yàn)試劑 乙酰化白藜蘆醇及白藜蘆醇由空軍軍醫(yī)大學(xué)生化教研室合成及提供,高效液相純度達(dá)到99%以上,乙酰化白藜蘆醇及白藜蘆醇用5‰羧甲基纖維素鈉溶液制成混懸液,灌胃給藥。LPS購(gòu)自美國(guó)Sigma公司,用生理鹽水制成混懸液后氣管內(nèi)滴注給藥。腫瘤壞死因子α (tumor necrosis factor-α,TNF-α)和IL-1β酶聯(lián)免疫吸附試驗(yàn)試劑盒購(gòu)于美國(guó)R&D 公司。FAK 和cofilin抗體購(gòu)于美國(guó)Cell Signaling公司,β-actin抗體購(gòu)于美國(guó)Santa Cruz公司。其他試劑均為國(guó)產(chǎn)或進(jìn)口分析純。
1.4 檢測(cè)指標(biāo)及方法
1.4.1 病理學(xué)檢查 取每組大鼠右下肺組織迅速放入4%多聚甲醛中固定24 h,脫水,然后進(jìn)行石蠟包埋并切片,HE染色,光學(xué)顯微鏡觀察。
1.4.2 肺組織濕/干重比值及肺組織通透性檢測(cè) 取各組大鼠相同部位肺組織,用濾紙擦拭血跡后稱重為肺濕重,將標(biāo)本置于70 ℃烘箱中72 h 至恒重,稱量干重,計(jì)算濕/干重比值。肺組織通透性檢測(cè)采用伊文思藍(lán)方法。大鼠麻醉前30 min將伊文思藍(lán)溶液 (20 mg/kg)注入到靜脈中,實(shí)驗(yàn)結(jié)束后,用生理鹽水注入大鼠右心室沖血管,直至左心房流出液變清。取下右肺中葉并在60 ℃下烘干72 h,然后室溫下用多聚甲醛浸泡24 h提取伊文思藍(lán),用分光光度計(jì) (620 nm)檢測(cè)上清液伊文思藍(lán)濃度。
1.4.3 TNF-α和IL-1β檢測(cè) 采用酶聯(lián)免疫吸附試驗(yàn)法檢測(cè)肺組織勻漿中的TNF-α和IL-1β的含量,具體步驟嚴(yán)格按照試劑盒說(shuō)明書(shū)操作。
1.4.4 蛋白質(zhì)印跡法檢測(cè)FAK 和cofilin相關(guān)蛋白表達(dá) 取相同位置適量的肺組織,加入蛋白裂解液于冰上進(jìn)行勻漿,離心并收集上清液,定量,用沸水煮15 min,電泳并轉(zhuǎn)膜。封閉2 h,加入1∶1 000稀釋的一抗,4 ℃過(guò)夜,然后加入1∶5 000稀釋二抗,37℃溫育1 h,ECL顯色,避光保存并照相,做灰度掃描處理。
1.4.5 免疫熒光觀察RPMVECs細(xì)胞骨架變化 進(jìn)行細(xì)胞爬片,處理后的細(xì)胞用4%多聚甲醛固定10 min,0.1% Triton X-100 穿透10 min,然后2%血清封閉30 min,加入熒光標(biāo)記的Alexa488-Phalloidin 并在室溫下避光孵育60 min,最后DAPI染核,封片,熒光顯微鏡觀察照相。
1.5 統(tǒng)計(jì)學(xué)分析 采用SPSS 16.0軟件進(jìn)行統(tǒng)計(jì)學(xué)分析。全部數(shù)據(jù)以±s表示,組間差異比較采用單因素方差分析。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 病理改變、肺濕/干重比值及肺組織通透性改變 與空白對(duì)照組比較,LPS 組大鼠肺組織結(jié)構(gòu)出現(xiàn)紊亂,肺間質(zhì)可見(jiàn)出血、滲出,并可見(jiàn)炎癥細(xì)胞浸潤(rùn),且肺濕/干重比值及肺組織通透性明顯增加(P值均<0.01);與LPS 組比較,乙酰化白藜蘆醇和白藜蘆醇預(yù)處理組大鼠肺組織結(jié)構(gòu)尚清晰,間質(zhì)滲出、出血和炎細(xì)胞浸潤(rùn)等改變明顯減輕,肺濕/干重比值及肺組織通透性也顯著減輕(P<0.01或P<0.05),且乙酰化白藜蘆醇預(yù)處理組減輕更為明顯。見(jiàn)圖1~3。
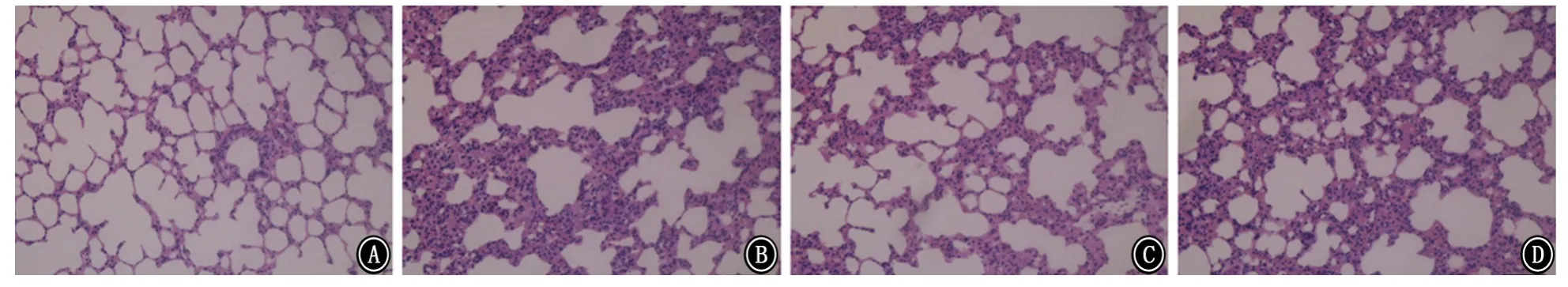
圖1 各組大鼠肺組織病理表現(xiàn) A:空白對(duì)照組;B:脂多糖組;C:乙酰化白藜蘆醇預(yù)處理組;D:白藜蘆醇預(yù)處理組 HE ×200
2.2 肺組織炎癥因子表達(dá)的改變 與空白對(duì)照組比較,LPS組大鼠肺組織中TNF-α和IL-1β均明顯增加 (P值均<0.01);與LPS 組比較,乙酰化白藜蘆醇和白藜蘆醇預(yù)處理組大鼠肺組織中TNF-α和IL-1β的增加出現(xiàn)了顯著的抑制 (P值均<0.01),且乙酰化白藜蘆醇預(yù)處理組更為明顯。見(jiàn)圖4、5。
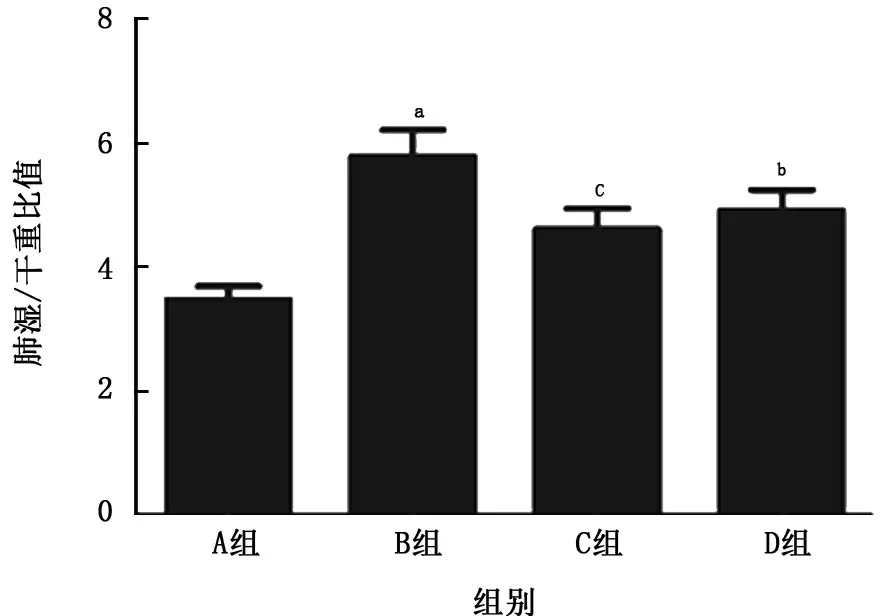
圖2 各組大鼠肺組織濕/干重比值的比較
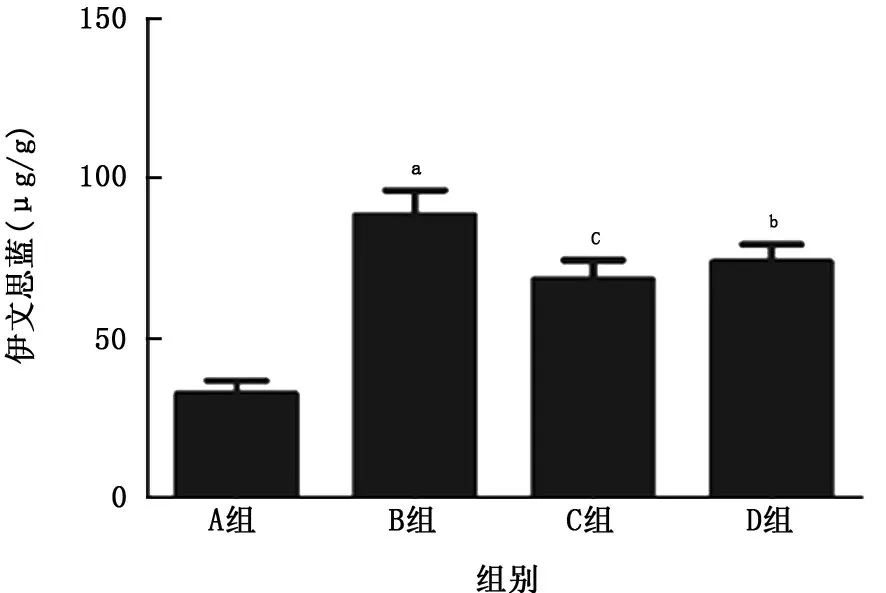
圖3 各組大鼠肺組織通透性的比較
2.3 大鼠肺組織FAK-cofilin通路改變 與空白對(duì)照組比較,LPS組大鼠肺組織中FAK 及其下游cofilin均出現(xiàn)了明顯的激活(磷酸化)(P值均<0.01);與LPS組比較,乙酰化白藜蘆醇和白藜蘆醇預(yù)處理組大鼠肺組織中FAK-cofilin的激活出現(xiàn)了顯著的抑制(P值均<0.01),且乙酰化白藜蘆醇預(yù)處理組更為明顯(圖6)。
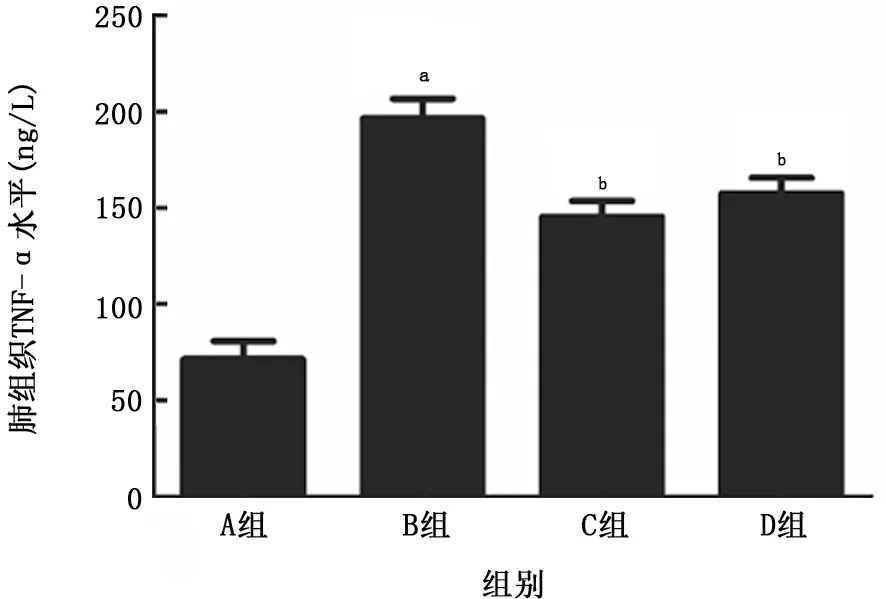
圖4 各組大鼠肺組織中TNF-α水平的比較
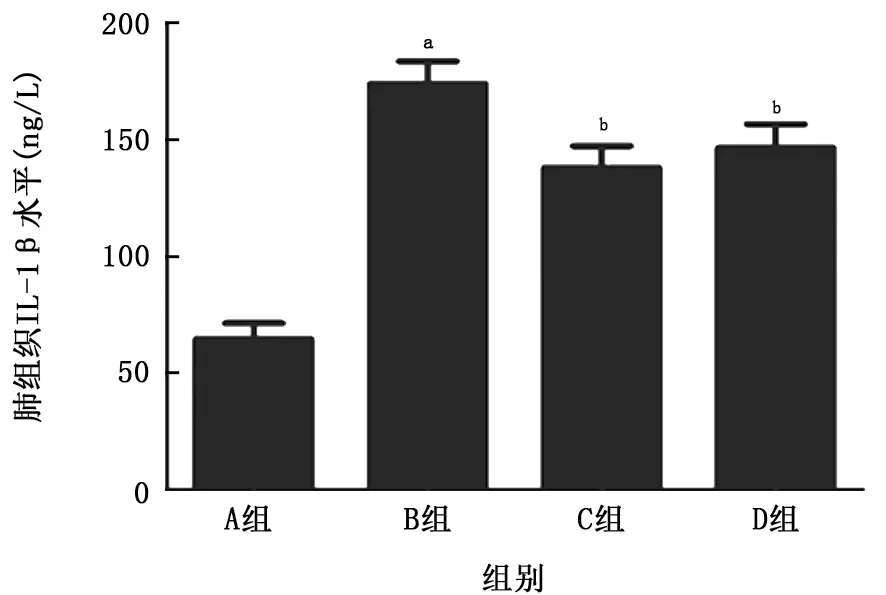
圖5 各組大鼠肺組織中IL-1β水平的比較
2.4 RPMVECs中FAK-cofilin 通路改變 與空白對(duì)照組比較,LPS組RPMVECs中FAK 及其下游cofilin均出現(xiàn)了明顯的激活 (磷酸化) (P值均<0.01);與LPS組比較,乙酰化白藜蘆醇和白藜蘆醇預(yù)處理組RPMVECs中FAK-cofilin的激活出現(xiàn)了顯著的抑制(P值均<0.01),且乙酰化白藜蘆醇預(yù)處理組更為明顯(圖7)。
2.5 RPMVECs細(xì)胞骨架的改變 與空白對(duì)照組比較,LPS組RPMVECs中細(xì)胞骨架蛋白出現(xiàn)了聚集,細(xì)胞間縫隙增大;與LPS 組比較,乙酰化白藜蘆醇和白藜蘆醇預(yù)處理組RPMVECs中細(xì)胞骨架蛋白聚集現(xiàn)象出現(xiàn)了較為明顯的抑制,且乙酰化白藜蘆醇預(yù)處理組更為明顯(圖8)。
3 討論
LPS誘導(dǎo)的急性肺損傷最主要的病理生理改變是肺組織水腫及肺泡炎癥反應(yīng)。LPS 作用于肺組織屏障后(肺微血管內(nèi)皮細(xì)胞及上皮細(xì)胞),引起肺組織屏障的損傷及細(xì)胞間隙的增加,最終導(dǎo)致水腫液及炎癥細(xì)胞滲出到肺泡組織中,進(jìn)一步引起肺組織炎癥[8-9]。在本研究中,筆者觀察到LPS作用后,大鼠肺泡中伴有出血、水腫以及大量炎細(xì)胞浸潤(rùn),炎癥因子的表達(dá)也增高。同時(shí),LPS 作用后引起了肺組織通透性增加,且通透性增加是通過(guò)細(xì)胞骨架重構(gòu)引起。此外,該作用是通過(guò)FAKcofilin信號(hào)通路的激活達(dá)成。通過(guò)乙酰化白藜蘆醇的預(yù)處理,肺水腫和炎癥反應(yīng)得到了一定程度的減輕,同時(shí)肺組織通透性也得到了改善;在細(xì)胞層面,乙酰化白藜蘆醇減輕了LPS誘導(dǎo)的細(xì)胞骨架重構(gòu),并且抑制了FAK-cofilin信號(hào)通路的激活。

圖6 各組大鼠肺組織FAK-cofilin通路激活情況 A:電泳圖;B:FAK 蛋白表達(dá)柱狀圖;C:cofilin蛋白表達(dá)柱狀圖
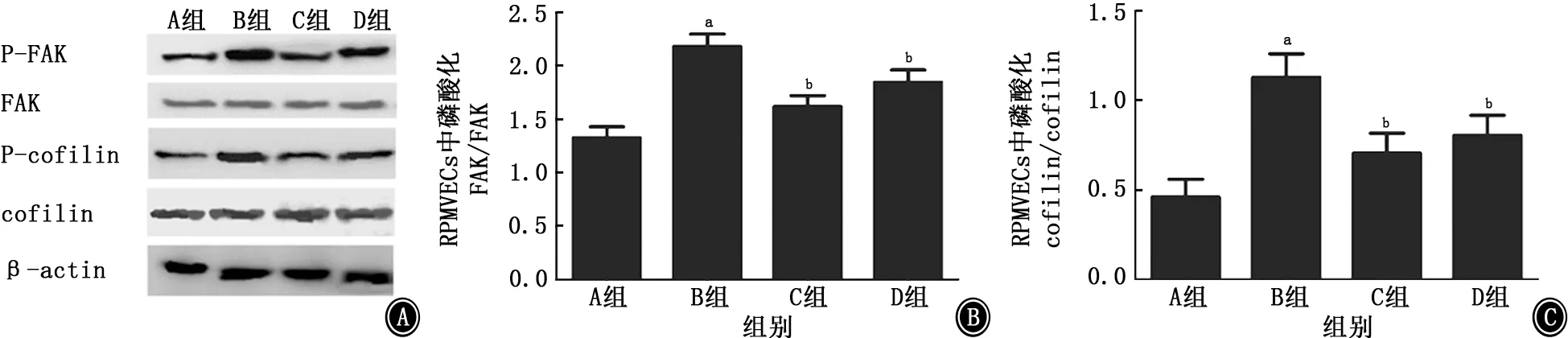
圖7 各組RPMVECs中FAK-cofilin通路激活情況 A:電泳圖;B:FAK 蛋白表達(dá)柱狀圖;C:cofilin蛋白表達(dá)柱狀圖
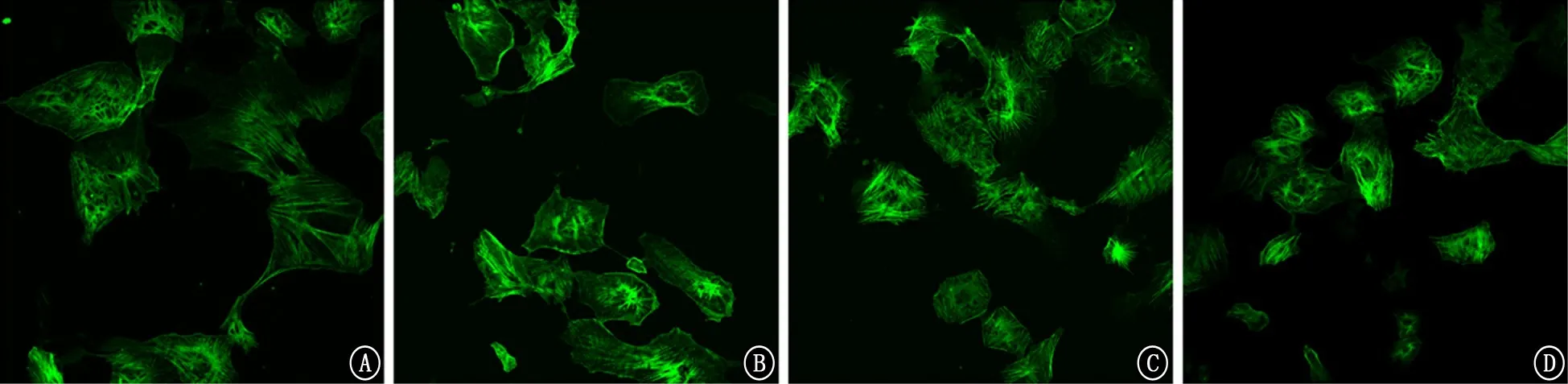
圖8 各組大鼠肺微血管內(nèi)皮細(xì)胞中細(xì)胞骨架的改變情況 A:空白對(duì)照組;B:脂多糖組;C:乙酰化白藜蘆醇預(yù)處理組;D:白藜蘆醇預(yù)處理組
目前急性肺損傷的相關(guān)治療仍集中在機(jī)械通氣、吸氧、物理排痰、抗感染等對(duì)癥治療方面。盡管有很多藥物也應(yīng)用于LPS誘導(dǎo)的急性肺損傷和ARDS (如糖皮質(zhì)激素可促進(jìn)炎癥及水腫吸收),但這些治療并沒(méi)有明顯的降低死亡率,同時(shí)也沒(méi)有較為特效的治療藥物。乙酰化白藜蘆醇是白藜蘆醇的前體物質(zhì),其應(yīng)用于機(jī)體后,通過(guò)代謝分解,會(huì)在肺組織中存在較高濃度的白藜蘆醇[10-12]。白藜蘆醇此前已經(jīng)證實(shí)其有預(yù)防腫瘤、抗氧化以及抗炎等重要作用。但白藜蘆醇作為藥物有著自身缺陷,比如存在半衰期短、生物利用度低等問(wèn)題。因此,乙酰化后的白藜蘆醇很好地解決了現(xiàn)有的問(wèn)題。
肺微循環(huán)在肺損傷的形成中起到了重要作用。大量的研究表明,多種因素造成的肺損傷中存在肺組織微血管通透性的增加,從而進(jìn)一步使血液中的液體及炎癥細(xì)胞滲入到肺泡中,最終在肺泡中聚集,引起肺組織炎癥反應(yīng),造成更多的損傷。因此,對(duì)于肺組織微循環(huán)的修復(fù)是肺損傷治療的重要方向。在本研究中也發(fā)現(xiàn)了 LPS 作用于RPMVECs后,細(xì)胞骨架結(jié)構(gòu)產(chǎn)生改變,細(xì)胞間隙增加,造成了水腫液及炎癥細(xì)胞大量的滲漏,從而加重肺組織炎癥。乙酰化白藜蘆醇作用后,減輕了LPS造成的肺組織水腫以及炎癥反應(yīng),且效果顯著優(yōu)于白藜蘆醇的作用。FAK 是局灶性黏附復(fù)合物的關(guān)鍵成分,它將細(xì)胞內(nèi)黏著斑與胞質(zhì)信號(hào)通路聯(lián)系起來(lái),而FAK 分子的磷酸化能夠調(diào)節(jié)細(xì)胞骨架的改變。cofilin是一種肌動(dòng)蛋白結(jié)合蛋白,在肌動(dòng)蛋白重組中有重要作用。研究表明cofilin 能夠被FAK 激活,起到調(diào)節(jié)細(xì)胞骨架結(jié)構(gòu)的作用[13-14]。在本研究中,LPS 的刺激引起了肺組織及RPMVECs中FAK-cofilin的激活,同時(shí)也引起了細(xì)胞骨架的聚集,導(dǎo)致細(xì)胞間隙增加。而乙酰化白藜蘆醇的作用能夠抑制FAK-cofilin的激活,同時(shí)能夠抑制細(xì)胞骨架蛋白的聚集及細(xì)胞間隙的增加。這些結(jié)果部分地解釋了乙酰化白藜蘆醇在LPS誘導(dǎo)的肺損傷中的作用機(jī)制,且上述實(shí)驗(yàn)證實(shí)了對(duì)于LPS肺損傷微循環(huán)的改善,乙酰化白藜蘆醇的效果要明顯優(yōu)于其前體物質(zhì)白藜蘆醇,同時(shí)也為乙酰化白藜蘆醇的臨床應(yīng)用提供了實(shí)驗(yàn)依據(jù)。
利益沖突所有作者均聲明不存在利益沖突

